El tratamiento conservador de la infección de los injertos vasculares protésicos se asocia con una alta mortalidad

Introducción
La infección del injerto protésico después de la reconstrucción vascular es una complicación rara pero devastadora y potencialmente mortal [1]. A pesar del éxito cada vez mayor obtenido con los dispositivos endovasculares, el Dacron (DuPont, Wilmington DE) y el politetrafluoroetileno son aún empleados de manera rutinaria en la reparación abierta tanto de los aneurismas como de la enfermedad aterosclerótica oclusiva. Se han tomado diferentes medidas para prevenir el desarrollo de una infección protésica, tales como el uso de antibióticos profilácticos perioperatorios, evitar las incisiones inguinales, adhesión a la esterilidad y el uso de injertos protésicos sintéticos que tienen ya sea rifampicina adherida o que están recubiertos con plata. No obstante, los injertos protésicos siguen siendo sensibles a la infección. Se ha reportado que la incidencia de infección en los injertos va desde el 0,6% al 3%, con una tasa de mortalidad oscilando entre el 5% y el 25% [1-4]. Aunque se han publicado varios estudios, reportando principalmente series pequeñas de infecciones protésicas, no existen guías claras en relación con el manejo diagnóstico y terapéutico. Tradicionalmente, el tratamiento de la infección protésica del injerto ha incluido antibióticos, resección de la prótesis infectada y bypass extra-anatómico, cuando está indicado [5-7].
Este estudio retrospectivo fue realizado para analizar las características clínicas, abordajes diagnósticos, estrategias terapéuticas y resultados de esta terrible complicación. El objetivo primario fue determinar si existen factores predictivos de la mortalidad.
Métodos
Entre enero de 1997 y diciembre de 2007, un total de 56 pacientes con antecedentes de reconstrucción vascular fueron admitidos por infecciones de los injertos en el centro terciario de derivación de los autores. Las infecciones de los injertos protésicos periféricos (3 femoro-femorales y 7 femoropoplíteos) y de los shunts arteriovenosos para diálisis, fueron excluidos de este estudio. Además, 2 pacientes con endoinjertos infectados fueron excluidos del análisis ulterior. Un total de 44 pacientes con infecciones de injertos protésicos centrales fueron los sujetos de este estudio retrospectivo. Las comorbilidades de los pacientes fueron definidas como lo recomienda el Ad Hoc Committee on Reporting Standars [8]. La enfermedad renal fue definida como un nivel de creatinina sérica de 2,5 a 5,9 mg/dL, un nivel de creatina > 6,0 mg/dL o diálisis o transplante renal. El diagnóstico de infección del injerto se basó en los siguientes criterios: (1) evidencia clínica de infección (por ejemplo, dolor, fiebre, edema y elevación de los parámetros de infección); (2) evidencia de infección del injerto en la tomografía computada (TC), resonancia magnética nuclear (RMN), gammagrafía de glóbulos blancos o tomografía de emisión de positrones (PET por positron emisión tomography) con F18-fluorodesoxiglucosa combinada con TC; (3) hallazgos operatorios (por ejemplo, necrosis, líquido purulento, material del injerto infectado) y (4) aislamiento de microorganismos de la sangre, material de drenaje o prótesis. Para recolectar la información requerida, se consultó el sistema de administración de pacientes del hospital. Además, los médicos generales y los pacientes fueron contactados para completar todos los datos requeridos.
Las reconstrucciones vasculares primarias fueron categorizadas como reconstrucciones centrales o periféricas: la toracoabdominal, aortoilíaca, aortofemoral e iliofemoral fueron consideradas como reconstrucciones centrales y la femorofemoral y femoropoplítea como periféricas. La enfermedad subyacente fue categorizada como aneurismática o vascular oclusiva. El momento de la presentación clínica de la infección fue dividido en temprano y tardío. La presentación temprana se relacionó con alguno de los criterios descritos más arriba < 3 meses después de la operación primaria, mientras que la infección tardía ocurrió después de los 3 meses. La mortalidad temprana fue definida como la muerte < 30 días después de la admisión por infección protésica o dentro de la misma admisión hospitalaria y la mortalidad tardía como la muerte después de los 30 días.
Los análisis estadísticos fueron realizados utilizando en programa SPSS para Windows, versión 14.0.2 (SPSS, Chicago, IL). Los datos fueron presentados como medias ± desvío estándar (DE). Las diferencias entre las variables categóricas fueron testeadas utilizando la prueba de c2 de Pearson. Las diferencias entre medias fueron testeadas utilizando la prueba de Student de 2 colas (para variables con distribución normal) o la U de Mann-Whitney (para aquellas con distribuciones asimétricas). La significación estadística fue establecida en P < 0,05. El análisis univariado con las pruebas de log-rank fue realizado para determinar si uno o más factores relacionados con el paciente y con la enfermedad eran predictivos para la mortalidad. Las variables que tuvieron una influencia directa después del análisis univariado fueron ingresadas de una manera gradual hacia atrás en un modelo de regresión multivariada de Cox.
Resultados
Hubo 33 hombres y 11 mujeres (edad media, 71 años; rango, 51-88). Hubo considerable comorbilidad: casi la mitad de los pacientes tenían enfermedad cardíaca y un tercio enfermedad renal (Tabla 1). Los procedimientos de revascularización realizados antes del comienzo de la infección son listados en la Tabla 2. En el 80% de los casos, estuvieron involucradas reconstrucciones centrales. El 75% de las prótesis infectadas fueron implantadas inicialmente para una enfermedad aneurismática (26% en aneurismas rotos; 34% para aneurismas agudos no rotos y 40% electivos). Ocho prótesis fueron inicialmente implantadas en aneurismas primariamente infectados (por ejemplo, aneurismas micóticos) y hubo un aneurisma inflamatorio.
· TABLA 1: Características de los pacientes (n = 44)
| Variable | Valor |
| Sexo Masculino Femenino |
33 (75%) 11 (25%) |
| Edad (años) | 71 (51-88) |
| Índice de masa corporal (kg/m2) | 26 (18-40) |
| Comorbilidades * Consumo de tabaco Hipertensión Enfermedad cardíaca Hiperlipidemia Enfermedad renal Enfermedad pulmonar Diabetes mellitus Neoplasia maligna Terapia inmunosupresora |
32 (73%) 20 (46%) 20 (46%) 19 (43%) 11 (25%) 11 (25%) 9 (21%) 7 (16%) 6 (14%) |
Los datos están expresados como números (porcentaje) o como medias (rango). * Definidas de acuerdo con el Ad Hoc Committee on Reporting Standards [4]
· TABLA 2: Factores relacionados con la prótesis en la operación inicial
| Factor | n (%) |
| Enfermedad subyacente Aneurismática Oclusiva |
33 (75) 11 (25) |
| Localización de la prótesis Tóracoabdominal Aortoilíaca Aortofemoral Iliofemoral |
1 (2) 27 (61) 10 (23) 6 (14) |
| Tipo de material del injerto Dacron Politetrafluoroetileno |
41 (93) 3 (7) |
El 98% de los pacientes con infecciones de los injertos protésicos presentaron síntomas clínicos. Los síntomas encontrados más frecuentemente son listados en la Tabla 3. En el 86% de los casos, se pudieron aislar los microorganismos causales, 50% de los cuales fueron cultivados del material obtenido después de la inserción de un drenaje y 48% del material del injerto protésico obtenido durante la operación (Tabla 4). Los organismos cultivados más comunes son listados en la Tabla 3. La presentación clínica temprana, dentro de los 3 meses, ocurrió en el 43% de los pacientes. En la mayoría de los casos, el Staphylococcus coagulasa negativo o el Staphylococcus aureus fueron aislados. El S aureus y la Escherichia coli tendieron a ser más comunes en los pacientes con presentación clínica tardía (intervalo promedio libre de infección, 33 meses). El intervalo medio libre de infección después de la operación primaria fue de 29 meses (rango, 0-154 meses). En este estudio, el Staphylococcus coagulasa negativo tendió a ser más común en la presentación clínica temprana en relación con otros microorganismos aislados, con un intervalo promedio libre de infección de 21 meses.
· TABLA 3: Sintomatología y microorganismos aislados
| Variable | n (%) |
| Síntomas Dolor Fiebre Edema/sutura aneurisma Infección de la herida |
36 (82) 22 (50) 17 (39) 15 (34) |
| Microorganismos aislados Staphylococcus coagulasa negativo Staphylococcus aureus Escherichia coli Candida albicans Pseudomonas aeruginosa Listeria monocytogenes Haemophilus influenzae Micrococcus spp Enterococcus faecalis Hafnia alvei Sin aislamiento de microorganismos Desconocido |
|
· TABLA 4: Diagnóstico de infección del injerto protésico
| Variable | n (%) |
| Presentación clínica | 43 (98) |
| Imágenes adicionales TC PET RMN Scan de leucocitos TC fusionada con PET |
36 (82) 33 (75) 13 (50) 2 (5) 5 (11) 13 (30) |
| Microorganismos cultivados de Sangre Drenaje* Prótesis |
9 (21) 22 (50) 21 (48) |
El diagnóstico fue hecho primariamente sobre la base de una combinación de la presentación clínica e imágenes adicionales, especialmente TC (75%). En el 30% de los casos, la TC se fusionó con PET con F18-fluorodesoxiglucosa. Las restantes modalidades de diagnóstico por imágenes usadas para diagnosticar las infecciones de los injertos protésicos son mostradas en la Tabla 4. Se usaron varias modalidades de tratamiento, con la administración de antibióticos y seguimiento estrecho, seguido por remoción completa del injerto y reconstrucción in situ. Los detalles de otras estrategias de tratamiento se describen en la Tabla 5.
· TABLA 5: Estrategias de tratamiento
| Tipo | n (%) |
| Tratamiento conservador (antibióticos) |
13 (30) |
| Drenaje | 9 (20) |
| Remoción del injerto y drenaje | 1 (2) |
| Remoción del injerto y bypass extra-anatómico | 8 (18) |
| Remoción del injerto y reconstrucción in situ con rifampicina | 13 (20) |
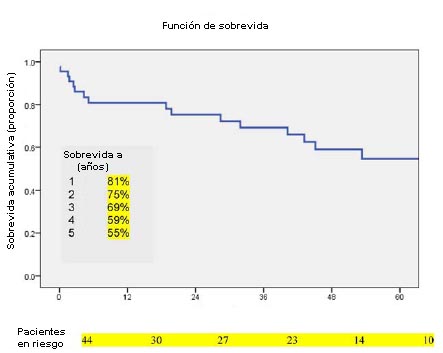
La duración media del seguimiento alejado fue de 5 años, durante los cuáles 20 pacientes (46%) fallecieron. La mortalidad temprana fue observada en 4 pacientes (9%) después de la admisión por infecciones del injerto protésico. Tres de ellos murieron debido a falla orgánica múltiple y 1 por hemorragia masiva del muñón aórtico. La mortalidad tardía ocurrió en 16 pacientes (37%). La causa principal de muerte en el período tardío estuvo también relacionada con la enfermedad vascular (n = 7 [16%]) Cinco pacientes fallecieron por falla orgánica múltiple. Los otros 2 pacientes, por hemorragia masiva. Otras causas de muerte en el período tardío estuvieron relacionadas con la comorbilidad y fiueron predominantemente la enfermedad pulmonar obstructiva crónica, enfermedad cardíaca y enfermedad maligna. Las causas de mortalidad son listadas en la Tabla 6. La sobrevida a 5 años de la infección del injerto protésico se muestra en la Figura 1.
· TABLA 6: Resultados después del tratamiento
| Variable | n (%) |
| Mortalidad | 20 (45) |
| Causa de mortalidad global Relacionada conenfermedad vascular Pulmonar Renal Cardíaca Otra |
9 (21) 3 (7) 1 (2) 2(4) 5 (11) |
· FIGURA 1: Curva de sobrevida acumulativa de Kaplan-Meier describiendo el seguimiento a 5 años de las infecciones de injertos protésicos.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.