Obesidad y cáncer de mama
Epidemiología y clasificación del cáncer de mama
En 2020, el cáncer de mama superó al cáncer de pulmón como la principal causa de incidencia mundial de cáncer en las mujeres.
El cáncer de mama comúnmente se estratifica en subtipos moleculares identificados mediante inmunohistoquímica por la presencia del receptor de estrógeno (ER), receptor de progesterona (PR) y receptor 2 del factor de crecimiento epidérmico humano (HER2/neu). Los tumores de mama con ER, PR o ambos detectables, con o sin amplificación de HER2, se definen como tumores de tipo luminal. Los tumores con sobreexpresión de HER2, pero no ER o PR, se definen como cáncer de mama HER2+ . El cáncer de mama triple negativo (TNBC) se define por la falta de expresión de los tres receptores.
El vínculo entre obesidad y cáncer de mama: evidencia epidemiológica
La obesidad promueve la incidencia y progresión de al menos 15 tipos de cáncer, incluido el cáncer de mama en mujeres posmenopáusicas. El tejido adiposo se convierte en el sitio predominante de producción de estrógenos después de la menopausia. Por lo tanto, las mujeres con obesidad tienen mayores niveles posmenopáusicos de estrógeno y, en consecuencia, una mayor exposición a los efectos oncogénicos de esta hormona.
En todos los subtipos de cáncer de mama, la obesidad se asocia con una peor supervivencia libre de enfermedad y supervivencia general. Sin embargo, la relación entre la obesidad y el cáncer de mama se complica por el subtipo y el estado menopáusico en la literatura. La obesidad en mujeres posmenopáusicas aumenta el riesgo relativo general de desarrollar cáncer de mama a 1,33, impulsado en gran medida por mayores tasas de cánceres de mama ER +. Sin embargo, la obesidad también se asocia con la incidencia y progresión del TNBC posmenopáusico.
Obesidad y progresión metastásica del cáncer de mama
La metástasis, la diseminación y crecimiento de células tumorales primarias en sitios secundarios, es la causa del 90% de las muertes relacionadas con tumores en pacientes con cáncer de mama, con tasas de supervivencia a 5 años del 28% para los pacientes afectados.
Para todos los subtipos de cáncer de mama, las pacientes obesas tienden a tener tumores primarios más grandes en el momento del diagnóstico y un mayor riesgo de desarrollar metástasis en los ganglios linfáticos. Un IMC más alto predice una menor supervivencia libre de recurrencia loco regional y a distancia entre mujeres con cáncer de mama, y aumenta la asociación con la mortalidad general en comparación con pacientes con cáncer de mama con un peso ideal. De hecho, los pacientes con cáncer de mama y obesidad tienen hasta un 46% más de probabilidades de tener metástasis a distancia 10 años después del diagnóstico.
La obesidad acelera y exacerba la progresión metastásica del cáncer de mama, respaldada por modelos preclínicos y estudios clínicos. Se han establecido varios mecanismos mediados por leptina detrás de este vínculo, incluida la invasión, migración y regulación inmune del cáncer de mama, así como el enriquecimiento de células madre cancerosas y la desregulación de células madre mesenquimales en el microambiente tumoral.
El vínculo entre obesidad y cáncer de mama: mecanismos moleculares
Interacciones entre obesidad, tejido adiposo y cáncer
Por separado, la obesidad y el cáncer son complejos e integran una combinación de genética, medio ambiente y estilo de vida que no se comprende del todo. Por tanto, la relación entre obesidad y cáncer es inmensamente complicada. A pesar de la complejidad, se han establecido varios mecanismos subyacentes al vínculo entre la obesidad y el cáncer.
El aumento de la masa de tejido adiposo blanco (WAT) está surgiendo como un nexo entre la biología tumoral y la desregulación metabólica e inflamatoria en la obesidad. WAT se compone de adipocitos maduros, preadipocitos, células endoteliales, fibroblastos, pericitos y células inmunes. La obesidad también promueve la hiperleptinemia, un resultado de la desregulación del tejido adiposo que puede aumentar la secreción de citoquinas inflamatorias.
Durante la expansión del tejido adiposo en el desarrollo de la obesidad, surge inflamación debido al aumento de la infiltración inmune, remodelación hipertrófica del tejido adiposo y angiogénesis, necrosis de los adipocitos y flujo desregulado de ácidos grasos debido al aumento de la lipólisis de los adipocitos. La rápida hipertrofia de los adipocitos durante la expansión del tejido adiposo puede crear una angiogénesis insuficiente para lograr una vascularización adecuada del tejido, lo que lleva a regiones hipóxicas en el tejido adiposo blanco (WAT).
Además de la modulación de los adipocitos y otras células que normalmente residen en el tejido adiposo, los tumores adyacentes reclutan activamente células estromales, de otras partes del cuerpo y reprograman su función a través de la comunicación bidireccional con las células tumorales para apoyar la progresión metastásica. Las células cancerosas inducen la lipólisis en los adipocitos, liberando ácidos grasos libres que los tumores utilizan para la proliferación y migración (Figura 1).
Esta transferencia de ácidos grasos, estimulada por citocinas, sostiene la inflamación del WAT y ocurre con mayor frecuencia en células de cáncer de mama cocultivadas con adipocitos de donantes con obesidad versus adipocitos de donantes no obesos. Como el tejido mamario está compuesto por un 90% de WAT, y el epitelio mamario humano está en interacción permanente con el tejido adiposo mamario, comprender el impacto del exceso de WAT es imperativo para resolver la relación entre la obesidad y el cáncer de mama.
Tejido adiposo blanco (WAT) y adipocinas
Los niveles elevados de hormonas sexuales endógenas se asocian con la obesidad y se correlacionan con el riesgo de cáncer de mama en mujeres posmenopáusicas.
Después de la menopausia, la producción de estrógeno a través de la actividad de la enzima clave aromatasa se vuelve no cíclica y ocurre principalmente en el tejido adiposo, exacerbando la producción de estrógeno en mujeres con obesidad.
El tejido adiposo blanco (WAT) es un importante órgano endocrino que secreta hormonas y factores de crecimiento, además de enzimas y metabolitos. El secretoma WAT es un mediador importante de la exacerbación tumoral por obesidad. Las adipocinas, secretadas por WAT, constituyen una clase de polipéptidos biológicamente activos con una amplia gama de funciones endocrinas, metabólicas e inflamatorias.
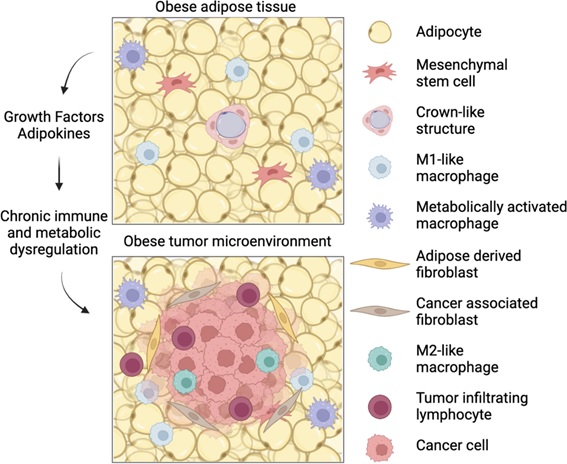
Figura 1. El impacto de la obesidad en el microambiente tumoral. El tejido adiposo blanco de un huésped obeso está compuesto de adipocitos hipertrofiados, algunos de los cuales se necrosan e inducen la formación de estructuras en forma de corona. La inflamación del tejido adiposo es fomentada por macrófagos de tipo M1 y activados metabólicamente. Los tumores que se desarrollan adyacentes al tejido adiposo obeso reciben numerosas señales inflamatorias y metabólicas del tejido adiposo y están marcados por un microambiente tumoral inmunosuprimido con linfocitos infiltrantes de tumores ineficaces y polarización de macrófagos inmunosupresores tipo M2. El tejido adiposo contribuye aún más al microambiente tumoral mediante el reclutamiento y la transdiferenciación de fibroblastos asociados al cáncer a partir de células madre mesenquimales y fibroblastos derivados de adipocitos a partir de adipocitos.
La leptina, la hormona polipeptídica producida principalmente por los adipocitos, se sintetiza y circula sistémicamente en proporción a la masa de tejido adiposo. Los niveles de leptina son más altos en pacientes con cáncer de mama en comparación con pacientes sanos, particularmente en mujeres con sobrepeso u obesidad. Además, el aumento de leptina se asocia con el riesgo de cáncer de mama con una diferencia media estandarizada de 0,96 en un metaanálisis de 46 estudios de más de 13.500 mujeres. La leptina afecta la biología del cáncer de mama a través de una multitud de mecanismos que resultan en un aumento del volumen tumoral y metástasis en modelos preclínicos y clínicos de cáncer de mama, incluido el TNBC.
El TNFα es una citocina expresada en el tejido adiposo subcutáneo (y en menor medida visceral). En el tejido mamario sano, el TNFα contribuye a la proliferación celular y a la ramificación morfogénica. Como citoquina proinflamatoria clave, el TNFα también se expresa en monocitos y macrófagos, y los niveles de TNFα en el tejido adiposo aumentan 2,5 veces en individuos con obesidad y tienen una fuerte correlación positiva con la hiperinsulinemia.
Por lo tanto, la obesidad desregula las funciones endócrinas y metabólicas del WAT al promover la transformación proinflamatoria, que se caracteriza por remodelación del estroma, hipoxia y perfil inmunológico alterado. Si bien se han logrado avances significativos en la comprensión de las relaciones entre estos procesos complejos y entrelazados, aún no se han determinado las contribuciones relativas de cada uno de ellos a la fisiopatología de la obesidad.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.