A pesar de los avances en inmunoterapia oncológica, como los inhibidores de los puntos de control inmunitario y la terapia celular adoptiva, las vacunas no se perfilan todavía como opciones concretas en oncología. No obstante, hay datos prometedores, especialmente para pacientes resistentes a otras terapias.
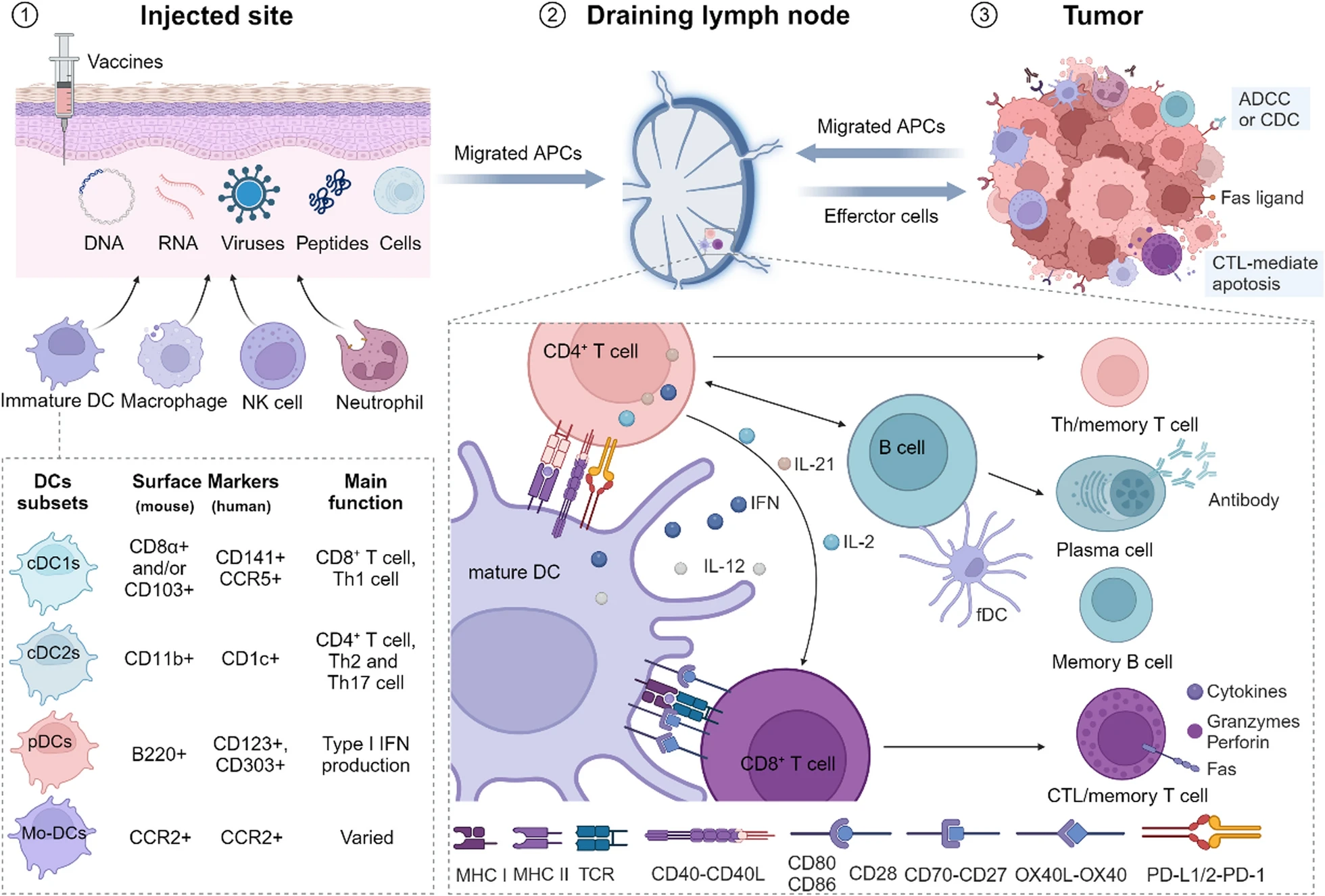
La identificación de neoantígenos derivados de mutaciones específicas del tumor es un área clave. El proceso implica la secuenciación del exoma completo (WES) y el ARN-Seq del tumor y el tejido normal para identificar mutaciones, seguido de inmunopeptidómica para identificar péptidos presentados por moléculas del Complejo Mayor de Histocompatibilidad (CMH) de clase I y II2.
La utilización de herramientas bioinformáticas, como OptiType, es fundamental para acelerar los tiempos de desarrollo. Los algoritmos de predicción evalúan la afinidad de unión de los péptidos mutados a las moléculas HLA6.
Por otro lado, las vacunas personalizadas dirigidas a múltiples neoantígenos han demostrado inducir respuestas de células T específicas en ensayos clínicos con melanoma, con potencial para reducir eventos metastásicos recurrentes y mejorar la sensibilidad a la terapia anti-PD-17. También se están investigando vacunas de neoantígenos compartidos para poblaciones de pacientes con mutaciones comunes, como KRAS10.
- Vacunas basadas en péptidos/proteínas: A menudo, se dirigen a múltiples epítopos y se combinan con adyuvantes. Si bien pueden generar respuestas inmunitarias potentes, los resultados clínicos han sido mixtos. Ejemplos incluyen a SurVaxM para glioblastoma, Tecemotide (L-BLP25) para cáncer de pulmón no microcítico (CPNM) y las peptídicas dirigidas a HER2 en cáncer de mama.
- Vacunas de ADN: Ofrecen seguridad y producción rentable, pero su inmunogenicidad en humanos ha sido limitada. Se están explorando estrategias para mejorar la captación y la expresión del ADN, como la electroporación. GNOS-PV02, una vacuna de ADN para carcinoma hepatocelular, mostró correlación entre las respuestas de células T específicas del antígeno y el número de neoantígenos.
- Vacunas basadas en ARNm: Destacan por su seguridad, eficacia y producción rentable. Pueden entregar antígenos tumorales (TAAs o neoantígenos) a las células presentadoras de antígenos, induciendo fuertes respuestas inmunitarias. Las formulaciones con nanopartículas lipídicas (LNPs) han mejorado la entrega y la estabilidad. BNT162b2 y mRNA-1273 son ejemplos de vacunas de ARNm exitosas contra el SARS-CoV-2. En oncología, hay resultados prometedores en melanoma.
- Partículas similares a virus (VLPs): Imitan la estructura de los virus para mejorar la captación por las células inmunitarias y la presentación de antígenos, sin el riesgo de replicación viral. Se están investigando VLPs que expresan TAAs, como HER2.
- Vectores virales: Utilizan virus recombinantes para entregar genes de antígenos tumorales a las células huésped, induciendo fuertes respuestas inmunitarias celulares y humorales. PROSTVAC-VF para cáncer de próstata y TG4010 para CPNM son ejemplos.
- Virus oncolíticos: Se replican selectivamente en células cancerosas, causando lisis tumoral directa e induciendo respuestas inmunitarias antitumorales. Talimogene laherparepvec (T-VEC) es un virus oncolítico aprobado para melanoma.
- Vacunas de células enteras: Utilizan células tumorales autólogas o alogénicas inactivadas o modificadas para entregar una amplia gama de antígenos tumorales. Sipuleucel-T (Provenge) es una vacuna de células autólogas aprobada para cáncer de próstata resistente a la castración metastásico. Las vacunas de células dendríticas (CD) cargadas con antígenos tumorales también han mostrado potencial. DCVax-L mostró una prolongación de la supervivencia global en pacientes con glioblastoma recién diagnosticado y recurrente.
Los tumores pueden desarrollar resistencia a las vacunas contra el cáncer a través de diversos mecanismos, incluyendo la pérdida de antígenos, la modulación del microambiente tumoral (TME) para suprimir la inmunidad, la sobreexpresión de puntos de control inmunitario y la activación de vías de señalización que promueven la supervivencia tumoral.
Las terapias combinadas son fundamentales para superar estas barreras y mejorar la eficacia de las vacunas. La combinación de vacunas con inhibidores de puntos de control inmunitario (ICI), como anti-PD-1/PD-L1 y anti-CTLA-4 ha mostrado sinergia en varios estudios. La combinación con quimioterapia, radioterapia y terapias dirigidas también se está investigando. Además, la combinación con terapia celular adoptiva (TCA) busca mejorar la persistencia y la función de las células T transferidas.
Si bien numerosas vacunas contra el cáncer han demostrado la capacidad de inducir fuertes respuestas inmunitarias en ensayos clínicos, la mayoría no ha logrado respuestas duraderas o una eficacia clínica significativa en ensayos de fase III a gran escala.
El diseño de una vacuna óptima requiere una cuidadosa consideración de la selección de antígenos, la incorporación de adyuvantes, los métodos de administración, la combinación con otras terapias y la identificación de la población receptora adecuada. Las tecnologías avanzadas, como la secuenciación unicelular y la imagen de alta resolución, están proporcionando nuevos conocimientos sobre el TME, lo que puede optimizar el diseño de las vacunas.
La evaluación de la eficacia de las vacunas se ha centrado principalmente en las respuestas inmunitarias adaptativas, particularmente en la activación de células T CD8+ específicas del antígeno y las TRM. En última instancia, los resultados clínicos siguen siendo el criterio definitivo. El futuro del campo reside en estrategias innovadoras, terapias combinadas y una comprensión más profunda de la inmunología del cáncer para desarrollar vacunas contra el cáncer más eficaces.