La distrofia corneal endotelial de Fuchs (Sigla en inglés FECD), es una patología que se caracteriza por la presencia de una especie de verrugas de colágeno (guttae) en la membrana de Descemet y disfunción celular endotelial debido a pérdida o degeneración celular. Por la morfología celular anormal característica, que puede observarse en el microscopio, como así también por la limitada capacidad regenerativa in vivo, las células endoteliales son consideradas como “distróficas”.
Por lo tanto, la FECD se trata normalmente mediante el reemplazo del endotelio con tejido donado, por medio de queratoplastia penetrante o endotelial. Este último procedimiento, está siendo perfeccionado, intentándose el trasplante únicamente de la membrana de Descemet y su endotelio, lo que se conoce como queratoplastia endotelial de la membrana de Descemet. Curiosamente, la observación clínica después de dicho procedimiento, pone en duda el concepto actual del estado del endotelio en la distrofia corneal, endotelial de Fuchs. Se observó, en realidad un importante rol del endotelio “distrofico” en la re-endotelización de la membrana de Descemet y posterior aclaración de la córnea. Asimismo, estudios recientes sobre la patofisiología de la distrofia corneal endotelial de Fuchs, han demostrado que las células endoteliales no son “distróficas” per se, sino que con el tiempo se vuelven disfuncionales. En el presente estudio se describe la lógica detrás de este nuevo concepto y se evalúan posibilidades de nuevos tratamientos, menos invasivos para la distrofia corneal, endotelial de Fuchs.
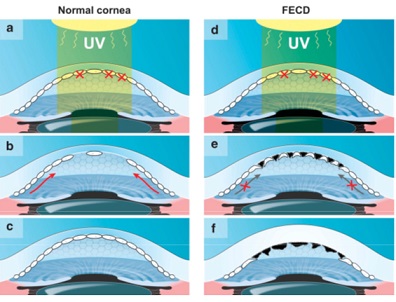
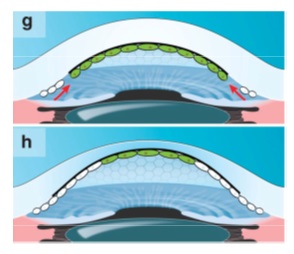
Fig 1.Cicatrización y potencial regenerativo de células endoteliales de receptor con córnea normal y con distrofia corneal endotelial de Fuchs. Se toma como ejemplo la radiación ultravioleta para mostrar la reacción de la herida de una córnea normal y córnea con distrofia endotelial, al daño por estrés oxidativo y apoptosis. Como la córnea central es más delgada que la periférica, se cree que la radiación UV causa mayor daño en las células endoteliales centrales, mientras que las células endoteliales periféricas están protegidas del daño por estrés oxidativo (a,d). A pesar de que las células cuentan con diversos mecanismos de defensa contra el estrés oxidativo, si la exposición es prolongada, el daño que no puede repararse se acumula y como consecuencia la célula muere por apoptosis. En el caso del endotelio corneal, queda una brecha entre las células endoteliales, que compromete el endotelio y causa inflamación estromal.
En la córnea normal (b, c) dicho defecto se compensa con la migración de células madre en la periferia (flechas en b), que durante la migración hacia el centro de la córnea, se convierten en células endoteliales maduras, capaces de mantener la córnea delgada y trasparente. Sin embargo, en las córneas con distrofia endotelial de Fuchs (e), las células endoteliales centrales son más susceptibles al daño inducido por la radiación UV, con mayor cantidad de células muertas y más espacios vacios entre células.
En este caso, el defecto no puede ser compensado por las células madre periféricas, debido a la barrera física formada por las “guttae” (estructuras negras). Por cuanto las células endoteliales adyacentes deben estirarse para cubrir el espacio dejado por la célula que se perdió. Finalmente, a medida que avanzan las guttae, se pierden también estas células y la córnea de descompensa, necesitando un procedimiento de queratoplastia para devolver la visión (F). Cuando se realiza queratoplastia endotelial de la membrana de Descemet, se extrae la barrera en forma de guttae, al extirpar la membrana de Descemet y cuando se implanta el injerto (verde), las células madre periféricas pueden volver a migrar hacia el centro (flechas) (g). Finalmente, se restaura la función endotelial y la córnea se vuelve delgada y transparente nuevamente. A su debido tiempo, la migración centrípeta de células madre del receptor continúa y se mezclan con las células del donante (verdes) (h).
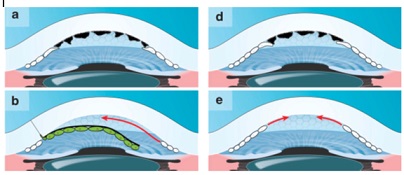
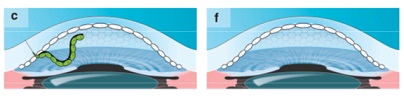
Fig 2. Los mecanismos detrás de la transparencia espontánea y el tratamiento de FECD únicamente con extirpación de la membrana de Descemet. Al retirar las guttae que actúan como barrera para la migración de células madre periféricas (a) e insertando el tejido del donante (verde) (apenas agarrado para que quede en posición segura), la observación clínica indica que se induce la migración de las células madre del receptor (b). Como consecuencia, el estroma desnudo se cubre con las células endoteliales de receptor (c), se restaura la función endotelial y la cornea se estabiliza.
Alternativamente, en algunos casos, la extirpación de la membrana de Descemet, sin trasplante de tejido donado, podría ser suficiente para inducir la migración endotelial del receptor (d-f). Uno de los requisitos para que esto suceda es la detección temprana de la patología, antes de que las guttae avancen hacia la periferia y queden células madre periféricas suficientes para cubrir el estroma (d). Luego de quitar la barrera física mediante la extirpación de la membrana de Descemet, comienza la proliferación y migración de células madre periféricas (e), restaurándose el mosaico endotelial normal y su función, obteniéndose una córnea delgada y transparente.
Al minimizar la intervención quirúrgica para tratar la FECD se beneficia el paciente, el cirujano y los bancos de córneas. Para los pacientes, el pronóstico visual es mejor, la repoblación fisiológica y restauración anatómica mediante células del receptor sería superior a cualquier procedimiento de queratoplastia. Para los cirujanos, el tratamiento de patologías endoteliales sería menos complicado, con menor riesgo de desprendimiento de los injertos y otras complicaciones. Para los bancos de córnea, el requerimiento de tejido se limitaría a la membrana de Descemet y/o cultivos celulares, permitiendo un uso más eficiente del tejido donado. Finalmente, la capacidad regenerativa de nuestros propios tejidos, es superior a los métodos quirúrgicos, ya que la madre naturaleza y no el cirujano, estaría realizando un mejor trabajo de recuperación.
Conclusiones:
El nuevo concepto del mecanismo de las células endoteliales permite acceder a métodos menos invasivos para tratar la FECD.
Síntesis y traducción: Dr. Martín Mocorrea, editor responsable de Intramed en la especialidad de oftalmología.