Los antirretrovirales de acción prolongada pueden cerrar las brechas que existen en la profilaxis previa a la exposición al VIH (PrEP), sobre todo la adherencia. En dos ensayos de fase 3, el lenacapavir subcutáneo dos veces al año fue seguro y altamente eficaz para la PrEP en diversas poblaciones.
Un estudio abierto de fase 1 en participantes de 18 a 55 años sin VIH evaluó la farmacocinética, la seguridad y la tolerabilidad de dos formulaciones de lenacapavir, administradas por inyección intramuscular ventroglútea, en una dosis única de 5000 mg (formulación 1 con etanol al 5 % p/p, formulación 2 con etanol al 10 % p/p).
Las muestras farmacocinéticas se recolectaron en puntos de tiempo preespecificados hasta 56 semanas. Las concentraciones plasmáticas de lenacapavir se midieron con un método validado de cromatografía líquida y espectrometría de masas en tándem y se resumieron con un análisis no compartimental.
Los parámetros farmacocinéticos evaluados incluyeron el área bajo la curva concentración-tiempo para el intervalo de dosificación anual calculado desde los días 1 hasta 365, la concentración plasmática máxima, el tiempo hasta alcanzar la concentración plasmática máxima y la concentración mínima.
20 participantes recibieron lenacapavir en su Formulación 1 y 20 recibieron Lenacapavir en su Formulación 2. Para la estimación de los parámetros farmacocinéticos, el tamaño de la muestra varió a lo largo del tiempo, con al menos 13 participantes (formulación 1) y al menos 19 participantes (formulación 2), debido a interrupciones tempranas por razones no relacionadas con el fármaco del estudio.
Después de la administración intramuscular de lenacapavir, las concentraciones aumentaron rápidamente y la mediana del tiempo hasta la concentración máxima fue de 84,1 días (IQR 56,1-112,0) para la formulación 1 y de 69,9 días (55,3-105,5) para la formulación 2. La mediana más alta de lenacapavir intramuscular una vez al año (247 ng/mL [IQR 184,0–346,0] para la formulación 1, 336,0 ng/mL [233,5–474,3] para la formulación 2) se mantuvo por encima de la mediana más alta de la concentración subcutánea más alta de lenacapavir dos veces al año (67,3 ng/mL [46,8–91,4]).
Los eventos adversos fueron, en su mayoría, de grado 1 o 2. El más común fue el dolor en el lugar de la inyección (16 [80 %] participantes que recibieron la formulación 1, 15 [75 %] que recibieron la formulación 2), que generalmente fue leve, se resolvió en 1 semana y se redujo sustancialmente con el pretratamiento con hielo.
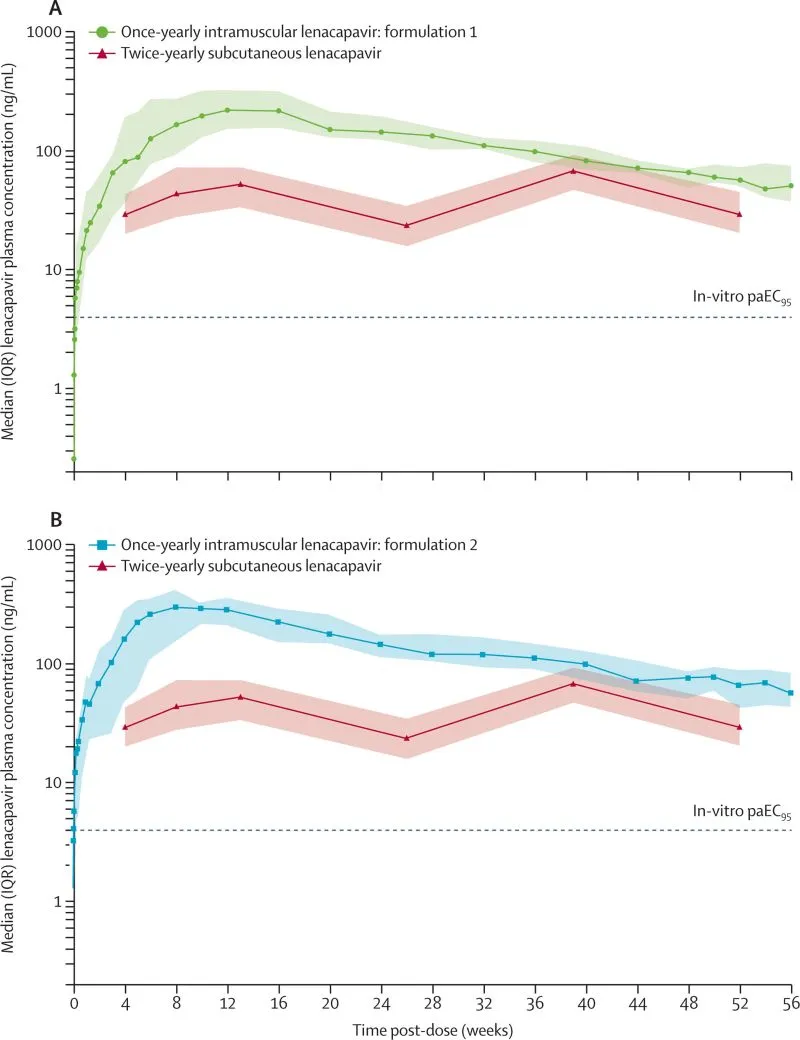
Perfiles de concentración plasmática mediana (IQR) en el tiempo de lenacapavir intramuscular una vez al año frente a lenacapavir subcutáneo dos veces al año para la formulación 1 (A) y la formulación 2 (B).
Tras la administración de lenacapavir intramuscular una vez al año, las concentraciones plasmáticas medias superaron las asociadas con la eficacia en los estudios de fase 3 de lenacapavir subcutáneo dos veces al año para la PrEP durante al menos 56 semanas. Ambas formulaciones fueron seguras y bien toleradas. Estos datos muestran el potencial de la prevención biomédica del VIH con un intervalo de dosificación una vez al año.
Los últimos años han sido testigos de progresos notables en este campo, mediante plataformas innovadoras que buscan activar y madurar linfocitos B difíciles de alcanzar con las estrategias tradicionales:
- ARN mensajero (mRNA) con enfoque en “germline-targeting”: Ensayos preclínicos y clínicos tempranos, como el IAVI G002, prueban vacunas en dos etapas (priming y boosting) para desencadenar linfocitos B específicos y guiarlos hacia la producción de anticuerpos ampliamente neutralizantes.
- Diseño secuencial de inmunógenos en modelos animales: Investigaciones financiadas por el NIH han demostrado en modelos murinos la capacidad de inducir inmunógenos ajustados para apuntar a precursores de dichas anticuerpos, sentando las bases para protocolos humanos futuros.
- Vacunas basadas en nanopartículas y plataformas de proteína recombinante: Aunque menos mediáticas que las mRNA, siguen evolucionando, usando adyuvantes de nueva generación para presentar las proteínas de la envoltura viral en configuraciones multivalentes que optimizan la captación por células presentadoras de antígeno.
El futuro parece estar en las herramientas de IA que prometen optimizar los inmunógenos para mejorar la afinidad y la estabilidad. A su vez, aunque los ensayos clínicos con vacunas mosaico (por ejemplo, HVTN 705/706) no alcanzaron eficacia suficiente, continúan en ajustes para ampliar el rango de cobertura.