| Introducción |
El síndrome del intestino irritable (SII) es un trastorno de la interacción intestino-cerebro (TIIC) caracterizada por dolor abdominal relacionado con la defecación y cambios en la frecuencia y forma de las heces. Los hábitos intestinales predominantes se clasifican en subtipos, con predominio de estreñimiento (SII-E), predominio de diarrea (SII-D), hábito intestinal mixto (SII-M) e inclasificable (SII-U. por su nombre en inglés). Al igual que los otros TIIC, el SII frecuentemente se asocia con trastornos neuropsiquiátricos como depresión y ansiedad, consideradas desencadenantes de la aparición de síntomas o que se producen en respuesta a la presencia de las mismas.
En el estudio global de la Fundación Roma, los sujetos con distrés psicológico o síntomas somáticos clínicamente relevantes tenían 4,45 veces más probabilidades de tener ≥1 TIIC que aquellos sin distrés psicológico. El mismo estudio reportó que quienes cumplían con los criterios específicos para trastornos intestinales presentaban distrés psicológico clínicamente relevante o síntomas somáticos (55,5% de los casos). Por otra parte, los sujetos con SII exclusivamente, la prevalencia global de depresión fue del 36%: 38% con SII-E, 37% con SII-D, 34% con SII-M y 22% con SII-U.
La ansiedad estuvo presente en el 44% de los pacientes con SII, 47% con SII-E, 37% con SII-D, 37% con SII-M y 11% con SII-U. Basados en esta asociación, los autores sostienen que sería lógico pensar que el uso de neuromoduladores podría servir para el tratamiento de estas comorbilidades psicológicas. Sin embargo, el valor terapéutico de los neuromoduladores en el SII va más allá de su asociación con los trastornos neuropsiquiátricos, ya que actúan directamente en la regulación de diferentes mecanismos fisiopatológicos implicados en la hipersensibilidad visceral o central, las alteraciones del tránsito intestinal o los efectos neurogénicos, que son todos responsables de las manifestaciones clínicas del SII.
Este enfoque permite elegir alternativas terapéuticas en función de la intensidad de los síntomas y la naturaleza de los síntomas tratados (por ej., dolor, diarrea, estreñimiento). Los neuromoduladores suelen prescribirse después de una respuesta insatisfactoria a tratamientos dirigidos periféricamente que incluyen dieta, antiespasmódicos, modulación de la microbiota, laxantes o procinéticos y antidiarreicos. Dado que el tratamiento con neuromoduladores todavía se considera fuera de indicación, muchas de las recomendaciones que se proponen aquí, están basadas en el consenso de expertos y la experiencia del autor principal.
| ¿Por qué usar neuromoduladores en el SII? |
Los neuromoduladores (antes denominados antidepresivos, ansiolíticos o antipsicóticos) actúan sobre los receptores a lo largo del eje cerebro-intestino (EIC) y afectan la función cerebro-intestino relacionada con la motilidad, la secreción y la señalización neuronal visceral y central. Dado que el SII y otros TIIC son causados por la desregulación del EIC, los neuromoduladores sirven para normalizar su acción. Específicamente, tienen efectos para: (i) tratar la comorbilidad psiquiátrica, (ii) modificar la motilidad intestinal, (iii) mejorar la regulación negativa central de las señales viscerales y, (iv) mejorar la neurogénesis.
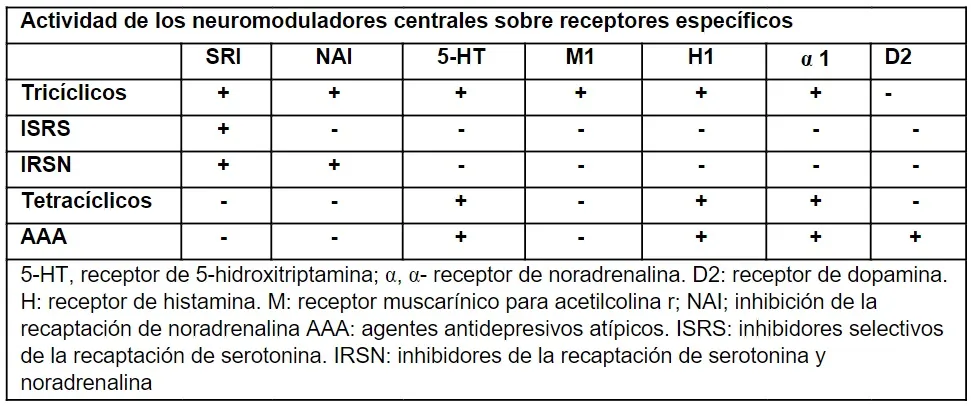
Algunos neuromoduladores actúan periféricamente en el sistema nervioso entérico, incluidos los agonistas del receptor 5-hidroxitriptamina (5-HT), los antagonistas del receptor 5-HT3, los agonistas de la guanilatociclasa C, los agonistas/antagonistas del receptor opioide, el ligando delta y los antagonistas de los receptores muscarínicos. Esta revisión solo se centra en los neuromoduladores de acción central, en particular los antidepresivos tricíclicos (ATC), los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), los tetracíclicos (TNAS) y los agentes antipsicóticos atípicos (AAA), que actúan sobre varios receptores específicos. Sus acciones ayudan a mejorar los síntomas de dolor o malestar, distensión abdominal, náuseas y vómitos. También pueden tener efectos periféricos sobre la motilidad y la secreción.
| Eje intestino- cerebro |
El EIC es un complejo bidireccional que conecta el sistema nervioso central y el sistema nervioso entérico. Comprende el cerebro, la médula espinal, el sistema nervioso autónomo (que incluye los sistemas nerviosos simpático, parasimpático y entérico), los sistemas neuroendocrino y neurohumoral.
Las señales nerviosas aferentes involucradas en la transmisión del dolor llegan al cerebro a través de una cadena de 3 órdenes de neuronas desde el aferente espinal primario que surge del intestino hasta las neuronas de segundo orden, desde el asta dorsal de la médula espinal hasta el tálamo, y luego al mesencéfalo. Los núcleos cerebrales involucrados en la regulación del dolor visceral incluyen el núcleo del tracto solitario, el núcleo parabranquial, el locus coeruleus, la médula ventromedial rostral, la corteza cingulada anterior, el núcleo paraventricular y la amígdala. Una vez que estas señales se registran centralmente, el cerebro puede modificar las señales viscerales entrantes a través de una modulación descendente, mediante mecanismos de control de compuerta. Esto está relacionado con la actividad de las fibras descendentes del tronco encefálico, que pueden afectar la sensibilidad de las neuronas del asta dorsal. Este mecanismo puede alterar la sensibilidad visceral y el control central de la percepción del dolor, mediante la participación de 2 neurotransmisores, la serotonina o la 5-HT y la noradrenalina (NA), que son los objetivos principales del tratamiento farmacológico.
El EIC también interactúa con la composición de la microbiota intestinal y la permeabilidad de la barrera intestinal, tanto que algunos autores utilizan el término eje microbiota cerebro-intestino. El microbioma, como parte del modelo conceptual biopsicosocial de los TIIC puede influir en el funcionamiento del sistema nervioso central. El metaboloma de una microbiota eubiótica contribuye al funcionamiento del cerebro sano, ya que algunos de sus componentes pueden atravesar la barrera hematoencefálica. El triptófano producido en el intestino por las células enterocromafines atraviesa la barrera intestinal y se transforma en 5-HT tras atravesar la barrera hematoencefálica; la 5-HT es crucial en el desarrollo y funcionamiento de la microglía. Los ácidos grasos de cadena corta, que son productos metabólicos de la microbiota, están directamente implicados en el fortalecimiento de las uniones estrechas de las células de la barrera intestinal.
Otro aspecto que apoya la relación entre la depresión y la microbiota intestinal son los datos que muestran que la composición de la microbiota difiere significativamente entre los sujetos sanos y los pacientes con diagnóstico de depresión . Por otra parte, un metaanálisis reciente halló cambios en la composición de la microbiota intestinal después de la administración de antidepresivos, y la evidencia preliminar sugiere un posible efecto de Bifidobacterium longum en la mejora de los puntajes psicológicos en pacientes con SII.
Un componente crítico del EIC es el sistema nervioso autónomo, que involucra al sistema nervioso entérico, actuando como mediador de la respuesta visceral a las influencias centrales. Hay evidencia que sugiere la presencia de trastornos de la función autónoma en pacientes con TIIC, lo que respalda la presencia de disminución o aumento del flujo vagal o de la actividad simpática. El desequilibrio autónomo también puede alterar la percepción visceral y estar involucrado en la percepción del dolor. Por estas razones, la disfunción autónoma podría ser un mecanismo fisiopatológico involucrado en muchos de los síntomas del SII y contribuir a factores asociados como la sudoración, arritmias cardíacas o alteraciones del ciclo respiratorio, incluida su asociación simultánea con los trastornos impulsados por el sistema autónomo, como el síndrome de taquicardia ortostática postural.
| Efectos neuromoduladores sobre la depresión y el dolor: la hipótesis de las monoaminas |
Esta hipótesis propone que la depresión resulta de una deficiencia de ≥1 de 3 monoaminas, que son 5-HT, NA y dopamina. Según esta hipótesis, los antidepresivos funcionan potenciando la transmisión sináptica de estas monoaminas, consiguiendo una regulación más lenta, o una desensibilización de sus receptores postsinápticos. La misma hipótesis puede explicar la actividad de los antidepresivos sobre la percepción del dolor visceral a través de EIC, ya que sus acciones monoaminérgicas interfieren en la actividad de los circuitos cerebrales relacionados con el dolor, las emociones, la ansiedad y la capacidad cognitiva. Los antidepresivos también interfieren con los mecanismos de transmisión nociceptiva en el asta dorsal de la médula espinal, modulando la transmisión del dolor aferente. El aumento de NA en la médula espinal, al inhibir directamente la recaptación, inhibe el dolor mediante los receptores α2-adrenérgicos. Por otra parte, la NA actúa en el locus coeruleus y mejora la función de un sistema inhibidor noradrenérgico descendente. Las regiones cerebrales, incluidas la amígdala y la corteza cingulada anterior, controlan de arriba a abajo las vías descendentes. Estas proyecciones son noradrenérgicas y serotoninérgicas, por lo que los antidepresivos pueden actuar modulando directamente estos procesos.
| Neuroplasticidad |
La neuroplasticidad se refiere a la notable capacidad del cerebro para reorganizarse a sí mismo mediante la formación o pérdida de nuevas conexiones neuronales a lo largo de la vida. Implica la capacidad del cerebro para adaptarse y cambiar en respuesta a experiencias, aprendizaje, influencias ambientales, lesiones y otros factores. La neurodegeneración se refiere a la pérdida de neuronas corticales con dolor crónico, eventos traumáticos de la vida y enfermedad psiquiátrica. La neurogénesis neuronal se refiere al crecimiento y conexiones neuronales nuevos, como puede ocurrir a raíz del tratamiento clínico. Este nuevo concepto ayuda a entender cómo los antidepresivos pueden mejorar los síntomas gastrointestinales. Las neuronas del sistema nervioso central son plásticas y capaces de crecer de nuevo en regiones como el hipocampo, y pueden morir después de un trauma psicológico grave, lo que se asocia con el desarrollo de trastorno de estrés postraumático o dolor crónico, como en el SII. La reducción de la densidad cortical después de un trauma se observa en otras regiones cerebrales involucradas en la regulación emocional y del dolor y es relevante para las regiones de control del dolor, como la corteza cingulada, en afecciones gastrointestinales crónicas y dolorosas como el SII.
Los tratamientos con antidepresivos parecen aumentar el crecimiento neuronal precursor después de una densidad cortical reducida debido a experiencias traumáticas. Los niveles del factor neurotrófico derivado del cerebro, un precursor del crecimiento neuronal, aumentan con el tratamiento antidepresivo, lo que se correlaciona con períodos de tratamiento más prolongados y el grado de recuperación de la depresión. Por otra parte, cuanto más tiempo se trate a los pacientes con antidepresivos, menor será la frecuencia de recaída o recurrencia de la depresión. Esto puede ayudar a explicar por qué, con el tiempo, estos tratamientos reducen los síntomas de manera más inmediata; lo que puede ayudar a reconectar el cerebro para acercarse a un estado de funcionamiento premórbido.
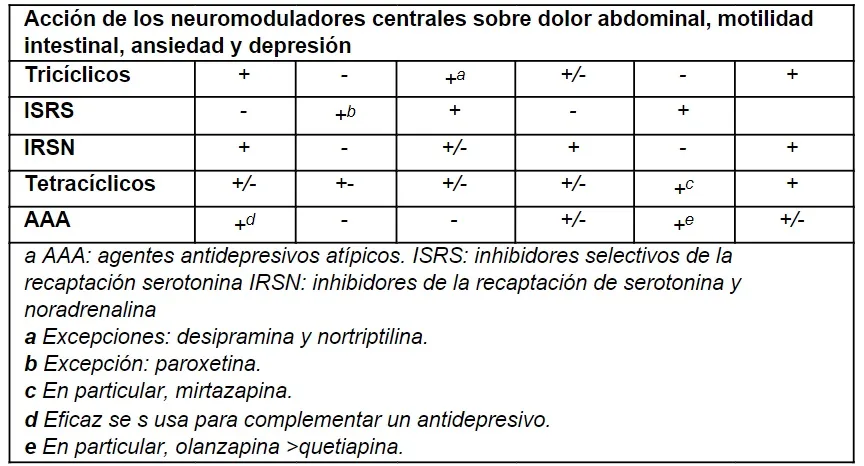
| Acción de los neuromoduladores centrales determinada por la clase de agente |
> Antidepresivos tricíclicos
Los ATC son neuromoduladores centrales cuyo mecanismo de acción es la inhibición de la recaptación presináptica de 5-HT y NA en combinación con propiedades antagonistas adicionales sobre los receptores postsinápticos 5-HT2A, 5-HT2C, 5-HT3, muscarínico 1, receptor de histamina (H)1, receptor de α-NA (α)1 y receptores presinápticos α2-NA.
El efecto antimuscarínico de los ATC se asocia con el estreñimiento debido a la disminución de la motilidad intestinal. Esta condición también puede estar relacionada con la acción inhibidora de estos agentes sobre el canal de potencial transitorio del receptor canónico tipo 4 en los miocitos colónicos que alteran su motilidad.
Si bien históricamente los ATC han sido utilizados en psiquiatría para tratar la depresión, los agentes más nuevos, como los ISRS y los IRSN, han suplantado en gran medida su uso. Sin embargo, los ATC también se recetan en dosis bajas para tratar afecciones dolorosas como el SII y la disfunción sexual.
La característica distintiva de los ATC, que se cree que es la principal responsable de sus propiedades antidepresivas y analgésicas, es una combinación variable de propiedades inhibidoras de la recaptación de 5-HT y NA. Con base en esta doble acción, los ATC tienen más potencial de efectos analgésicos que otras clases de antidepresivos que se dirigen solo a un sistema de monoamina, como los ISRS. Sin embargo, esto también puede estar asociado con un mayor riesgo de efectos secundarios. La mayoría de los ATC tienen afinidades receptoras adicionales, algunas de las cuales pueden ser las principales responsables de su perfil de efectos secundarios. Por lo tanto, el antagonismo del receptor muscarínico1 puede causar efectos secundarios anticolinérgicos clásicos, como boca seca, estreñimiento, somnolencia y visión borrosa.
El antagonismo del receptor adrenérgico α1 puede provocar mareos, somnolencia e hipotensión ortostática; y el antagonismo del receptor H1 puede provocar aumento de peso, especialmente en combinación con el antagonismo 5-HT2C, así como somnolencia.
Otros efectos adversos son: sedación, fatiga, cefalea, náuseas y disfunción sexual. Por otra parte, algunos ATC tienen propiedades débiles de bloqueo de los canales de sodio, lo que conduce al riesgo de arritmias y coma, o convulsiones en caso de sobredosis. Estos efectos secundarios parecen ser menos comunes con los ATC de amina secundaria, desipramina y nortriptilina. Por lo tanto, los ATC deben evitarse en pacientes con bloqueo de rama o intervalos QT prolongados. Algunos de los efectos secundarios de los ATC pueden ser beneficiosos en pacientes con inflamación de la articulación de la cadera. Por ejemplo, la ralentización del tránsito gastrointestinal debido a sus propiedades anticolinérgicas, que deberían ser útiles en pacientes con SII, y el aumento del apetito y el aumento de peso serán útiles en pacientes con dispepsia funcional con saciedad temprana y pérdida de peso.
Los agentes ATC se subdividen en aminas secundarias como la desipramina y la nortriptilina y aminas terciarias como la amitriptilina y la imipramina, esta última con mayores acciones antimuscarínicas y antihistamínicas. Si bien ambos tipos pueden funcionar para el dolor del SII, si el estreñimiento es un síntoma dominante se prefieren las aminas secundarias.
La dosis inicial y el programa de titulación de los diversos ATC son similares. Sin embargo, las aminas terciarias tienen más efectos secundarios debido a su mayor antagonismo de los receptores colinérgicos, adrenérgicos e histamínicos. La dosis puede comenzar con 25 mg, aumentando hasta 50 mg después de 1 semana si el paciente la tolera bien y, si fuera necesario, se puede aumentar a 75 mg.
Si después de 1n mes el beneficio obtenido no es suficiente, la dosis de ATC puede aumentarse aún más, siempre que se tolere y los efectos secundarios sean mínimos. Las dosis utilizadas en psiquiatría (150–300 mg) para la depresión son más elevadas que las necesarias para tratar el dolor y otros síntomas gastrointestinales.
Muchos prestadores optan por comenzar con dosis bajas, presumiblemente para evitar efectos secundarios o aliviar la ansiedad anticipatoria. Sin embargo, si se inicia con 10 mg, es necesario aumentar la dosis a una dosis objetivo más elevada. Si con dosis bajas el paciente informa efectos secundarios de inmediato puede ser un efecto nocebo. En este caso, se aconseja que el paciente continúe 1 semana con la misma dosis hasta adaptarse, para luego seguir con los aumentos necesarios. Las dosis más elevadas, hasta 150 mg/d pueden provocar efectos muscarínicos.
> Inhibidores selectivos de la recaptación de serotonina
Los ISRS actúan mediante el bloqueo selectivo del transportador presináptico de 5-HT, estimulando la neurotransmisión de 5-HT y, en consecuencia, estimulando el tránsito intestinal. Sin embargo, al no actuar sobre los receptores de NA, los ISRS no tratan el dolor. Su efecto serotoninérgico primario, sin efecto noradrenérgico, produce beneficios esperados más significativos en el tratamiento de la ansiedad, el trastorno obsesivo-compulsivo y las conductas relacionadas con la fobia. Se pueden agregar a un ATC o a un IRSN en dosis bajas cuando la ansiedad es dominante. Del mismo modo, se pueden usar los ISRS en lugar de un ATC para tratar a un paciente con SII-C cuando el dolor no es dominante.
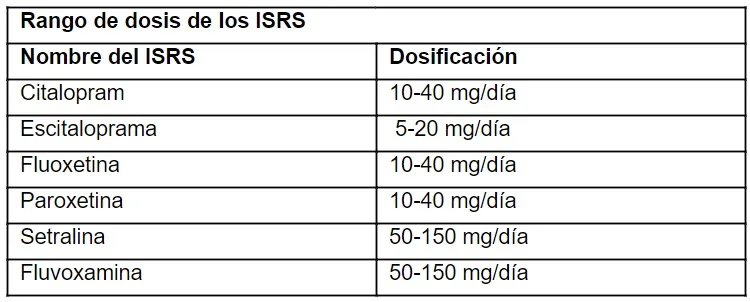
Los ISRS tienen más probabilidades de causar diarrea mientras que los ATC tienden a provocar estreñimiento debido a su efecto NA. Los ISRS incluyen fluoxetina, fluvoxamina, sertralina, paroxetina, citalopram y escitalopram. Aunque todos actúan sobre la inhibición de la recaptación de 5-HT, cada uno tiene propiedades farmacológicas específicas, como un mayor antagonismo de 5-HT2C de la fluoxetina y una mayor acción anticolinérgica de la paroxetina, por lo que a diferencia de los otros ISRS, la paroxetina puede producir estreñimiento.
La sertralina, el citalopram y el escitalopram tienden a tener menos interacciones farmacocinéticas, ya que exhiben efectos mínimos sobre el sistema enzimático del citocromo P450. Sin embargo, la fluoxetina y la paroxetina tienen mayor riesgo de interacciones farmacocinéticas con otros medicamentos, debido a su fuerte inhibición de las isoenzimas 1A2 y 2D6 del P450. Por lo tanto, deben ser administrada con precaución cuando se usan junto con ATC y betabloqueantes como el metoprolol, los opioides, el litio, el triptófano y los inhibidores de la monoaminooxidasa.
Los ISRS son agentes farmacológicos de primera línea para tratar los trastornos de ansiedad, pero tienen el potencial de inducir inquietud y exacerbar la ansiedad al inicio del medicamento. Por lo general, se inician con la mitad de la dosis inicial habitual para minimizar estos posibles efectos adversos ansiogénicos. La dosis puede aumentar gradualmente hasta la dosis inicial habitual después de aproximadamente 1 semana.
El efecto máximo del ISRS generalmente se retrasa 3-4 semanas , lo que puede representar un problema para aquellos pacientes con ansiedad significativa. Esto complica el tratamiento y causa un deterioro funcional importante. Una estrategia útil para esta situación es indicar una benzodiazepina de acción prolongada para cubrir temporalmente este tiempo de retraso y proporcionar alivio sintomático para los síntomas de ansiedad. La dosis de la benzodiazepina debe reducirse gradualmente después de aproximadamente 4 semanas de tratamiento con ISRS. Otros efectos secundarios de los ISRS son agitación, alteración del sueño, náuseas, diarrea, sudores nocturnos, cefalea, pérdida de peso y disfunción sexual.
> Inhibidores de la recaptación de serotonina y noradrenalina
Los IRSN bloquean la recaptación presináptica de 5-HT y NA, lo que aumenta la neurotransmisión de ambas y disminuye la percepción del dolor visceral sin efectos antihistamínicos ni anticolinérgicos. Tienen menos efecto sobre la motilidad intestinal que los ATC, por lo que pueden usarse como tratamiento neuromodulador de primera línea en presencia de estreñimiento, con menor riesgo de efectos adversos. Su valor ha sido demostrado para el dolor somático, como la fibromialgia, la neuropatía diabética o las migrañas.
No se ha estudiado adecuadamente para el dolor visceral. Aun así, se los utiliza comúnmente fuera de indicación para este propósito, con beneficios empíricos debido a la menor carga de efectos secundarios que los ATC y una reducción similar del dolor. Cabe señalar que, además de mostrar beneficios en la depresión y los trastornos dolorosos, los IRSN mejoran significativamente la ansiedad, por lo que podrían considerarse para este propósito como monoterapia o como parte de una terapia combinada. Los IRSN se prescriben como agentes primarios para tratar el SII y otros TIIC dolorosos.
Se pueden utilizar en pacientes con dolor que no han respondido al tratamiento inicial con ATC o experimentaron efectos secundarios intolerables de los ATC, que les impidieron alcanzar una dosis potencialmente terapéutica. En cuanto a los efectos adversos relacionados con el uso de los IRSN, pueden presentarse náuseas, más frecuentemente con duloxetina, pero se pueden minimizar si se toman con las comidas.
Otros efectos secundarios relacionados con los IRSN son hipertensión, más frecuentemente con venlafaxina, agitación, mareos, alteración del sueño, fatiga, cefalea, especialmente al disminuir las dosis y, en casos raros, disfunción hepática. La inhibición de la recaptación de NA varía según cada neuromodulador, por lo que la dosis es diferente para cada agente.
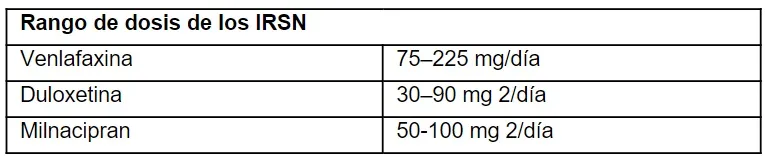
La venlafaxina en dosis de 75–225 mg para la depresión a actúa principalmente como un ISRS en dosis más bajas, pero se necesitan dosis más elevadas (0,225 mg) para lograr la inhibición de la NA y ser eficaz como tratamiento del dolor. La duloxetina tiene una afinidad fuerte y similar por el transportador de 5-HT y la NA, actuando como un verdadero IRSN incluso en dosis más bajas; En un estudio comparativo que evaluó la actividad de la duloxetina en pacientes con SII-D mostró una remisión clínica del dolor y la diarrea, así como un aumento del umbral de sensibilidad visceral, mediante la prueba de dilatación con balón. El milnaciprán es más potente en la inhibición de la recaptación de NA en comparación con su capacidad para inhibir la recaptación de 5-HT. Por esta razón, se utiliza para el tratamiento del dolor somático crónico y, aunque es un IRSN, en EE. UU. no se comercializa para la depresión. Esto puede ayudar a facilitar la aceptación por parte de los pacientes a quienes les preocupa que se les prescriba un medicamento psiquiátrico.
> Antidepresivos tetracíclicos o noradrenérgicos y serotoninérgicos específicos
La NA y los antidepresivos serotoninérgicos específicos, conocidos como TNAS, tienen efectos indirectos que resultan en un aumento de la actividad serotoninérgica y de la NA, a través del antagonismo sobre los receptores α2 NA, 5-HT2A, 5-HT2C 5-HT3, H1 y muscarínico 1. El agente más representativo de esta clase es la mirtazapina. Sin embargo, sus efectos parecen ser principalmente sobre la ansiedad, la saciedad temprana, las náuseas y otros síntomas asociados con trastornos esofágicos y gastroduodenales, por lo que su uso en el SII es limitado.
Debido a su efecto sedante, en general se administra a la hora de acostarse. Sin embargo, puede ser transitorio, y hay un efecto paradójico, con sedación, que disminuye con las dosis más elevadas de mirtazapina. Este fármaco potencia la neurotransmisión de 5-HT y NA bloqueando los autorreceptores y heterorreceptores α2 presinápticos de NA en las neuronas NA y 5-HT, que actúan como frenos en la liberación tanto de NA como de 5-HT de las respectivas neuronas. Por otra parte, como algunos de los ATC, poseen propiedades antagonistas de los receptores 5-HT2A y 5-HT2C, lo que puede explicar algunas propiedades antidepresivas adicionales. También tiene un perfil de efectos secundarios más favorable al bloquear algunas de las acciones no deseadas de los receptores de potenciación de la transmisión de 5-HT. Lo mismo aplica a sus propiedades antagonistas de 5-HT3, lo que puede explicar su perfil de efectos secundarios gastrointestinales más favorable, incluyendo la reducción de náuseas, dolor y diarrea, aunque este mismo mecanismo podría inducir estreñimiento. Asimismo, a través de sus propiedades antagonistas de H1 y 5-HT2C, la mirtazapina puede causar aumento del apetito y del peso, sedación, fatiga, sudoración y sequedad de boca.
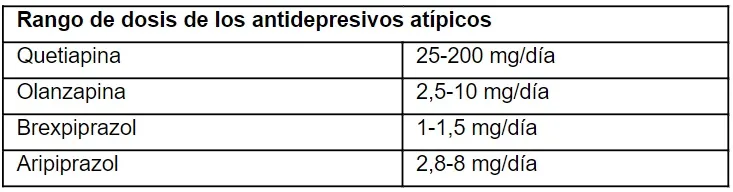
Los AAA son un grupo de fármacos de segunda generación, que se diferencian de los antipsicóticos de primera generación por presentar menos efectos adversos. Esta clasificación incluye: quetiapina, olanzapina, brexpiprazol y aripiprazol. Sin embargo, los más utilizados para los TIIC son la quetiapina y la olanzapina. Los AAA actúan a través de mecanismos complejos, lo que produce efectos clínicos favorables, como la reducción de la ansiedad y la regulación de los patrones de sueño. Los AAA también tienen efectos como inhibidores del transportador de NA, lo que es una ventaja teórica para los efectos analgésicos; en particular, la quetiapina ha sido utilizada como agente potenciador o tratamiento de segunda línea en pacientes con dolor abdominal relacionado con el SII que no responden a los ATC o IRSN.
El objetivo de los antipsicóticos tradicionales es la actividad antagonista del receptor de dopamina (D2), su modulación es responsable del efecto antipsicótico y también es la causa de efectos secundarios no deseados como el extrapiramidalismo, la discinesia, la hiperprolactinemia y los trastornos afectivos o cognitivos. Por otro lado, los AAA tienen propiedades antagonistas del receptor 5-HT2A (olanzapina, quetiapina), disociación rápida del receptor D2, agonismo parcial del receptor D2 y/o agonismo parcial del receptor 5-HT1A (quetiapina).
Estos mecanismos de acción adicionales reducen el impacto de su actividad antagonista del receptor D2 y, por lo tanto, reducen la incidencia de efectos secundarios. Sin embargo, en relación con sus propiedades anticolinérgicas adicionales, los diferentes efectos antagonistas de los receptores H1, 5-HT2C, α1-NA y/u otros mecanismos, no muy conocidos, los AAA pueden aumentar el apetito y causar un síndrome extrapiramidal, aumento de peso, fatiga, sudoración, mareos, enfermedad cardiometabólica y sedación. Por lo tanto, aunque en el tratamiento del SII y los TIIC se prescriben dosis bajas de estos agentes, los mismos deben usarse con suficiente cuidado y ser controlados para detectar efectos secundarios, sobre todo cuando se usan en forma crónica. Sin embargo, la mayoría de estos efectos secundarios se informan en la literatura psiquiátrica con dosis 5 a 10 veces mayores que las prescritas para los trastornos gastrointestinales. Por lo tanto, con las dosis más bajas utilizadas para los trastornos gastrointestinales se esperan menos efectos secundarios.
Las propiedades farmacológicas por las que la quetiapina y la olanzapina actúan para mejorar las náuseas, el dolor abdominal y los síntomas generales de los TIIC siguen siendo inciertas.
Se sabe que la olanzapina y la quetiapina tienen propiedades antagonistas combinadas de D2/5-HT2A, características de la mayoría de los AAA, además de propiedades anticolinérgicas y antagonistas de H1, 5-HT2C y α1. La quetiapina tiene propiedades agonistas parciales de 5-HT1A adicionales, así como efectos inhibidores de la recaptación de NA, lo que puede proporcionar una justificación para su uso en el SII y otras TIIC.
| Selección del neuromodulador central |
La elección de un neuromodulador central para el tratamiento del SII debe hacerse según las propiedades farmacológicas de los diferentes grupos y los síntomas predominantes de cada paciente, así como hay que considerar los posibles efectos secundarios.
> Cómo prescribir neuromoduladores centrales
Enfoque general
La prescripción de un neuromodulador central implica proporcionar la justificación de su uso, aclarar sus beneficios y efectos secundarios previstos y prestar atención a las quejas del paciente. No es raro que los pacientes crean que se está recetando un neuromodulador central para una afección psiquiátrica en lugar de un TIIC. Es importante explicarles, de manera clara y concisa, el significado del EIC y vincular sus síntomas con la desregulación entre el cerebro y el intestino. Por lo tanto, los neuromoduladores no se utilizan necesariamente para el tratamiento de la depresión, pero son una alternativa terapéutica en el manejo de los TIIC. Resulta útil utilizar el término “neuromodulador” en lugar de “antidepresivo”. También ayuda a aclarar que estos medicamentos pueden tratar el dolor y otros síntomas gastrointestinales independientemente del tratamiento de la depresión, mientras que las dosis son más bajas que las usadas para la depresión mayor. Esto evitará que el paciente se preocupe de que sus síntomas sean subestimados o sean considerados producto de su imaginación. Este enfoque fortalece la comprensión del paciente y reduce la posibilidad de incumplimiento. También ayuda a tener en cuenta que el dolor crónico puede provocar ansiedad y depresión, por lo que estos medicamentos pueden ayudar a ambos componentes. De esta manera, el paciente estará más abierto a aceptar un componente de ansiedad y depresión en su enfermedad.
Pruebas farmacogenómicas
Las pruebas farmacogenómicas han ganado terreno en la selección de un neuromodulador para el tratamiento de enfermedades psiquiátricas. La farmacogenómica es el estudio de la variabilidad de la expresión de genes individuales relevantes para la susceptibilidad a la enfermedad, así como la respuesta a los fármacos. Se utiliza para identificar interacciones determinadas genéticamente y perfiles de neuromoduladores para optimizar los beneficios y reducir la toxicidad.
En la práctica, puede determinar si un paciente es un metabolizador rápido (niveles sanguíneos bajos; beneficio reducido) o lento (niveles sanguíneos elevados y toxicidad), lo que ayuda a determinar la selección de medicamentos o su dosis. También ayuda a la hora de complementar el tratamiento con varios medicamentos cuando se deben evitar los efectos de interacción. Sin embargo, su valor clínico aún no se ha determinado para los trastornos gastrointestinales, por lo que es solo una guía. Los autores proponen que las pruebas no sean necesarias inicialmente.
La elección del neuromodulador, la dosis inicial y los posibles cambios a lo largo del tiempo deben realizarse en función de los síntomas predominantes y la tolerancia al fármaco. Sin embargo, ellos creen que las pruebas farmacogenómicas son una opción en 2 condiciones.
En primer lugar, cuando el paciente no informa ningún beneficio sintomático con dosis elevadas de neuromoduladores, para determinar si el paciente es un metabolizador rápido. Si es así, se puede cambiar a otro medicamento con metabolismo normal.
En segundo lugar, las pruebas pueden ser valiosas para pacientes con muchos efectos secundarios de varios medicamentos. Las pruebas pueden determinar si el paciente es un metabolizador lento, por lo que acumula niveles sanguíneos elevados y el médico puede entonces buscar una opción mejor. Si el estudio muestra un metabolismo normal, esto puede ayudar a la adherencia del paciente. Entonces se podría intentar alentarlo a continuar un poco más con la medicación, hasta que se produzca el beneficio terapéutico y disminuyan los efectos secundarios.
| Objetivos del tratamiento basados en los síntomas |
La selección de un neuromodulador en pacientes con SII se debe hacer con cuidado, considerando sus propiedades farmacológicas y efectos secundarios.
> Cuando el síntoma principal es el dolor abdominal
El tratamiento neuromodulador de primera línea es con ATC. Un importante metaanálisis mostró la mejoría global significativa de los síntomas tanto con ATC como con ISRS pero solo los ATC difirieron significativamente en el dolor abdominal. Otra alternativa a los neuromoduladores de primera línea para el manejo del dolor son los IRSN. Un metanálisis de estudios con amitriptilina y duloxetina confirmó la eficacia de ambos fármacos en la mejoría del dolor del SII. Sin embargo, los autores advierten que la evidencia para la duloxetina es de menor calidad. No obstante, los IRSN se utilizan cada vez más para el tratamiento de otras afecciones dolorosas. El efecto anticolinérgico de los ATC podría reducirse mediante el uso de aminas secundarias (desipramina y nortriptilina) aunque como alternativa, se podría usar IRSN, cuyo uso en el SII-E con dolor como síntoma predominante parece ser más seguro.
> Cuando el paciente presenta ansiedad
Si bien no son eficaces en el tratamiento del dolor abdominal, los ISRS son útiles cuando predominan los síntomas de ansiedad e hipervigilancia, conductas obsesivas, fobia social o agorafobia. Cuando el síntoma principal es el dolor abdominal junto con ansiedad significativa, los ATC pueden combinarse con ISRS en dosis bajas. En estos casos, puede utilizarse escitalopram por su tolerancia y baja frecuencia de interacciones farmacológicas. Alternativamente, para la ansiedad y el dolor se puede usar un IRSN en monoterapia.
> Cuando el paciente presenta estreñimiento
El hábito intestinal predominante es importante a la hora de elegir un neuromodulador para tratar el SII, tanto por la oportunidad de mejorarlo como para estar atentos a cuándo el tratamiento puede empeorarlo. Cuando predomina el estreñimiento, se deben evitar los neuromoduladores con fuerte acción anticolinérgica, como los ATC de aminas terciarias (por ej., amitriptilina, imipramina). Los IRSN o ATC de aminas secundarias son más aceptables debido a su menor efecto para reducir el tránsito intestinal. Aunque los ISRS generalmente estimulan el tránsito intestinal, no mejoran el dolor del SII-E.
> Cuando el paciente presenta diarrea
Cuando predomina la diarrea, las aminas terciarias como la amitriptilina y la imipramina son una buena opción debido a su fuerte acción anticolinérgica. Si se produce estreñimiento, se puede considerar la opción de tratarlo, especialmente si la terapia neuromoduladora ayuda a reducir el dolor abdominal y otros síntomas. De otro modo, se puede prescribir una amina secundaria que tenga menos efecto anticolinérgico o duloxetina. En pacientes con diarrea cuyo componente de ansiedad predomina sobre el dolor, se podría elegir paroxetina ya que tiene mayor efecto anticolinérgico que los otros ISRS.
> Cuando el paciente tiene hábito intestinal mixto
En estos casos, los ATC de amina secundaria como la desipramina y la nortriptilina, o los IRSN como la duloxetina, podrían ser de preferencia porque no tienen un efecto tan fuerte sobre el tránsito intestinal. Hay que tener en cuenta que la mirtazapina, los ATC de amina terciaria como la amitriptilina y la imipramina y la paroxetina pueden causar estreñimiento. Por el contrario, los ISRS pueden provocar diarrea, por lo que deben ser recetados cuando la ansiedad no puede ser controlada eficazmente con neuromoduladores de otra clase.
Aumento: qué hacer cuando la monoterapia no es suficiente
| Cuando implementar la terapia de aumento |
Cómo implementar la terapia de aumento Cuando el efecto terapéutico del primer agente es parcial, puede ser beneficios agregar otro agente neuromodulador de primera línea . Los beneficios pueden ocurrir con medicamentos que tienen mecanismos de acción complementarios; por lo tanto, si un paciente con SII muestra alivio del dolor usando un ATC pero tiene un control insuficiente de la ansiedad coexistente, entonces se agregaría un ISRS. También puede ser que los pacientes estén usando ISRS prescritos por un psiquiatra. En estos casos, considerar el agregado de un agente ATC o IRSN para controlar los síntomas del SII, comenzando con dosis bajas, idealmente en colaboración con el psiquiatra. Es importante recordar que la dosis habitual de ATC puede ser insuficiente para tratar la condición psiquiátrica o producir efectos secundarios relacionados con la serotonina .
Otra opción es agregar un agente neuromodulador de segunda línea como un AAA, que tiene menos riesgo de efectos secundarios que los antipsicóticos de primera generación. Existe cierta experiencia con el uso de quetiapina para tratar el dolor crónico, la cual también puede mejorar el dolor cuando es utilizada para aumentar los efectos de un ATC o un IRSN. Esta combinación ha añadido efectos clínicos como la reducción de la ansiedad y el establecimiento de un patrón de sueño normal.
Su metabolito principal también tiene efectos como inhibidor del transportador de NA, lo que es una ventaja teórica para los efectos analgésicos. La quetiapina en dosis >200 mg/día puede ser mal tolerada debido a la sedación excesiva, mareos y efectos secundarios metabólicos como el aumento de peso, la hiperlipidemia y la diabetes. Por este motivo, el rango de dosis recomendado sería de 25 a 200 mg/día para pacientes con SII o TIIC. A veces se usan dosis más elevadas, cuando hay comorbilidades psicológicas, como el trastorno de estrés postraumático o la ansiedad.
Cabe señalar, dicen los autores, “que, si bien se recomendamos el uso de AAA, algunos gastroenterólogos y prestadores de atención primaria pueden sentirse incómodos porque no están familiarizados con el uso de AAA” También se debe considerar que las regulaciones para la prescripción de estos medicamentos difieren según los diferentes países. En esta situación, agregan, “recomendamos prescribir AAA en colaboración con un psiquiatra.”
| Efectos secundarios importantes y situaciones que se deben tratar |
Todos los agentes tienen perfiles de efectos secundarios bien reconocidos y deben ser tenidos en cuenta a la hora de recetarlos. Esto es especialmente cierto cuando se combinan medicamentos para aumentar la dosis o cuando los pacientes tienen afecciones médicas subyacentes, como enfermedades cardíacas o embarazo.
> Síndrome serotoninérgico
Muchos de los neuromoduladores centrales activan los receptores de serotonina. Por lo tanto, una posible complicación es el síndrome serotoninérgico, que en su forma más grave se caracteriza por fiebre, hiperreflexia, clonus espontáneo, rigidez muscular, temblores, confusión, taquicardia, convulsiones, dilatación pupilar y mayor riesgo de muerte si no se trata de inmediato. Sin embargo, los prestadores deben estar más alertas a los episodios más leves de aumento de la ansiedad y la taquicardia. El síndrome serotoninérgico es más probable que ocurra cuando se utilizan dosis elevadas de neuromoduladores que inhiben fuertemente la recaptación de serotonina, como los ISRS, o cuando se combinan varios agentes con efectos serotoninérgicos. Las manifestaciones clínicas suelen aparecer poco después de implementar la terapia de aumento, cuando los niveles séricos de serotonina son más elevados. Cuando el síndrome se presenta se deben suspender temporalmente todos los medicamentos con propiedades serotoninérgicas. La reimplementación se debe hacer en forma gradual, comenzando con dosis bajas que se van aumentando lentamente durante varios días o 1 semana. Por otra parte, otras clases de medicamentos como el tramadol, el ondansetrón o los triptanos también pueden aumentar los niveles de serotonina y desencadenar el síndrome.
> Efectos secundarios cardíacos
Prolongación del intervalo QT
Aunque las primeras publicaciones sugieren que los ISRS y los IRSN tienen menor riesgo de enfermedad cardiovascular en comparación con los ATC, muchos de los antidepresivos más nuevos no están exentos de provocar enfermedades cardíacas, entre ellas la prolongación del intervalo QT. Un intervalo QT aumentado puede estar asociado con una taquiarritmia ventricular maligna conocida como Torsade de Pointes. El riesgo de prolongación del QT debe tenerse en cuenta durante el uso de ATC y en pacientes que usan ISRS. El citalopram parece ser el agente que con más frecuencia provoca la prolongación del intervalo QT corregido. No se ha identificado una asociación clínicamente consistente con defectos de conducción cardíaca o arritmias con los IRSN. Sin embargo, la venlafaxina (>200 mg/día) y la duloxetina se han asociado con aumentos en la presión arterial diastólica. Aunque el riesgo de enfermedad cardiovascular no es elevado en los usuarios de neuromoduladores centrales, para que sean eficaces deben prescribirse en las dosis más bajas necesarias. Se debe considerar la realización de un electrocardiograma (ECG) para evaluar la prolongación del intervalo QT y las arritmias cardíacas, y debe hacerse en la población de edad avanzada y en pacientes con enfermedad cardíaca o tratamiento concomitante con fármacos que se sabe provocan la prolongación del intervalo QTc. Algunos ejemplos son los antiarrítmicos, como la amiodarona, el sotalol, la quinidina, la procainamida, el verapamilo y el diltiazem. Por otra parte, se deben considerar los fármacos no cardiovasculares, como el ondansetrón, los macrólidos, los antibióticos fluoroquinolónicos y los agentes antipsicóticos de primera generación, como el haloperidol, la tioridazina y el sertindol. Si el ECG confirma la prolongación del intervalo QT, se debe suspender la medicación de alto riesgo y reiniciar el tratamiento con una dosis más baja después de una consulta cardiológica, para luego repetir el ECG.
Hipotensión ortostática
El riesgo de hipotensión ortostática secundaria al uso de neuromoduladores centrales ha sido bien establecido con los ATC debido a su conocida actividad antagonista del receptor α1-adrenérgico. La paroxetina parece ser el ISRS más frecuentemente asociado con la hipotensión ortostática debido a sus efectos anticolinérgicos, especialmente en la población de edad avanzada. Sin embargo, los principales mecanismos asociados con la hipotensión ortostática inducida por otros ISRS siguen siendo desconocidos. La mirtazapina también puede causar hipotensión ortostática hasta en el 7% de los pacientes. Sin embargo, la venlafaxina, debido a su fuerte acción noradrenérgica, puede causar este efecto secundario en más del 50% de los pacientes>60 años.
El riesgo de hipotensión ortostática secundaria al uso de neuromoduladores centrales ha sido bien establecido con los ATC debido a su conocida actividad antagonista del receptor α1-adrenérgico. La paroxetina parece ser el ISRS más frecuentemente asociado con la hipotensión ortostática debido a sus efectos anticolinérgicos, especialmente en la población de edad avanzada. Sin embargo, los principales mecanismos asociados con la hipotensión ortostática inducida por otros ISRS siguen siendo desconocidos. La mirtazapina también puede causar hipotensión ortostática hasta en el 7% de los pacientes. Sin embargo, la venlafaxina, debido a su fuerte acción noradrenérgica, puede causar este efecto secundario en más del 50% de los pacientes>60 años.
Aumento de peso
El aumento de peso relacionado con el uso de neuromoduladores centrales puede ser beneficioso para pacientes con TIIC con saciedad temprana y bajo peso. Aun así, puede resultar inadecuado cuando hay riesgo de sobrepeso y trastornos metabólicos. Este efecto secundario puede ocurrir durante las fases aguda y de mantenimiento del tratamiento con neuromoduladores centrales.
El aumento de peso relacionado con el uso de neuromoduladores centrales puede ser beneficioso para pacientes con TIIC con saciedad temprana y bajo peso. Aun así, puede resultar inadecuado cuando hay riesgo de sobrepeso y trastornos metabólicos. Este efecto secundario puede ocurrir durante las fases aguda y de mantenimiento del tratamiento con neuromoduladores centrales.
El aumento de peso inducido por neuromoduladores centrales puede ocurrir debido a la interacción de varios mecanismos: (i) acción sobre neurorreceptores específicos, (ii) disminución del gasto calórico debido a efectos sedantes, (iii) cambio en la preferencia alimentaria y, (iv) sequedad de boca/garganta que puede inducir un aumento de la ingesta de bebidas calóricas. Como se mencionó en secciones anteriores, la afinidad de los neuromoduladores por el receptor H1 parece estar relacionada con el aumento de peso. Basado en esta hipótesis, un estudio evaluó el aumento de peso como parte del síndrome metabólico durante el tratamiento con antidepresivos y mostró que los pacientes que utilizaron amitriptilina, trimipramina, mirtazapina y nortriptilina tenían una elevada afinidad por el receptor H1 y experimentaron un aumento de peso significativamente mayor que aquellos que usaron duloxetina, venlafaxina, citalopram, escitalopram, sertralina, paroxetina y fluoxetina, que mostraron una baja afinidad por el receptor H1.
La magnitud del efecto se ha cuantificado en pacientes que recibieron dosis bajas o moderadas de ATC administrados durante un promedio de 6 meses. Hubo un aumento de peso medio de 0,59–1,32 kg/mes, lo que llevó a un aumento de peso total promedio de 1,36–7,26 kg, dependiendo del fármaco, la dosis y la duración del tratamiento. el aumento de peso es más común cuando se combina un antidepresivo con un AAA. Aunque los ISRS se asocian comúnmente con pérdida de peso al menos inicialmente, la evidencia sugiere que la paroxetina puede inducir aumento de peso. En cuanto a los IRSN, el aumento de peso parece ser un efecto adverso poco común en pacientes tratados con venlafaxina y duloxetina. Si se produce un aumento de peso durante el tratamiento con neuromoduladores se aconseja reducir la dosis. Otras opciones incluyen cambios en la dieta y posiblemente el uso de intervenciones para el tratamiento de la obesidad, como la metformina o el péptido símil glucagón.
|
Complicaciones relacionadas con el embarazo
|
Los neuromoduladores centrales se consideran seguros durante el embarazo, en especial los ATC, los IRSN, la mirtazapina y los AAA. Aunque los ISRS parecen ser menos seguros, son los antidepresivos más recetados durante el embarazo.
La evidencia muestra que se asocian con menor crecimiento de la cabeza del feto y mayor riesgo de parto prematuro. Se debe evitar la paroxetina ya que está relacionada con defectos cardíacos (y otros) congénitos comparada con otros ISRS. Por ejemplo, la sertralina parece aumentar el riesgo de cardiopatías y craneosinostosis, el citalopram con malformaciones cardíacas y el escitalopram con malformaciones musculoesqueléticas. Los IRSN no parecen asociarse con mayor riesgo de malformaciones congénitas pero sí con mayor riesgo de hemorragia posparto (poca evidencia) y la venlafaxina con hipertensión durante el embarazo.
El tratamiento con neuromoduladores centrales durante el embarazo debe sopesarse con sus riesgos asociados. Si la paciente está estabilizada con un fármaco específico es preferible mantener el mismo tratamiento, excepto la paroxetina. Si se trata de una mujer que no ha recibido tratamiento con neuromoduladores, el uso de ATC, mirtazapina, AAA e IRSN son alternativas bastante seguras. Si se requieren ISRS, la sertralina y el citalopram parecen ser las alternativas más adecuadas.
| Prescripción y suspensión de neuromoduladores centrales |
> Cómo prescribir y disminuir gradualmente la dosis
La práctica general es prescribir neuromoduladores centrales para reducir el dolor abdominal, las náuseas, la distensión abdominal, la dismotilidad intestinal y, en ocasiones, la ansiedad o la depresión. Se debe ajustar la dosis hasta alcanzar una dosis óptima que proporcione beneficios. Los autores recomiendan prescribir el medicamento a la mitad de la dosis durante 1 o 2 semanas para evaluar los efectos secundarios y, si no aparecen, se puede prescribir la dosis completa. Si aparecen efectos secundarios y se toleran, se debe alentar al paciente a continuar con el tratamiento durante 1 o 2 semanas más porque es probable que los efectos disminuyan y luego se pueda aumentar hasta la dosis deseada. En general, si no se producen efectos secundarios con la dosis inicial, es mucho menos probable que se produzcan al aumentar la dosis.
Puede haber efectos nocebo cuando el paciente experimenta síntomas relacionados más con la ansiedad anticipatoria o el condicionamiento de experiencias terapéuticas anteriores en lugar de corresponder al efecto farmacológico del fármaco. Esto puede ocurrir cuando los efectos secundarios no son habituales para el medicamento en particular u ocurren después de tomar 1 pastilla, antes de alcanzar niveles sanguíneos adecuados. En un estudio, la gravedad de los efectos secundarios se correlacionó con los puntajes de ansiedad sin relación con los niveles sanguíneos del medicamento.
Cuando esto ocurre, es importante ayudar al paciente a comprender la importancia de seguir un tratamiento con un medicamento aumentando gradualmente la dosis en lugar de cambiar por otro medicamento. Los neuromoduladores centrales para el SII requieren un uso prolongado. Según los autores, se necesitan 6 a 12 meses o más para aumentar la probabilidad de remisión.
A veces, puede haber una buena respuesta clínica en un período más corto. La decisión de interrumpir el tratamiento depende de la respuesta clínica. Si el paciente logra una mejoría significativa o la mejor resolución de los síntomas durante este período, puede haberse producido la remisión y puede comenzar una reducción lenta de la dosis. Si hay una respuesta parcial, el tratamiento continuará por más tiempo.
El tratamiento también puede continuar cuando existen factores estresantes psicosociales en curso, antecedentes de múltiples episodios o comorbilidades psiquiátricas. La disminución gradual de la dosis comenzará cuando el paciente haya controlado los síntomas durante al menos 6 meses. La dosis se reduce lentamente en 4 semanas (25%/semana) pero si se comprueban efectos de la interrupción puede tardar más, como suele suceder don los IRSN.
Si el paciente tomó el neuromodulador central <4 a 6 semanas, el mismo se puede suspender rápidamente. Se destaca que la mayoría de los síntomas tienden a fluctuar por semanas o meses lo que requiere ajustar la dosis. Después de dicho ajuste esencial esperar de 3 a 4 semanas para determinar su eficacia. Si no es efectivo, se puede cambiar por otro neuromodulador en un tiempo relativamente corto sin necesidad de la reducción gradual de la monoterapia. Por ejemplo, al cambiar de un ATC a un IRSN, su dosis podría reducirse a la mitad mientras se agrega el IRSN a la mitad de la dosis y, luego de 2 semanas, se suspende el ATC mientras se aumenta el IRSN a la dosis completa.
> Síndrome de discontinuación de antidepresivos
La discontinuación abrupta de los neuromoduladores serotoninérgicos (principalmente ISRS e IRSN) puede asociarse con el síndrome de discontinuación de antidepresivos (SDA) integrado por varios síntomas (náuseas, cefalea, síntomas seudogripales, desequilibrio, insomnio, ansiedad, agitación y alteración sensorial como descargas cerebrales y parestesia).
Es más común con los agentes de vida media más corta. Por lo tanto, la interrupción abrupta del ISRS paroxetina, con una vida media <1 día probablemente provoque el SDA. Por el contrario, la fluoxetina tiene una vida media de 3 a 4 días y el SDA es menos común. El citalopram, el escitalopram y la sertralina son intermedios y presentan vidas medias >1 día, pero aun así pueden requerir una reducción gradual para evitar los síntomas del síndrome. No hay una estrategia claramente definida para prevenir y tratar los síntomas del SDA por lo que las atribuciones del paciente a la abstinencia deben ser consideradas.
El paciente que está hipervigilante a los efectos de la abstinencia es más probable que tenga una interrupción del tratamiento dificultosa. Por otra parte, cuando existen comorbilidades como depresión mayor o trastornos de ansiedad, se debe utilizar terapia cognitiva conductual u otras terapias conductuales cerebro-intestinales de manera concurrente para complementar la pérdida del uso de la medicación. Por otra parte, las intervenciones conductuales de autocuidado como la atención plena, la relajación y las relaciones de apoyo explican hasta el 20%–30% de la varianza en la predicción de la interrupción exitosa de los antidepresivos.
Algunas estrategias pueden ser útiles. Es mejor suspender la dosis matutina durante 1 semana y luego suspender la dosis vespertina. Otra alternativa, cuando se planea dejar un antidepresivo es cambiar a un agente con una vida media más larga, como la fluoxetina. Sin embargo, si los síntomas son graves, a veces es necesario reintroducir el neuromodulador y volver a intentarlo utilizando un proceso de suspensión más lento. Dado que la dosis más baja de duloxetina es 20 mg, a veces, cuando se continúa con el protocolo de reducción gradual, los autores recomiendan que los pacientes abran la cápsula y tomen la mitad de la dosis (10 mg).