Introducción
La tirotoxicosis es una afección común asociada al exceso de hormonas tiroideas circulantes, que puede presentarse de mil maneras y por lo tanto es un cuadro que se puede presentar a profesionales de todas las disciplinas médicas. En Europa afecta anualmente a alrededor de 1/2.000 personas.
Aunque la tirotoxicosis se presenta típicamente con pérdida de peso, intolerancia al calor y palpitaciones, hay una gran diversidad de características adicionales, todas las cuales se manifiestan en forma más variada con la edad avanzada y en las personas cuya enfermedad es más leve. Es importante determinar la causa de la tirotoxicosis, ya que esto determina el tratamiento. Algunos expertos distinguen entre el hipertiroidismo y la tirotoxicosis, dejando este último término para describir las condiciones asociadas al exceso de síntesis y secreción de hormonas tiroideas por la glándula tiroides.
¿Cuáles son las causas de la tirotoxicosis y quiénes la padecen?
La causa más común es la enfermedad de Graves, la que está presente en casi el 75% de los casos. Es típica en las mujeres de 30 a 50 años, pero puede ocurrir a cualquier edad, en ambos sexos. Las personas con mayor riesgo de contraer la enfermedad de Graves son las que tienen antecedentes de otros trastornos autoinmunes, antecedentes familiares de una enfermedad tiroidea o de otros trastornos autoinmunes o, los fumadores.
Varios estudios de casos y controles, pero no todos, han mostrado que los informes sobre eventos adversos de la enfermedad aumentaron en el año previo al diagnóstico de la enfermedad de Graves, lo que indica que el estrés puede actuar como un disparador de la enfermedad. Por otra parte, los estudios de observación han mostrado un aumento de la incidencia de un diagnóstico nuevo o de una recaída de la enfermedad de Graves en el período posparto, lo que sugiere que el parto es un factor de riesgo adicional.
Por último, las personas que se están recuperando de la inmunosupresión derivada de un tratamiento antirretroviral activo para el VIH están en alto riesgo de desarrollar la enfermedad de Graves. La tirotoxicosis debida al bocio nodular tóxico es más frecuente en los >60 años mientras que los que viven en zonas con carencia de yodo tienen un riesgo particularmente elevado.
¿Cuál es la fisiopatología de la tirotoxicosis?
La enfermedad de Graves es un trastorno autoinune mediado por anticuerpos que estimulan los receptores de la hormona estimulante del tiroides (TSH), provocando la secreción excesiva de hormonas tiroideas y la hiperplasia de las células de los folículos tiroideos, dando como resultado el hipertiroidismo y el bocio difuso. Tanto los factores genéticos como los ambientales (por ej., cigarrillo, estrés y yodo de la dieta) representan un papel importante en la patogénesis de la enfermedad de Graves.
El hipertiroidismo en un nódulo tóxico solitario y en el bocio multinodular tóxico resulta de la hipersecreción de hormonas tiroideas por uno o más nódulos. Histológicamente, esos nódulos son adenomas foliculares benignos. La tiroiditis (subaguda, silente o posparto) provoca la liberación de hormonas tiroideas preformadas hacia la circulación, como resultado de la destrucción inflamatoria de los folículos tiroideos, causando una tirotoxicosis transitoria.
El hipertiroidismo gestacional ocurre en el primer trimestre del embarazo debido a la hipersecreción de la hormona tiroidea, en respuesta a la gonadotrofina coriónica placentaria ß humana, la cual es estructuralmente similar a la TSH.
El hipertiroidismo gestacional es particularmente común en las mujeres con hiperémesis gravídica, la cual se asocia a niveles elevados de gonadotrofina coriónica β humana. Varios fármacos, entre ellos la amiodarona, el yodo, el litio, el interferón α, la terapia retroviral activa, los inhibidores de la tirosina cinasa y la levotiroxina pueden causar tirotoxicosis de diferentes maneras.
¿Cuáles son las manifestaciones clínicas y las condiciones asociadas?
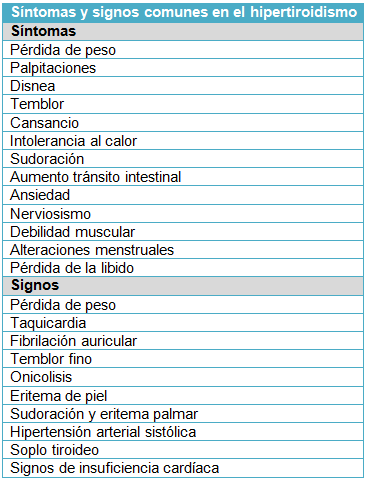
Los síntomas comunes de la tirotoxicosis son: pérdida de peso, intolerancia al calor, palpitaciones, temblores, ansiedad y astenia. Otros pacientes tienden a tener menos síntomas. Un estudio de observación de 3.000 pacientes consecutivos con tirotoxicosis halló que más de la mitad de los pacientes ≥61 años tenía menos de 3 síntomas de tirotoxicosis clásicos. Es común la asociación de tirotoxicosis con fibrilación auricular, particularmente en los mayores de edad. Un estudio epidemiológico reciente de 500.000 adultos mostró una incidencia cumulativa del 13% de fibrilación auricular a lo largo de 8 años en las personas >65 años con tirotoxicosis.
A veces, la tirotoxicosis se asocia con parálisis muscular aguda e hipopotasemia grave, denominada parálisis periódica tirotóxica. Se observa más comúnmente en hombres asiáticos con tirotoxicosis y suele desencadenarse por una actividad física intensa, elevada carga de carbohidratos, alcohol o infección.
Raramente, los pacientes con tirotoxicosis sufren la tormenta tiroidea, una condición que pone en peligro la vida y se presenta con taquicardia, fiebre, agitación, alteración mental, insuficiencia cardíaca y trastornos de la función hepática. Entre los factores precipitantes se halla la falta de cumplimiento del tratamiento, las cirugías, el parto y los traumatismos.
¿Cómo se determina la causa de la tirotoxicosis?
El diagnostico de hipertiroidismo primario se basa en el aumento del nivel de tiroxina sérica con un nivel de TSH <0,05 mUI/L. Si el nivel de tiroxina libre es normal y la TSH está suprimida, se debe determinar el nivel de triiiodotironina (T3), para excluir la tirotoxicosis por T3. Esto debe hacerse en las formas leves de hipertiroidismo y se observa comúnmente asociado al bocio multinodular tóxico o a un nódulo tiroideo tóxico, pero también puede ser una manifestación de la enfermedad de Graves. Los niveles bajos o suprimidos de TSH en presencia de niveles de tiroxina libre y T3 libre normales establece el diagnóstico de hipertiroidismo subclíníco.
Una historia clínica y un examen físico correctos pueden brindar la base para el diagnóstico de tirotoxicosis. Por ejemplo, la oftalmopatía, la dermopatía y la acropaquia son características de la enfermedad de Graves. En ausencia de estas manifestaciones, el diagnóstico de enfermedad de Graves puede confirmarse determinando los niveles de anticuerpos contra los receptores de TSH.
Un metaanálisis reciente ha mostrado que estos anticuerpos analizados mediante métodos de inmunoensayo son altamente sentibles y específicos para el diagnóstico de enfermedad de Graves (análisis de tercera generación; sensibilidad 98%, especificidad 99%). Por el contrario, los anticuerpos antiperoxidassa tiroidea están presentes solamente en el 75% de los casos de enfermedad de Graves. No se hallan anticuerpos contra los receptores de TSH y puede ser de utilidad un centellograma con tecnecio radioactivo para distinguir entre las diferentes causas de tirotoxicosis.
En la tiroiditis subaguda, el estudio de la captación tiroidea de radionúclidos (con tecnecio o yodo radiactivos) permite distinguir las diferentes causas de la tirotoxicosis. En la tiroiditis subaguda, los marcadores inflamatorios como la velocidad de eritrosedimentación y la proteína C reactiva suelen estar aumentadas.
¿Cuándo se debe derivar al paciente al especialista?
Todos los pacientes con tirotoxicosis de reciente comienzo deben ser evaluados en un servicio de atención secundaria, para establecer la causa y planificar el tratamiento. Para las mujeres que ya están en tratamiento con fármacos antitiroideos o que en el pasado han sido tiroidectomizadas es conveniente hacer la consulta pregestación para recibir asesoramiento y optimizar el tratamiento, ya sea con antitroideos o con yodo radioacctivo (I131).
¿Cuáles son las opciones terapéuticas?
Enfermedad de Graves
Las opciones terapéuticas para el hipertiroidismo de la enfermedad de Graves son los fármacos tionamida, el I131 o la tiroidectomía y los β bloqueantes (por ej., 80 mg de propranolol de liberación modificada, 1 o 2 veces/día). Estos últimos son útiles para el control de los síntomas en todos los pacientes con tirotoxicosis, pero están contraindicados en aquellos con tirotoxicosis y fibrilación auricular. Un ensayo aleatorizado controlado de fármacos antitiroideos, tiroidectomía o I131 en la enfermedad de Graves no mostró diferencias significativas en la satisfacción de los pacientes respecto de las 3 opciones terapéuticas. Cada modalidad tiene sus propias ventajas y desventajas, y habitualmente, un factor decisivo en la elección del tratamiento es la preferencia del paciente es.
Fármacos tionamida
Para el tratamiento de la tirotoxicosis, durante más de 60 años se han utilizado las tionamidas como el propiltiouracilo, el carbimidazol y su metabolito activo, el metinazol.
Un metaanálisis de estudios aleatorizados controlados mostró la remisión prolongada del ihipertiroidismo de la enfermedad de Graves en casi el 50% de los pacientes tratados a largo plazo con tionamidas. El carbimidazol o el metimazol son los preferidos para comenzar el tratamiento, ya que tienen un riesgo bajo de provocar lesiones hepáticas graves (alrededor de 1/10.000 adultos) según pudo observarse recientemente durante el uso del propiltiouracilo. Por otra parte, el carbimidazol o el metimazol pueden tomarse 1 vez/día y no cada 8 o 12 horas como sucede con el propiltiouracilo, mientras que su vida media más prolongada permite un control rápido.
Las tionamidas reducen los niveles de hormonas tiroideas circulantes actuando como un sustrato preferencial para la yodación por la peroxidasa tiroidea, la enzima fundamental en la síntesis de la hormona tiroidea. La mayoría de los pacientes con hipertiroidismo de la enfermedad de Graves retorna al eutiroidismo luego de 4-8 semanas de tratamiento con metimazol (15-30 mg /día) o carbimazol (20-40 mg/día).
Los pacientes con hipertiroidismo grave (tiroxina libre >70 pmol/L), bocio grande o exposición reciente al yodo (incluyendo los medios de contraste utilizados para la tomografía computarizada) pueden requerir un tratamiento más prolongado o con dosis de tionamidas más elevadas.
Luego de alcanzar el eutiroidismo se pueden aplicar dos regímenes. Uno, es el denominado “reemplazo bloqueante”, en el que la dosis de tionamida se toma en forma constante (por ej., 40 mg/día de carbimazol) lo que bloquea toda la producción de hormona tiroidea, seguido por la administración de levotiroxina (100 μg/día para las mujeres, 125 μg/día para los hombres).
En el segundo régimen, denominado “titulado”, la dosis de tionamida se va disminuyendo progresivamente a intervalos regulares, con el fin de permitir la síntesis endógena de hormona tiroidea, para luego continuar en forma regulada. Con ambos regímenes se consigue una remisión de casi el 50%, siempre que el tratamiento sea continuado y dure entre 6 y 18 meses; luego de este período, el tratamiento se suspende. La mayor desventaja de cada régimen terapéutico es la duda acerca de si se producirá o no una recaída luego de la suspensión del tratamiento y sobre la calidad e intensidad de sus efectos adversos potenciales.
En casi el 5% de los pacientes que recibe antitiroideos aparece una erupción pruriginosa que suele ser transitoria. Un efecto más raro pero ocasionalmente letal de las tionamidas es la agranulocitosis, la cual aparece en 1 cada 300 personas. Comúnmente se presenta con dolor de garganta, úlceras y fiebre elevada. Los pacientes que inician tratamiento antitiroideo deben recibir información clara, verbal y escrita, sobre sus efectos adversos, y la indicación de suspender el fármaco ante la aparición de esos signos de alarma y hasta obtener los resultados de un hemograma. La agranulocitosis ocurre con más frecuencia en los primeros 3 meses del tratamiento (media, 30 días) y es rara luego de los 6 meses. Un factor de riesgo importante es la dosis utilizada.
Cualquiera sea el régimen utilizado, el tratamiento más allá de los 18 meses no mejora las tasas de remisión, por lo que se aconseja que no dure más que esos 18 meses. Una vez finalizado el tratamiento, a las 4-6 semanas se harán pruebas de la función tiroidea, para detectar una recaída temprana. El paciente ideal para tratar con medicamentos antitiroideos en la enfermedad de Graves son los que tienen una elevada posibilidad de remisión después del tratamiento. Así, una mujer >40 años con una glándula tiroides pequeña, sin manifestaciones extratiroideas, hipertiroxinemia leve o tirotoxicosis por T3 en la presentación y un título bajo de anticuerpos anti receptores de TSH tiene más probabilidades de tener buenos resultados con el tratamiento farmacológico. Cuando después de una recaída no es factible hacer un tratamiento definitivo con I131 o cirugía, es aceptable indicar dosis pequeñas de tionamida a largo plazo.
Yodo radioactivo
El I131 está absolutamente contraindicado durante el embarazo y la lactancia
El I131 es un emisor de radiaciones β y gamma, las cuales son rápidamente concentradas por la glándula tiroides luego de la ingestión oral. La radiación β tiene un radio de 2 mm de actividad e induce un daño al ADN que provoca la muerte de las células tiroideas. Entre las 6 semanas y los 6 meses de tratamiento radiante, la mayoría de los pacientes con enfermedad de Graves llega secuencialmente al eutiroidismo y al hipotiroidismo.
Se recomienda utilizar una dosis fija pragmática que resulta en eutiroidismo o hipotiroidismo en el 70-90% de los pacientes, ya que por medio de la dosimetría se intenta estimar la dosis individual óptima de I131 que no mejora el resultado. La guía actual del Reino Unido recomienda el uso sistemático de 370 a 550 MBq para la enfermedad de Graves. Sin embargo, los pacientes con un bocio de tamaño grande pueden requerir dosis mayores o repetidas de I131para alcanzar el eutiroidismo.
Aunque comúnmente, el I131 se utiliza en la recurrencia de la enfermedad de Graves o por la existencia de efectos secundarios de los fármacos antitiroideos, también se debe a derivar al paciente a la consulta endocrinológica, para el tratamiento de aquellos con enfermedad de Graves Graves (particularmente los pacientes jóvenes <40 años, hombres y aquellos con bocio de tamaño grande), a quienes les es imposible alcanzar una remisión duradera con los fármacos antitiroideos.
El I131 también es un buen tratamiento para los pacientes que quieren una cura previsible y para quienes aceptan tener una elevada probabilidad de requerir tratamiento con levotiroxina durante toda la vida posterior. Un análisis reciente halló que el uso precoz del I131 es la estrategia terapéutica a largo plazo más barata para la enfermedad de Graves.
Un mes después del tratamiento de la enfermedad de Graves con I131 hay una exacerbación del riesgo (bajo) de tirotoxicosis (aunque también puede haber riesgo de precipitación de una tormenta tiroidea) debido a la liberación de hormona preformada. Para reducir este riesgo se recomienda que los pacientes con bocios grandes, tirotoxicosis graves, cardiopatía isquémica, insuficiencia cardíaca o arritmia deben ser tratados previamente con una tionamida hasta que alcancen el eutiroidismo.
Un metaanálisis mostró que para obtener un resultado óptimo del tratamiento con I131 tanto el metimazol como el carbimazol deben ser suspendidos al menos 1 semana antes del tratamiento radioactivo. Sin embargo, es ampliamente aceptado que el propiltiouracilo debe ser suspendido al menos 2 semanas antes y que los fármacos antitiroideos pueden ser restablecidos 2 semanas después del tratamiento con I131, si el control de la tirotoxicosis continúa siendo importante. Los pacientes deben ser monitoreados regularmente mediante pruebas de la función tiroidea para la detección temprana del hipotiroidismo inducido por el I131.
El I131 está absolutamente contraindicado durante el embarazo y la lactancia, y se debe aconsejar a las pacientes que eviten un nuevo embarazo antes de pasados los 6 meses del tratamiento. En el Reino Unido, a los pacientes que reciben dosis estándar de I131 también se les aconseja tener varias precauciones para minimizar los efectos adversos de la radiación ionizante en otras personas. Por ejemplo, debe evitarse el contacto cercano y prolongado con niños y embarazadas, por lo menos durante las 3 semanas posteriores a la dosis de 400 MBq.
Varios estudios han investigado el riesgo de cáncer después del uso terapéutico de I131 y concluyeron que los cánceres en todos los sitios no difieren en frecuencia en los pacientes tratados con I131 comparados con la población de referencia.
El I131 está relativamente contraindicado en los pacientes con oftalmopatía inflamatoria activa de Graves, ya que la liberación de antígeno tiroideo y el subsecuente hipotiroidismo pueden asociarse con el deterioro de la enfermedad ocular. Sin embargo, el riesgo de deterioro de la oftalmopatía es pequeño en los pacientes con oftalmopatía inactiva, siempre y cuando el reemplazo de la tiroxina se haga prontamente. El riesgo de oftalmopatía es mucho mayor en los fumadores, pero puede ser contrarrestado por un curso corto de prednisolona.
Cirugía tiroidea
La tiroidectomía total (o casi total) es un tratamiento altamente efectivo y predecible para la enfermedad de Graves. Los pacientes con enfermedad de Graves que han sufrido una recaída luego del tratamiento médico adecuado, o aquellos con olfatmopatía de Graves activa o con un bocio antiestético son buenos candidatos para la cirugía. Las complicaciones a largo plazo de la tiroidectomía son la hipocalcemia como resultado de un hipoparatiroidismo que suele ser transitorio y, la paresia de las cuerdas vocales debido al compromiso quirúrgico del nervio recurrente. Los pacientes necesitan alcanzar el eutiroiodismo antes de la cirugía, y cuando no se pueden administrar tionamidas se debe recurrir a la carga de yodo con yoduro de potasio, Lugol o los medios de contraste oral para la colecistografía (ácido iopanoico, 1 gr/día). En casi todos los casos, su administración durante 5-10 días es suficiente para alcanzar el eutirooidismo.
Bocio multinodular tóxico y nódulo tóxico solitario
En el bocio multinodular tóxico y el nódulo tóxico solitario, los fármacos antitiroideos no llevan a una remisión de la tirotoxicosis prolongada. Por lo tanto, para estos casos, el tratamiento de elección es el I131. Cuando no es posible hacer el tratamiento con I131, una alternativa es administrar pequeñas dosis de carbimazol (o de metimazol) a largo plazo o, la cirugía tiroidea.
Tiroiditis
La tirotoxicosis asociada a la tiroiditis es transitoria, y frecuentemente pasa por una fase de hipotiroidismo para luego resolverse en forma espontánea. Los fármacos antitiroideos son ineficaces y deben evitarse. El tratamiento suele estar limitado al control de los síntomas con el uso de los β bloqueantes. Para controlar el dolor que pude haber en la tiroiditis subaguda son útiles los antiinflamatorios no esteroides y a veces, los glucocorrticosteroides sistémicos.
La tirotoxicosis inducida por la amiodarona puede ser el resultado de la autoinmunidad (tipo 1) o de la tiroiditis destructiva con liberación de hormonas tiroideas preformadas (tipo 2). Se recomienda establecer una estrecha colaboración con el cardiólogo, para un mejor manejo de esos pacientes. La forma más común en tiroiditis inducida por amiodarona en el Reino Unido es la de tipo 2. Un ensayo leatorizado controlado reciente halló que el tratamiento más efectivo fue la prednisolona. La tirotoxicosis inducida por amiodarona de tipo 1 se trata con fármacos antitiroideos.
El tratamiento de la tirotoxicosis asociada a otros fármacos como el litio, el interferón α, la terapia anti retroviral altamente activa y los inhibidores de la tirosina cinasa depende de si el mecanismos subyacente es la autoinmunidad o la tiroiditis destructiva. Con frecuencia, estas condiciones son autolimitadas y una investigación oportuna ahorra tratamientos innecesarios. Se recomienda hacer interconsultas con los especialistas.
Situaciones especiales.
Embarazo y lactancia
La enfermedad de Graves es la causa más común de hipertiroidismo en el embarazo; sin embargo, es necesario distinguir del hipertiroidismo gestacional mediado por la gonadotrofina coriónica β humana. Este último se caracteriza la ausencia de oftalmopatía o de bocio grande, ausencia de anticuerpos contra los receptores de TSH y la resolución espontánea del hipertiroidismo a las 20 semanas de gestación.
El tratamiento fundamental del hipertiroidismo de la enfermedad de Graves es el de fármacos antitiroideos, siendo necesario el régimen de las dosis tituladas ya que el reemplazo bloqueante se asocial con riesgo de hipotiroidismo fetal y bocio. Hay evidencias de que todos los fármacos antitiroideos entrañan un riesgo pequeño de embriopatía.
Un estudio de cohorte en todo el territorio nacional de Dinamarca mostró defectos de nacimiento en el 9,1% de los recién nacidos de madres tratadas con carbimazol o metimazol, comparado con el 8,0% tratado con propiltiouracilo y 5,4% en mujeres tratadas con un diagnóstico previo de hipertiroidismo. El espectro de anormalidades congénitas es diferente: aplasia cutis, atresia de las coanas, fístula traqueoesofágica y onfalocele con el carbimazol o el metimazol. Pero estos efectos son potencialmente menos graves que las malformaciones faciales, del cuello, el tracto urinario y cardíacas provocadas por el propiltiouracilo. Este riesgo de defectos congénitos de los fármacos antitiroideos también tiene que contrabalancearse con por el riesgo mucho más raro de hepatotoxicidad materna grave.
Durante el primer trimestre del embarazo, las guías actuales recomiendan optar por el propiltiouracilo. Dada la incertidumbre acerca de los defectos congénitos es necesario debatir ampliamente con las futuras madres. Si las mujeres en edad fértil presentan hipertiroidismo de la enfermedad de Graves y expresan el deseo de embarazarse se deben analizar con ellas las ventajas de un tratamiento definitivo precoz con I131 o cirugía.
La lactancia materna es segura con cualquiera de los 3 fármacos antitiroideos (dosis diaria máxima de 20 mg de metimazol o carbimazol o, 300 mg de propiltiouracilo); sin embargo, debido al riesgo de toxicidad hepática asociado (bajo) con el propiltiouracilo, las guías actuales recomiendan el metimazol o el carbimazol, sobre todo para las mujeres lactantes.
Oftalmopatía tiroidea
En la oftalmopatía de la enfermedad de Graves se debe evitar el I131. El mejor tratamiento pueden ser los antitiroideos en dosis bloqueantes hasta que la oftalmmopatía se torne inactiva. En el caso de intolerancia a este régimen una buena opción alternativa es la tiroidectomía. Los pacientes con oftalmmopatía pueden requerir un tratamiento específico y deben ser derivados tempranamente al especialista.
Hipertiroidismo subclínico
Se considera hipertiroidismo subclínico al estado en el que hay niveles de TSH bajos o suprimidos con niveles de tiroxina libre y T3 circulantes normales. Ocurre en el 2-3% de los pacientes >80 años, de los cuales casi el 0,7% tiene una anormalidad más importante de supresión de la TSH, <0,1 UI/L. Estudios prospectivos muestran más del 50% de pacientes con hipertiroidismo subclínico, particularmente aquellos con un nivel bajo pero no suprimido de TSH (rango 0,1-0,4 mUI/L) tienen una anormalidad transitoria.
Un nivel bajo o suprimido de TSH puede deberse a la acción de varios fármacos, como los opiáceos, la levodopa, las dosis antiinflamatorias de los glucocorticoides, la metformina y la levotiroxina. Por otra parte, los niveles bajos o suprimidos de TSH en forma persistente pueden anticipar una enfermedad sistémica más importante, como la infección crónica o el cáncer manifiesto. Aunque los estudios epidemiológicos muestran que los niveles séricos bajos de TSH se asocian con la fibrilación auricular, y en algunos casos con un exceso de mortalidad vascular, solamente pocos pacientes tienen evidencia de enfermedad tiroidea intrínseca.
Para los pacientes >65 años con niveles persistentemente suprimidos de TSH (<0,1 mUI/L), la opinión actual se inclina por el tratamiento antitioideo, particularmente en presencia de fibrilación auricular y otros problemas cardíacos. En las personas con hipertiroidismo subclínico no tratado, se deben hacer pruebas de función tiroidea anuales, para descartar o detectar la progresión hacia una tirotoxicosis manifiesta.
Traducción y resumen objetivo: Dra. Marta Papponetti