Dos enfoques clave para combatir las enfermedades infecciosas son la prevención y el tratamiento: el primero mediante la administración de vacunas y el segundo mediante la administración de antibióticos.
Si bien los beneficios de los antibióticos para la salud son innegables, su uso tiene consecuencias. La infección con el patógeno bacteriano nosocomial Clostridioides difficile tras la administración de antibacterianos provoca enfermedades gastrointestinales de gravedad variable y un aumento de los costos de atención médica.
La infección por C. difficile se produce cuando se altera la microbiota intestinal autóctona, más comúnmente después de la administración de antibióticos. Esto altera la actividad metabólica de la microbiota, lo que permite la expansión de C. difficile en el intestino, debido a la pérdida de resistencia a la colonización.
El patógeno produce toxinas y, finalmente, la persona infectada elimina la espora ambientalmente estable, que puede contaminar el medio ambiente y fomentar la propagación de C. difficile a otras personas. La estrategia general actual para limitar la infección por C. difficile consiste en prevenirla mediante el cribado, el aislamiento de contactos y la limitación del uso de antibióticos, como las quinolonas.
Dado que la patogénesis de la infección por C. difficile depende de la producción de las potentes toxinas TcdA (toxina A) y TcdB (toxina B) por las células vegetativas de la bacteria, existe la esperanza de desarrollo de vacunas dirigidas a estos factores de virulencia. Sin embargo, los resultados de ensayos clínicos sugieren que es necesario reconsiderar los enfoques de vacunas estándar contra la infección por C. difficile dirigidos a TcdA y TcdB.
Un ensayo de una vacuna compuesta por TcdA inactivada con formalina y TcdB purificada de una cepa de C. difficile altamente toxigénica se detuvo en el primer análisis provisional planificado debido a su inutilidad clínica. Más recientemente, se publicaron los resultados del Ensayo de Eficacia de la Vacuna contra Clostridium difficile (CLOVER), un ensayo aleatorizado de fase 3 de una vacuna desintoxicada genéticamente, compuesta por TcdA y TcdB recombinantes (que contienen sustituciones de aminoácidos específicas para limitar la actividad tóxica), que se desintoxicaron aún más por medios químicos. Aunque el ensayo no mostró un beneficio con respecto al criterio de valoración principal de prevenir un primer episodio de infección, los pacientes vacunados que desarrollaron la infección tuvieron una duración más corta de los síntomas y una menor probabilidad de recibir atención médica que los pacientes que recibieron placebo.
En este contexto, resulta de interés un nuevo tipo de vacuna candidata contra C. difficile, descrita por Alameh, Semon y colaboradores. Desarrollaron una vacuna multivalente de ARN mensajero (ARNm) modificado con nucleósidos administrada en nanopartículas lipídicas (NPL). En la formulación inicial, también incluyeron un ARNm que codifica un factor de virulencia adicional de C. difficile, la metaloproteinasa Pro-Pro endopeptidasa 1 (PPEP-1), que mejora la motilidad al degradar las moléculas de adhesión en la superficie del patógeno.
Encapsulados en NPL, los ARNm que codifican TcdA, TcdB y PPEP-1 (o sus porciones) representan una vacuna trivalente. Los autores también elaboraron versiones recombinantes de las tres dianas vacunales y las administraron con alumbre como adyuvante. La vacuna trivalente de ARNm-NPL y la vacuna recombinante se administraron a ratones.
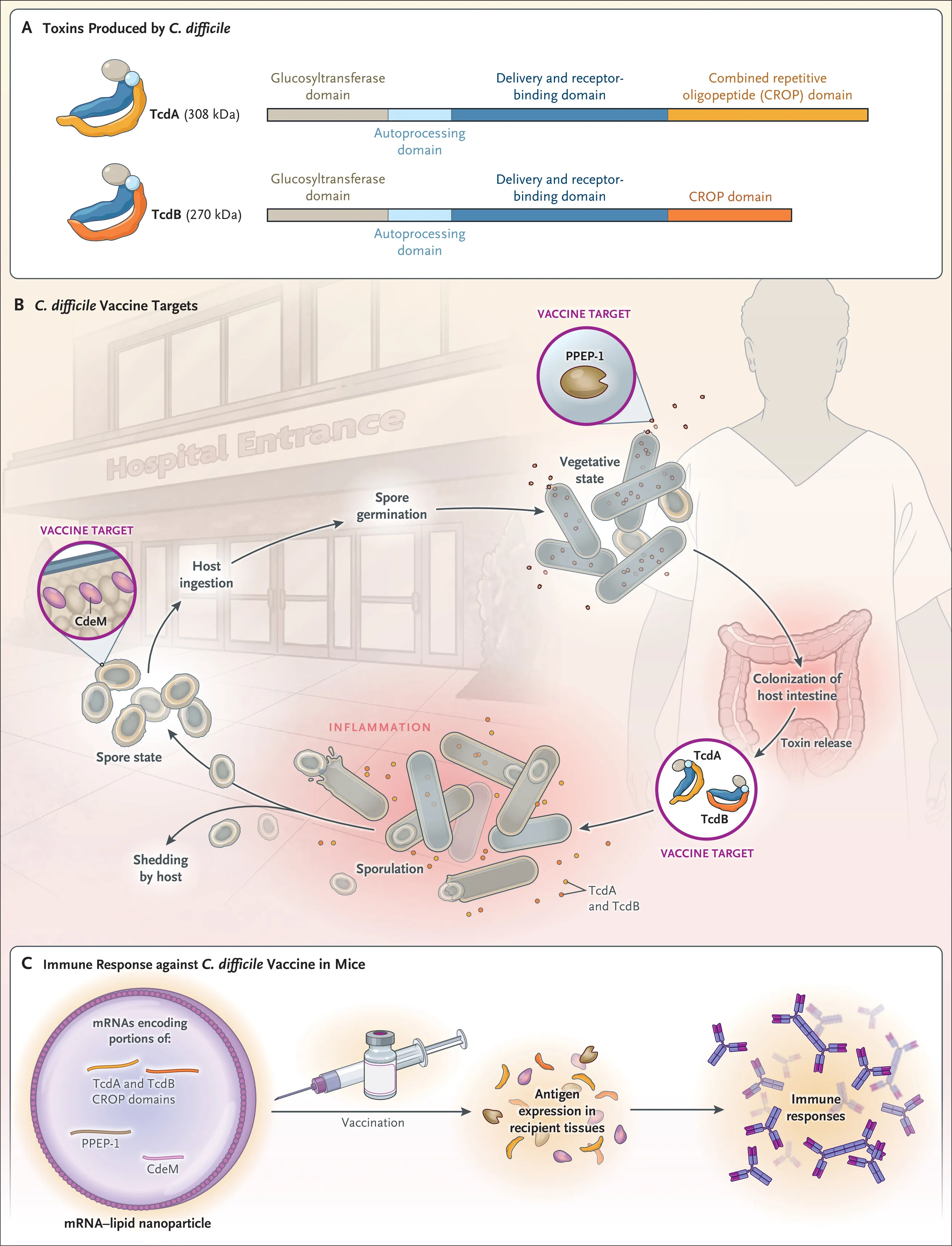
La vacuna de ARNm-NPL generó niveles más altos de anticuerpos contra las tres dianas vacunales que la vacuna recombinante con adyuvante de alumbre. Además, la vacuna de ARNm-NPL proporcionó protección completa contra la inoculación con una dosis alta de TcdA o TcdB purificada administrada por vía intraperitoneal: todos los ratones vacunados sobrevivieron, mientras que todos los ratones no vacunados morían en dos días. Las vacunas recombinantes con alumbre protegieron solo al 20 % de los animales vacunados.
A continuación, los investigadores evaluaron la capacidad de la vacuna multivalente de ARNm-NPL para proteger a los animales en un modelo experimental de infección por C. difficile. Los ratones fueron pretratados con antibióticos y posteriormente expuestos a esporas de una cepa virulenta de C. difficile. Los animales de control no vacunados murieron a causa de la infección en los dos días posteriores a la exposición; todos los animales vacunados sobrevivieron.
Sin embargo, la protección no se asoció con la prevención de la colonización: todos los animales vacunados eliminaron una gran cantidad de C. difficile cultivable y presentaron daño histopatológico en el tejido intestinal equivalente al observado en animales no vacunados. Este hallazgo sugiere que la protección se debió al bloqueo de los efectos sistémicos de las toxinas de C. difficile. Sin embargo, datos adicionales indicaron que la inclusión del antígeno PPEP-1 en la vacuna multivalente resultó en una eliminación más rápida de los niveles luminales de toxina. Se observó un efecto similar en la eliminación de la toxina con una vacuna de ARNm-NPL formulada con un antígeno (CdeM) presente en la superficie de la espora de C. difficile.
Estos resultados sugieren que la activación de respuestas inmunitarias contra la superficie del patógeno, tanto en estado vegetativo como de espora, limita la producción de toxina. La inmunogenicidad de la vacuna tetravalente en un primate no humano se evaluó mediante la inyección de la vacuna en un macaco rhesus. Dos inyecciones resultaron en fuertes respuestas de anticuerpos a los cuatro antígenos.
El estudio de Alameh y sus colegas representa un avance no solo para el desarrollo de vacunas contra C. difficile, sino también para el desarrollo de vacunas contra patógenos bacterianos en general. Sin embargo, es importante señalar que la vacuna ARNm-NPL no previno la colonización por C. difficile ni la inflamación intestinal en animales tratados con antibióticos. El beneficio general de esta nueva vacuna residió en la disminución de la gravedad de la enfermedad, más que en su prevención.
El rápido desarrollo de la vacuna contra el SARS-CoV-2 y el rápido perfeccionamiento de versiones posteriores que se dirigen a las variantes emergentes también ha demostrado el poder de la plataforma de vacunas de ARNm para infecciones virales. Alameh y sus colegas han demostrado que esta plataforma puede utilizarse para atacar un importante patógeno bacteriano, un hallazgo que debería abrir camino al desarrollo de futuras vacunas.
Resumen: Dra. Alejandra Coarasa