La enfermedad inflamatoria intestinal (EII), que incluye la enfermedad de Crohn y la colitis ulcerosa, sigue siendo un desafío clínico, debido a su etiología multifactorial y su impacto en la calidad de vida de los pacientes.
Aunque su causa exacta sigue sin esclarecerse, la evidencia científica actual señala a la disbiosis del microbioma intestinal como un actor central en su patogénesis, asociada a respuestas inmunitarias exacerbadas y a la alteración de la barrera intestinal.
Más allá de su rol en la fisiopatología, la microbiota intestinal emerge como un biomarcador potencial para el diagnóstico, el pronóstico y la predicción de la respuesta terapéutica en EII.
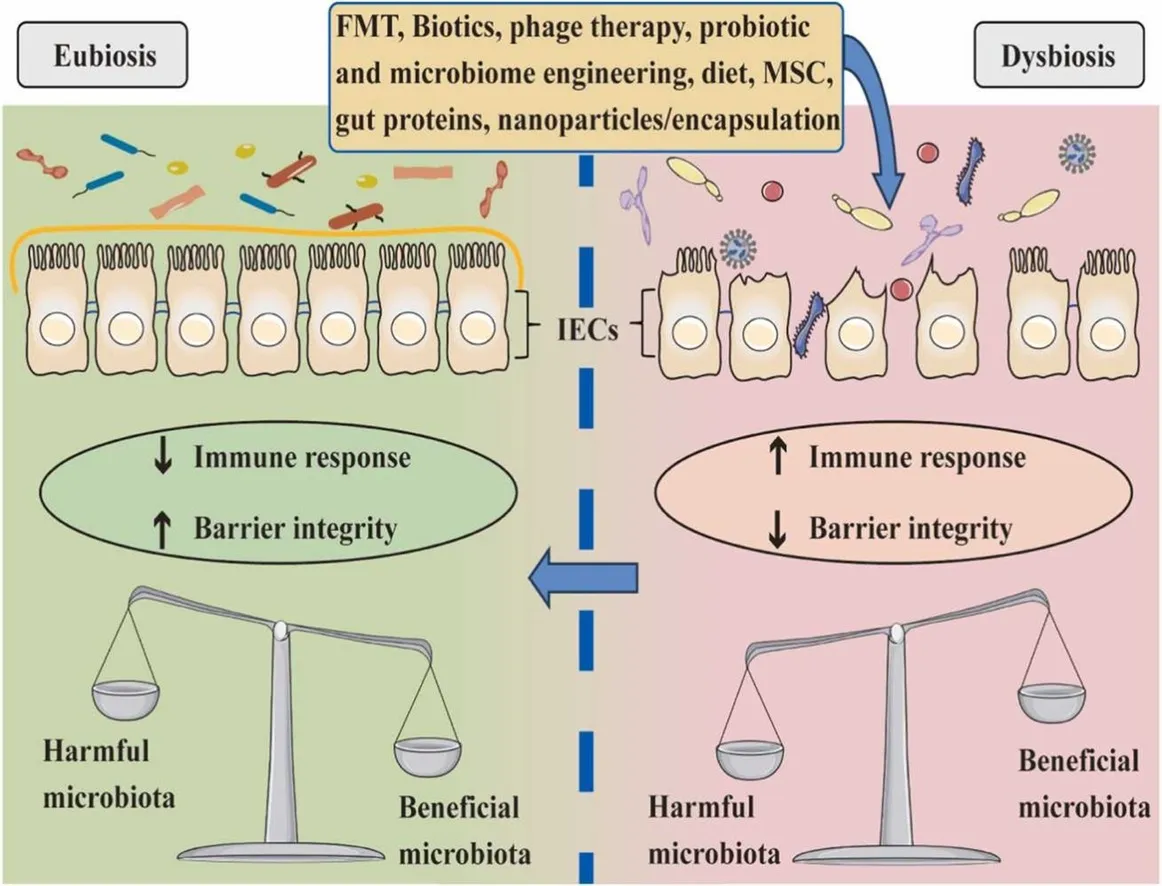
La disbiosis contribuiría a la patogénesis de la EII a través de dos vías principales:
- Respuesta inmune exacerbada: La alteración en la composición microbiana favorece la proliferación de especies proinflamatorias y reduce la abundancia de bacterias comensales beneficiosas. Esto desencadena una activación anormal del sistema inmune intestinal, caracterizada por aumento de las citocinas proinflamatorias (como IL-1β, IL-6, TNF-α y IFN-γ), activación desregulada de células T helper (Th1 y Th17), que perpetúan la inflamación crónica en la mucosa intestinal, disminución de células reguladoras, esenciales para mantener la tolerancia hacia la microbiota comensal,
- Alteración de la barrera intestinal: La disbiosis compromete la integridad epitelial. Hay reducción de la expresión de proteínas de unión estrecha (como claudinas y ocludinas), lo que aumenta la permeabilidad intestinal ("intestino permeable"). hay disminución de la producción de metabolitos microbianos protectores, como el butirato (un ácido graso de cadena corta producido por bacterias comensales); la falta de butirato se asocia con una menor producción de mucina y una mayor susceptibilidad a la invasión de patógenos. La disminución de bacterias productoras de butirato (por ejemplo, Faecalibacterium prausnitzii) se correlaciona con una menor capacidad para inhibir la vía NF-κB, una ruta de señalización clave en la inflamación.
Como resultado, la disbiosis promueve la translocación de productos microbianos (como lipopolisacáridos, LPS) a través del epitelio dañado, activando receptores de reconocimiento de patrones (PRR), como los TLR4 (Toll-like receptor 4) en células epiteliales y macrófagos. Esto amplifica la cascada inflamatoria local.
El desequilibrio en la composición microbiana —conocido como disbiosis— no solo contribuye al desarrollo de la EII, sino que también perpetúa la inflamación crónica característica de estas enfermedades. Estudios recientes destacan que los tratamientos convencionales, enfocados en modular citocinas proinflamatorias, no siempre logran restaurar el equilibrio microbiano ni inducen remisión sostenida.
Ante este escenario, se exploran terapias innovadoras que actúan directamente sobre el microbioma, con el objetivo de promover un estado de eubiosis. Entre las estrategias más prometedoras se encuentran las siguientes:
- Trasplante de microbiota fecal (FMT): Procedimiento que busca restaurar la diversidad microbiana mediante la transferencia de heces de donantes sanos a pacientes con EII. Aunque los resultados son variables, metanálisis recientes sugieren beneficios significativos en subgrupos de pacientes, especialmente en aquellos con colitis ulcerosa refractaria.
- Terapias basadas en probióticos y prebióticos: Cepas específicas de bacterias beneficiosas, como Faecalibacterium prausnitzii y Bifidobacterium, han demostrado capacidad para modular la respuesta inmunitaria y reducir la inflamación intestinal. La ingeniería de probióticos, que combina cepas modificadas genéticamente, busca potenciar su efecto antiinflamatorio y mejorar la adherencia a la mucosa intestinal.
- Nanopartículas y sistemas de encapsulación: Estas tecnologías permiten la liberación dirigida de compuestos bioactivos o microbios beneficiosos en el colon, optimizando su acción local y minimizando efectos sistémicos.
- Terapia con bacteriófagos: Virus que infectan bacterias patógenas de manera selectiva, ofreciendo una alternativa a los antibióticos para reducir poblaciones microbianas asociadas a la inflamación.
- Células madre mesenquimales (MSCs): Su capacidad inmunomoduladora y trófica sobre el epitelio intestinal las posiciona como una herramienta adyuvante en la reparación de la barrera mucosa y la regulación de la respuesta inflamatoria.
- Proteínas y péptidos derivados de la microbiota: Moléculas como la flagelina o metabolitos como el butirato —producido por bacterias comensales— se investigan por su potencial para fortalecer la integridad epitelial y reducir la permeabilidad intestinal aumentada en EII.
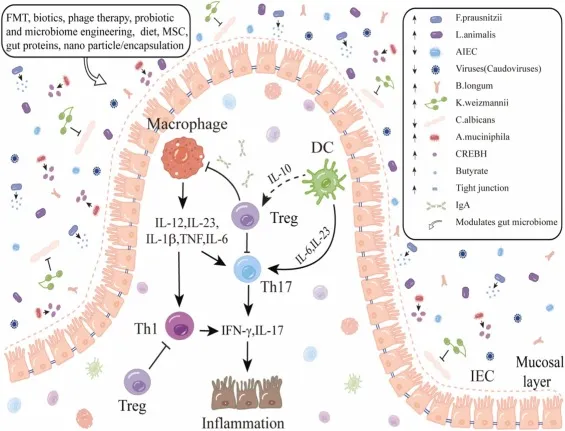
El manejo del microbioma intestinal en la EII. Los métodos emergentes como el FMT, los bióticos, la dieta, la ingeniería del microbioma, la terapia con fagos, la encapsulación de nanopartículas, las proteínas intestinales y las MSC pueden regular el desequilibrio del microbioma intestinal, promoviendo un equilibrio saludable al aumentar los microorganismos beneficiosos, reducir la inflamación y mejorar la integridad de la barrera intestinal. La estimulación de las CD por un microbioma intestinal sano libera IL10 y Tregs para bloquear otras células T y macrófagos cercanos, restaurando el entorno de disbiosis a la eubiosis. DC, células dendríticas; IEC, célula epitelial intestinal; IFN, interferón; IgA, inmunoglobulina A; IL-interleucina; Th, células T auxiliares; Treg, células T reguladoras.
La caracterización del perfil microbiano de cada paciente podría permitir estrategias diagnósticas y terapéuticas personalizadas. Por ejemplo, la disminución de la diversidad bacteriana y la sobreabundancia de especies proinflamatorias (como Escherichia coli adherente-invasiva) se asocian con un peor pronóstico y mayor riesgo de recaídas.
En este sentido, el análisis metagenómico de muestras fecales o de biopsias intestinales podría integrarse en algoritmos clínicos para predecir la respuesta a fármacos biológicos (anti-TNF, anti-integrinas); identificar pacientes con alto riesgo de complicaciones, como estenosis o cáncer colorrectal asociado a EII; monitorear la eficacia de intervenciones dietéticas o farmacológicas.
A pesar de los avances, persisten desafíos, como la estandarización de los protocolos de FMT, la selección de cepas probióticas óptimas y la comprensión de los mecanismos exactos mediante los cuales la microbiota interactúa con el sistema inmunitario del huésped. Además, la heterogeneidad de la EII —tanto en su presentación clínica como en su microbioma asociado— exige enfoques terapéuticos adaptativos.