La hematopoyesis clonal de potencial indeterminado (CHIP) es un fenómeno caracterizado por la expansión clonal de células hematopoyéticas que portan mutaciones somáticas asociadas a leucemias, como DNMT3A, TET2 y ASXL1. Aunque inicialmente se consideraba un hallazgo incidental en personas mayores, estudios recientes han demostrado que CHIP está relacionado con un mayor riesgo de desarrollar neoplasias hematológicas y enfermedades cardiovasculares.
En el contexto del cáncer, la hematopoyesis ineficaz asociada a CHIP puede ser impulsada por factores como la quimioterapia y la radioterapia, que generan estrés genotóxico y seleccionan clones mutados. Este proceso no solo afecta la producción normal de células sanguíneas, sino que también crea un microambiente inflamatorio que puede favorecer la progresión tumoral.
Por un lado, las células clonales pueden contribuir a un estado proinflamatorio mediante la liberación de citocinas y quimiocinas, lo que promueve la angiogénesis y la invasión tumoral. Por otro lado, las mutaciones en genes como TP53, que son comunes en CHIP, están asociadas con una mayor resistencia a la apoptosis y una mayor inestabilidad genómica, características que pueden acelerar la transformación maligna.
Además, la interacción entre las células clonales y el microambiente tumoral puede facilitar la evasión inmunitaria, permitiendo que el cáncer progrese de manera más agresiva. Por lo tanto, CHIP no solo es un marcador de riesgo, sino también un actor activo en la dinámica del cáncer.
La identificación de CHIP en cáncer de próstata y ovario ha avanzado significativamente gracias a estudios genómicos y técnicas de secuenciación de nueva generación. En el cáncer de próstata, se ha observado que mutaciones asociadas a CHIP, como las de los genes DNMT3A y TET2, pueden estar presentes en pacientes con enfermedad avanzada, lo que sugiere un posible vínculo con la progresión tumoral.
En el cáncer de ovario, la detección de CHIP ha revelado una interacción compleja entre las células clonales y el microambiente tumoral, destacando su papel en la inflamación crónica y la resistencia a terapias. Estas investigaciones no solo mejoran nuestra comprensión de la biología del cáncer, sino que también abren nuevas oportunidades para el desarrollo de biomarcadores y estrategias terapéuticas personalizadas.
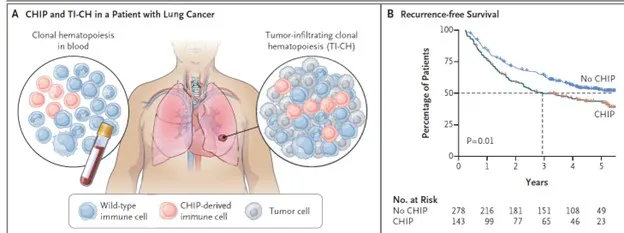
La hematopoyesis clonal infiltrante tumoral (TI-CH) es un fenómeno relacionado con la expansión de células hematopoyéticas mutadas que se infiltran en tumores sólidos, especialmente en el cáncer de pulmón no microcítico (NSCLC). Un estudio reveló que TI-CH está presente en el 26 % de los pacientes con hematopoyesis clonal de potencial indeterminado y se asocia con un mayor riesgo de recurrencia y mortalidad en diversos tipos de cáncer.
Las mutaciones en el gen TET2 son las principales responsables de TI-CH, ya que remodelan el microambiente tumoral al promover la infiltración de células mieloides y acelerar el crecimiento de organoides tumorales. Estos hallazgos subrayan el impacto de la hematopoyesis clonal relacionada con el envejecimiento en la evolución del cáncer y su potencial como biomarcador clínico.
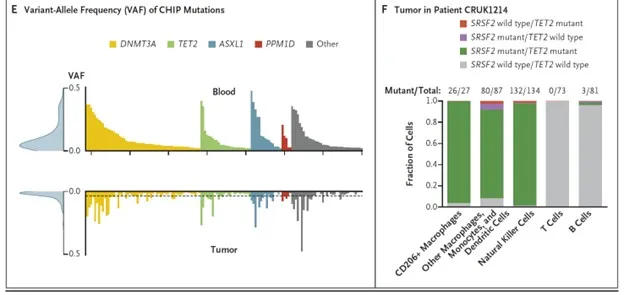
En el caso del NSCLC, aproximadamente el 40 % de los pacientes con CHIP presentan TI-CH, lo que incrementa significativamente el riesgo de muerte o recurrencia. Los modelos preclínicos muestran que las células mieloides mutadas por TET2 migran hacia los tumores y se acumulan como macrófagos en el microambiente tumoral, favoreciendo la progresión del cáncer.
Además, los estudios en organoides humanos confirman que las células mieloides mutadas por TET2 aumentan la capacidad clonogénica y el crecimiento de las células tumorales. Estos resultados destacan la importancia de TI-CH en la biología del cáncer y abren nuevas vías para la investigación y el desarrollo de estrategias terapéuticas dirigidas.
La identificación de CHIP y su impacto en la biología del cáncer abre nuevas oportunidades para el desarrollo de biomarcadores y estrategias terapéuticas personalizadas, subrayando la importancia de este fenómeno en la investigación oncológica actual.