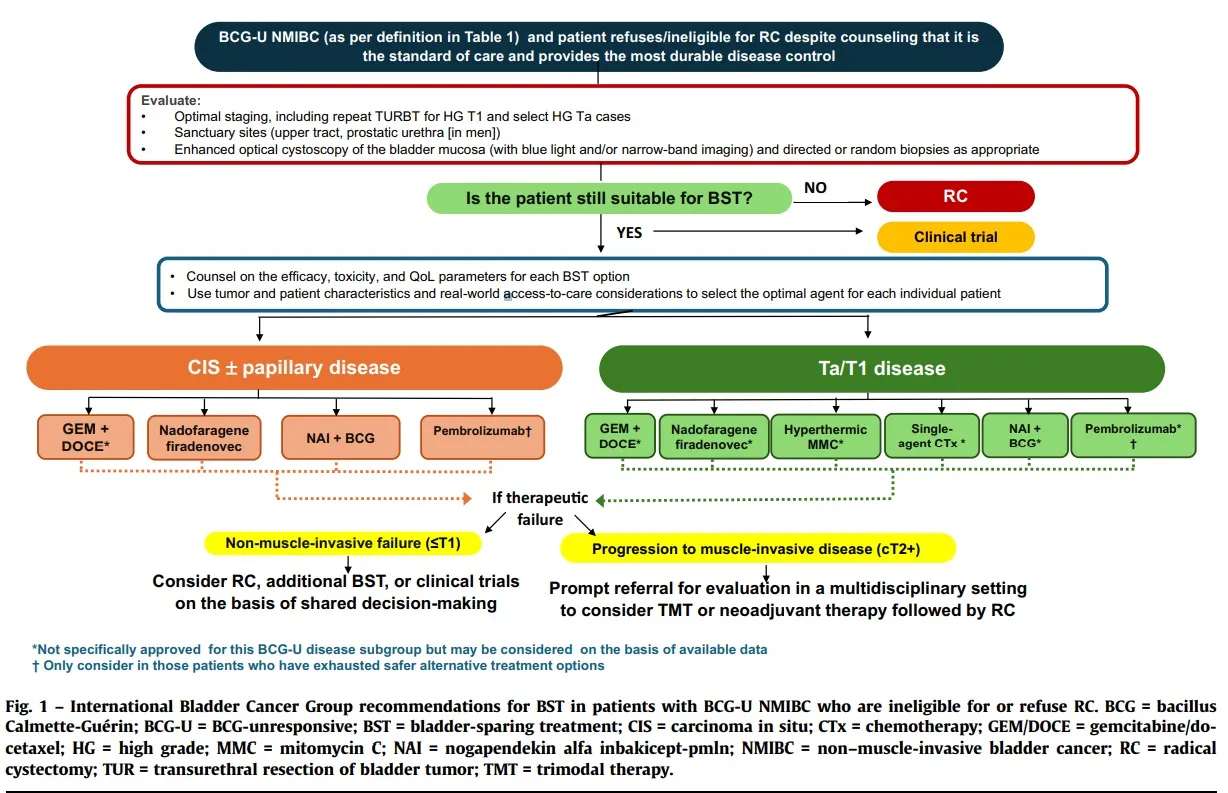
Actualmente, no existe un único agente óptimo para pacientes con enfermedad BCG-U que buscan evitar la cistectomía radical (CR). La selección de BST debe ser personalizada, teniendo en cuenta las características y preferencias individuales del paciente, los atributos del tumor y los datos de eficacia/toxicidad de los agentes disponibles.
Para pacientes con carcinoma in situ (CIS) con BCG-U, se recomienda gemcitabina/docetaxel (GEM/DOCE), y ofrecer pembrolizumab después de agotar otras opciones. Para pacientes con tumores papilares con BCG-U, se recomiendan GEM/DOCE, NFF, NAI + BCG, quimioterapia de agente único, mitomicina C hipertérmica y pembrolizumab.
| Recomendaciones |
El Grupo Internacional de Cáncer de Vejiga proporciona recomendaciones de tratamiento consensuadas para el cáncer de vejiga no músculo-invasivo, que no responde al bacilo de Calmette-Guérin (BCG), con la incorporación de nuevos hallazgos de ensayos clínicos fundamentales. Para los pacientes que desean evitar la cistectomía radical, la terapia de conservación de la vejiga debe personalizarse de acuerdo con las preferencias del paciente.
El campo de las opciones de tratamiento para el cáncer de vejiga no músculo invasivo que no responde a BCG se ha expandido rápidamente, a raíz de un aumento de ensayos de registro de un solo brazo.
Hasta la fecha, no se ha realizado ningún RCT en el entorno de BCG-U, debido a la falta de un BST efectivo para usar como comparador y la renuencia de los pacientes a ser asignados aleatoriamente a CR.
La eficacia relativa de los agentes en investigación solo puede compararse de manera imprecisa entre ensayos; estas comparaciones se confunden aún más por las diferentes tasas de eficacia observadas para varios subgrupos de enfermedades (CIS, papilar o CIS + papilar). Por lo tanto, el IBCG acordó que el tratamiento óptimo debe personalizarse, de acuerdo con las características tumorales específicas de cada paciente (grado, estadio) y la composición fisiológica (por ejemplo, capacidad/incapacidad para mantener un agente intravesical) y consideraciones del mundo real (por ejemplo, acceso a instalaciones de atención médica, dosis de medicamentos y costos).
|
En ausencia de datos comparativos directos o biomarcadores predictivos, y con base en una revisión de la evidencia disponible presentada aquí, y las recomendaciones de las pautas actuales para BST en NMIBC BCG-U, el IBCG recomienda lo siguiente: 1. Nadofaragene firadenovec (aprobado), pembrolizumab (aprobado), NAI (N-803) + BCG (aprobado) y GEM/ DOCE (fuera de etiqueta) para pacientes con CIS BCG-U. 2. GEM/DOCE, quimioterapia de agente único, MMC hipertérmica, NAI (N-803) + BCG, nadofaragene, firadenovec y pembrolizumab (todos fuera de etiqueta) para pacientes con tumores papilares solo con BCG-U. Hay que asesorar a los pacientes con BCG-U sobre las terapias aprobadas para este entorno e informarles que la RC es el estándar de referencia actual. Para aquellos que eligen no someterse a RC, el asesoramiento sobre los agentes aprobados/fuera de etiqueta disponibles debe incluir un análisis de la eficacia, la toxicidad y los parámetros de calidad de vida. |
Para los pacientes con tumores CIS ± Ta/T1, la tasa de CR fue del 44 % a los 3 meses, del 38 % a los 6 meses y del 25 % a los 12 meses. Esto representa una mejora modesta sobre el parámetro.
La RC es el estándar actual para el NMIBC con BCG-U. Si la RC se realiza antes de la progresión a MIBC, la tasa de CSS es > 90 %. Sin embargo, para pacientes seleccionados adecuadamente (es decir, sin invasión linfovascular [LVI] o subtipo histológico variante, y en pacientes T1 estadificados adecuadamente), la BST puede ser una alternativa segura a la RC para el NMIBC con BCG-U.
Es importante destacar que ningún paciente con LVI o subtipo histológico variante recibió BST inicial en esta cohorte. En el análisis multivariable, el tabaquismo continuo fue la única variable predictiva de recurrencia de alto grado (HR 4,44; p = 0,011).
Las tasas de >pT2 y pN+ fueron similares para los grupos que recibieron RC inicial (23–50 % y 8–16 %) y RC de rescate después de BST (8–33 % y 3–12 %).
De acuerdo con la carta abierta a la FDA de Kamat et al., el IBCG acordó que los pacientes con enfermedad BCG-U que experimentan un fracaso terapéutico no invasivo muscular de BST (T1) y que se niegan o no son elegibles para la RC pueden ser considerados para ensayos clínicos adicionales de BCG-U y BST sobre la base de una toma de decisiones compartida.