| Introdução |
O supercrescimento bacteriano do intestino delgado (SIBO) é uma condição caracterizada por um excesso de bactérias nesse órgão, ocasionando um desequilíbrio na microbiota intestinal. Essa disbiose não só aumenta a densidade bacteriana, mas também promove a colonização por microrganismos típicos do intestino grosso, alterando significativamente a funcionalidade digestiva.
No Brasil, a relevância do SIBO na gastroenterologia está crescendo, ainda que haja uma grande lacuna na prática clínica e na pesquisa, com escassez de dados epidemiológicos sobre a doença na população. A ausência de diretrizes padronizadas pode gerar heterogeneidade nos protocolos de tratamento e disparidades nos cuidados entre diferentes instituições e profissionais de saúde. Por isso, em 2025, a Federação Brasileira de Gastroenterologia publicou um posicionamento oficial da doença no país. Leia abaixo um resumo do documento.
| Fisiopatologia e fatores de risco |
A fisiopatologia do SIBO decorre do desequilíbrio entre a microbiota intestinal e os mecanismos de defesa do hospedeiro, levando à fermentação de carboidratos não digeridos, produção de hidrogênio, metano e metabólitos que podem lesar a mucosa.
Os principais fatores de risco incluem distúrbios da motilidade gastrointestinal (redução do complexo motor migratório), diminuição da secreção gástrica (comum em usuários de IBPs), alterações estruturais (estenoses e cirurgias bariátricas) e disfunção imunológica (como a deficiência da IgA secretora). Além disso, doenças como diabetes, esclerose sistêmica, doença de Crohn e uso crônico de opioides predispõem ao SIBO, que frequentemente coexiste com síndrome do intestino irritável (SII), doença inflamatória intestina (DII) e doença celíaca, complicando o diagnóstico e manejo clínico.
| Apresentação clínica |
As manifestações clínicas são inespecíficas e incluem distensão, flatulência, dor abdominal, diarreia e constipação até manifestações mais graves, como perda de peso, deficiências nutricionais, esteatorreia, anemia e neuropatia.
Além disso, bactérias envolvidas no metabolismo de ácidos biliares podem levar a má absorção de gorduras e vitaminas lipossolúveis, enquanto microrganismos produtores de ácido fólico e vitamina K podem elevar seus níveis no sangue. Estudos sugeriram uma possível relação entre SIBO e névoa cerebral, ansiedade e depressão, embora essa conexão ainda não seja totalmente compreendida.
O diagnóstico baseado apenas nos sintomas é desafiador, sendo essencial suspeitar do SIBO em populações de risco, como pacientes com distúrbios da motilidade, alterações gastrointestinais estruturais, imunodeficiências ou disfunções na barreira intestinal.
| Epidemiologia |
O SIBO apresenta uma prevalência global variada, entre 2,5% e 22%, sendo mais frequente em idosos e indivíduos com comorbidades. No Brasil, embora os dados sejam limitados, estudos indicaram prevalências significativas, como 30% em pacientes com doença de Crohn e taxas de 56% e 64% em indivíduos com sintomas gastrointestinais, conforme testes respiratórios de hidrogênio e metano, respectivamente. Esses resultados destacaram a necessidade de uma abordagem diagnóstica e terapêutica adaptada à realidade brasileira, considerando fatores demográficos e clínicos dos pacientes.
| Desafios nos estudos epidemiológicos e diagnóstico |
A pesquisa epidemiológica sobre SIBO enfrenta desafios devido à variação nos critérios diagnósticos e métodos de testagem, impactando a precisão dos dados de prevalência.
A cultura do aspirado do intestino delgado é o padrão-ouro para diagnóstico, mas sua invasividade, custo e disponibilidade limitada tornam os testes respiratórios mais comuns na prática clínica.
A falta de padronização nos testes compromete a interpretação dos resultados, impactando o diagnóstico, epidemiologia e tratamento. Como ainda não há um consenso sólido sobre o método ideal, esforços continuam para unificar protocolos, garantindo maior precisão e acessibilidade, especialmente no Brasil, onde a pesquisa ainda está em desenvolvimento.
Os critérios diagnósticos para a cultura do aspirado intestinal seguem o consenso norte-americano: ≥10⁵ UFC/mL para aspirado jejunal e ≥10³ UFC/mL para aspirado duodenal. Apesar da alta precisão, a técnica pode gerar falsos positivos e negativos. Além disso, apenas 40% da microbiota intestinal pode ser identificada por cultura convencional, e algumas bactérias produtoras de hidrogênio não são cultiváveis.
| Testes respiratórios |
Os testes respiratórios são a abordagem inicial para o diagnóstico de SIBO, por serem métodos não invasivos, práticos e acessíveis. Esses avaliam os gases produzidos pela fermentação bacteriana no intestino delgado, principalmente hidrogênio (H₂) e metano (CH₄), além do potencial futuro uso da medição de gás sulfídrico (H₂S). Cerca de 30% da microbiota adulta são produtores de metano, o que pode ocasionar falsos negativos se apenas H₂ for medido; a inclusão de CH₄ melhora a acurácia diagnóstica em 20–30% dos pacientes.
Após a ingestão de uma dose padronizada de glicose (75 g) ou lactulose (10 g) diluída em água, o paciente, em jejum de pelo menos 8 horas, realiza coletas de ar a cada 15–20 minutos durante 90–120 minutos; aumentos de 20 ppm de H₂ ou 10 ppm de CH₄ em relação à linha de base indicam SIBO.
A preparação adequada para o teste é crucial para minimizar interferências. No dia anterior, deve-se evitar alimentos ricos em carboidratos fermentáveis de difícil absorção e fibras, suspender determinados medicamentos (como procinéticos, laxantes, opioides e antibióticos) conforme as diretrizes, e evitar fatores como fumar ou mascar chicletes que possam alterar a ventilação.
Quanto a diferença dos substratos, enquanto a glicose é rapidamente absorvida e específica para o intestino delgado proximal, a lactulose não é absorvível e permite avaliar todo o intestino.
Apesar da ausência de um protocolo universal e das variações nas diretrizes internacionais, a padronização segundo o Consenso Norte-Americano tem sido adotada amplamente, contribuindo para um diagnóstico mais preciso e consistente de SIBO na prática clínica.
| Tratamento |
O tratamento inicial do SIBO envolve a identificação e correção da causa subjacente, reposição de déficits vitamínicos (lipossolúveis e B12) e avaliação nutricional. Atualmente, os antibióticos são a base do tratamento, modulando a microbiota e reduzindo sintomas gastrointestinais.
Contudo, o uso indiscriminado de antibióticos levanta preocupações sobre resistência bacteriana, efeitos adversos e risco de infecção por Clostridioides difficile. A diretriz do American College of Gastroenterology (2020) recomendou que o diagnóstico seja confirmado antes do tratamento empírico, seguindo protocolos padronizados, como descrito na tabela 1.
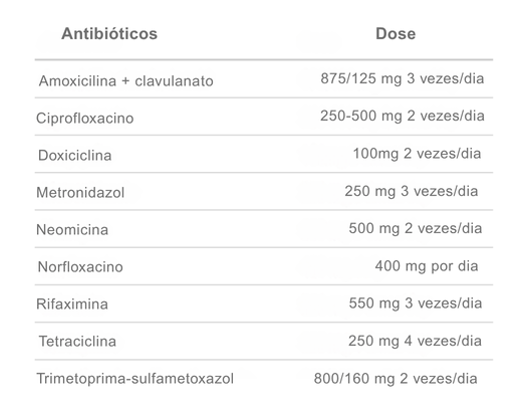
Tabela 1: Antibióticos para o tratamento do supercrescimento bacteriano do intestino delgado (10 a 14 dias). Tabela adaptada de Federação Brasileira de Gastroenterologia (2025).
Diversos antibióticos sistêmicos mostraram eficácia na redução de sintomas de SIBO e síndrome do intestino irritável. Estudos indicaram que o ciprofloxacino pode suprimir o supercrescimento bacteriano em 83% a 100% dos casos, melhorando sintomas gastrointestinais e sendo mais tolerado que o metronidazol. O norfloxacino reduziu a frequência evacuatória em 45% e o amoxicilina-clavulanato em 29%, com efeitos terapêuticos por cerca de seis dias.
A rifaximina, antibiótico não absorvível, é considerada primeira linha para SIBO. Um estudo retrospectivo mostrou resposta positiva em 47,4% dos pacientes com teste respiratório positivo para hidrogênio e 80% nos positivos para hidrogênio e metano. Os resultados demonstraram que além de reduzir a inflamação, a rifaximina restaurou a permeabilidade intestinal e modulou a microbiota, reforçando seu papel como tratamento primário.
| Considerações especiais |
Em áreas com acesso limitado a testes diagnósticos para SIBO, uma estratégia viável é iniciar um tratamento terapêutico com antibióticos baseado na alta suspeita clínica, mesmo sem confirmação laboratorial. Essa abordagem permite que os pacientes recebam cuidados de forma oportuna, mas requer monitoramento rigoroso da resposta ao tratamento para evitar o uso desnecessário ou prolongado de antibióticos. Quando a rifaximina não está disponível, os antibióticos sistêmicos, como ciprofloxacino ou metronidazol, são geralmente indicados, devendo a escolha ser individualizada de acordo com contraindicações e com a disponibilidade dos medicamentos localmente.
| Recorrência do SIBO |
A reincidência do SIBO é comum após o tratamento antibiótico, devido a fatores como motilidade intestinal prejudicada, anormalidades anatômicas e uso crônico de inibidores de bomba de prótons (IBPs), que não são corrigidos apenas com antibióticos. O retorno dos sintomas gastrointestinais reforça a necessidade de um tratamento personalizado e eliminação de fatores predisponentes.
Quando há recorrência, recomenda-se reavaliação com teste respiratório e, se positivo, considerar um novo curso de antibióticos, embora ainda faltem diretrizes definitivas. Estudos indicaram que o uso cíclico de antibióticos não absorvíveis ou baixas doses noturnas de tegaserod ou eritromicina podem ajudar a prevenir a recorrência.
| Probióticos |
O uso de probióticos no tratamento do SIBO é controverso devido tanto à variabilidade nos estudos quanto às suas formulações, duração do tratamento e métodos diagnósticos. Uma meta-análise com 18 estudos indicou que os probióticos aumentaram a taxa de erradicação da doença, sem impacto na frequência evacuatória ou prevenção da condição.
Embora a associação de probióticos, prebióticos, glutamina e suplementos fitoterápicos com antibióticos e dieta de baixo FODMAP não altere significativamente a normalização dos gases, pode melhorar sintomas gastrointestinais, especialmente na SIBO metanogênica. Um estudo-piloto com pacientes com SIBO e esclerose sistêmica demonstrou que a combinação de metronidazol e Saccharomyces boulardii foi mais eficaz na erradicação da SIBO (55%) e na redução dos sintomas do que o uso isolado de cada um. Entretanto, a variabilidade das cepas probióticas utilizadas dificulta conclusões definitivas.
Embora os probióticos possam ter benefícios, as evidências ainda são limitadas e inconsistentes, não sustentando seu uso rotineiro na SIBO. Estudos adicionais são necessários para esclarecer sua eficácia e impacto clínico.
| Mudanças alimentares |
A alimentação é um fator crucial para a composição e estabilidade da microbiota intestinal. Dietas ricas em fibras, vegetais e prebióticos, com baixo teor de gordura e colina favorecem uma microbiota saudável. Em pacientes com SIBO, que podem apresentar diarreia ou constipação e sofrer recorrências, uma nutrição adequada é essencial, mas nem sempre elimina os sintomas. Embora o regime low-FODMAP—que restringe carboidratos fermentáveis—possa aliviar inchaço e gases, essa dieta deve ser realizada por no máximo seis semanas, pois o seu uso prolongado pode comprometer a diversidade microbiana. Dietas eliminatórias, como as de glúten ou lactose, devem ser empregadas com cautela, já que hábitos alimentares inadequados podem favorecer o retorno da SIBO.
| Supercrescimento de metanogênicos intestinais (IMO) |
Esse termo é novo e se refere a proliferação excessiva de metanogênicos tanto no intestino delgado quanto no cólon. Esses microrganismos do domínio Archaea (Euryarchaeota), que produzem CH₄ a partir de H₂ e CO₂, têm o Methanobrevibacter smithii como a espécie predominante. Estudos associaram níveis elevados de metano a distúrbios de motilidade intestinal, constipação funcional e SII com predominância de constipação, embora os mecanismos exatos ainda não estejam totalmente esclarecidos. O diagnóstico é realizado via teste respiratório, considerando-se positivo um aumento de pelo menos 10 ppm de metano, já que a cultura direta do intestino delgado é invasiva e cara. O tratamento de primeira linha é a combinação de neomicina (500 mg duas vezes ao dia) e rifaximina (550 mg três vezes ao dia) por 14 dias,.
| Conclusão |
A revisão da Federação Brasileira de Gastroenterologia abordou a compreensão atual do SIBO, enfatizando os desafios no diagnóstico e as estratégias terapêuticas no contexto brasileiro. Apesar das limitações diagnósticas, testes de respiração e aspiração jejunal apresentam-se como alternativas viáveis. A rifaximina continua sendo o tratamento de primeira linha por sua ação local e eficácia; quando ausente, antibióticos sistêmicos como ciprofloxacino e metronidazol são opções adequadas. Destacou-se também a necessidade de superar as barreiras de acesso aos diagnósticos, sobretudo em áreas carentes, e de abordar os fatores de risco para recorrência. Avanços em pesquisas e protocolos padronizados são essenciais para otimizar o manejo do SIBO no Brasil e aprimorar a qualidade do cuidado ao paciente.