En oncología, los criterios de evaluación de respuesta al tratamiento son herramientas fundamentales para estandarizar la manera en que se mide la efectividad de una terapia. Los criterios RECIST (Response Evaluation Criteria in Solid Tumors), en sus versiones 1.0 y actualizada 1.1, son los más utilizados y se basan en mediciones del tamaño tumoral mediante imágenes.
Estos criterios clasifican la respuesta del tumor en categorías: respuesta completa, parcial, enfermedad estable o progresión, y son aplicables a la mayoría de los tumores sólidos.
Otros sistemas más específicos, como los criterios Choi, fueron desarrollados para tumores con respuestas no necesariamente reflejadas en cambios de tamaño, como los tumores del estroma gastrointestinal tratados con inhibidores de tirosina quinasa, considerando también cambios en la densidad del tumor.
Los criterios PERCIST, en cambio, evalúan la respuesta basada en la actividad metabólica observada en estudios PET con FDG, lo cual es útil especialmente en contextos donde la actividad funcional del tumor es más representativa que su volumen.
Los tratamientos con inmunoterapia han planteado nuevos desafíos en la evaluación de la respuesta tumoral, ya que pueden generar patrones atípicos, como la pseudoprogresión, donde el tumor parece aumentar de tamaño antes de reducirse debido a la infiltración inmune. Para abordar esta situación, se desarrollaron los criterios iRECIST (immune RECIST), una adaptación de los RECIST 1.1, específicamente diseñada para estudios y tratamientos con inmunoterapia.
iRECIST introduce nuevas categorías, como iUPD (progresión inmune no confirmada) e iCPD (progresión inmune confirmada), permitiendo continuar el tratamiento incluso ante una aparente progresión inicial, siempre que el paciente se mantenga clínicamente estable. Esto ayuda a evitar la interrupción prematura de terapias que podrían ser efectivas a largo plazo y proporciona una guía más precisa en el manejo clínico y la evaluación en ensayos clínicos inmuno-oncológicos.
La evaluación precisa de tumores sólidos es esencial para el manejo clínico y la investigación en oncología. Aunque el estándar actual, RECIST 1.1, es ampliamente utilizado, presenta limitaciones significativas, como la variabilidad interobservador (hasta un 20 %) y la subestimación de la carga tumoral total, debido a su dependencia de mediciones lineales unidimensionales. Además, los métodos de inteligencia artificial (IA) existentes enfrentan desafíos debido a la heterogeneidad tumoral, la falta de anotaciones suficientes y la ausencia de interacción con el usuario.
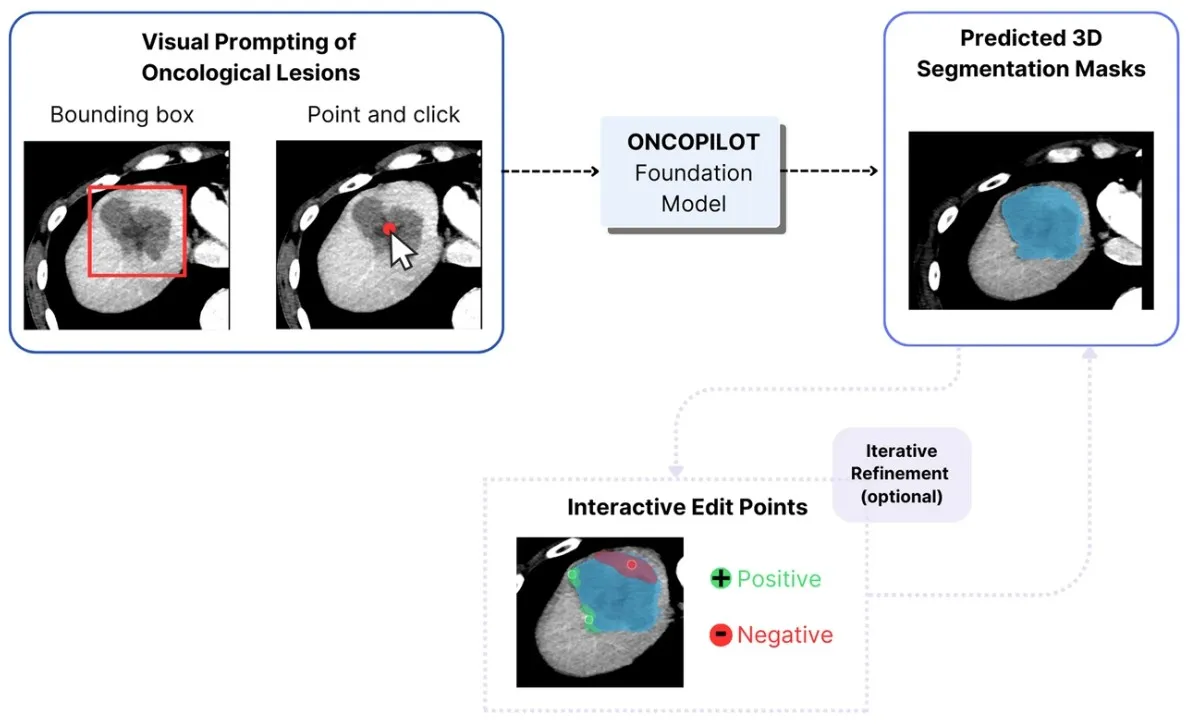
ONCOPILOT es un modelo fundacional basado en TC, diseñado para segmentar tumores en 3D y mejorar las evaluaciones RECIST 1.1, mediante la integración activa del radiólogo. Entrenado en más de 8000 TC, el modelo utiliza indicaciones visuales intuitivas (puntos, cuadros delimitadores y ediciones interactivas) para generar segmentaciones precisas.
ONCOPILOT supera o iguala a los métodos actuales en precisión, reduce la variabilidad interobservador y agiliza el flujo de trabajo, facilitando el acceso a biomarcadores avanzados como el análisis volumétrico.
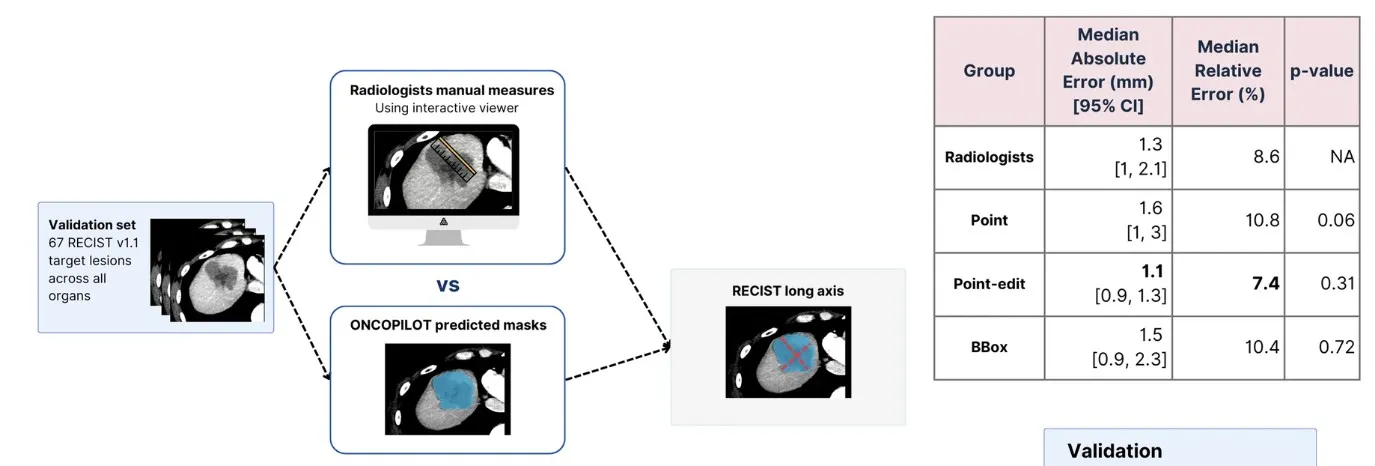
ONCOPILOT ha demostrado un notable avance en la segmentación tumoral, obteniendo un puntaje DICE medio de 0,79 en modo edición, superando al modelo nnUnet, que alcanzó un DICE de 0,70.
Aunque su rendimiento fue inferior en tumores pequeños (<15 mm) o con baja esfericidad (DICE: 0,66), la incorporación de edición interactiva eliminó estas diferencias, logrando resultados significativamente más precisos. Este enfoque interactivo permite al radiólogo ajustar las segmentaciones, optimizando la evaluación morfológica y reduciendo errores comunes en modelos automáticos.
En términos de integración clínica, ONCOPILOT ha mostrado beneficios tangibles, disminuyendo la variabilidad interobservador de 2,4 mm en mediciones manuales a 1,7 mm en un entorno asistido. Además, ha agilizado el tiempo de medición por lesión de 25,3 segundos a 17,2 segundos, lo que representa una mejora notable en los flujos de trabajo.
Sin embargo, aún enfrenta desafíos en la precisión de tumores pequeños, especialmente aquellos de menos de 10 mm, lo que destaca como un área crítica para futuras versiones. Por último, se requieren estudios de validación clínica para comprender mejor su impacto en la estratificación de pacientes y en la toma de decisiones terapéuticas, consolidando así su potencial en entornos médicos avanzados.