| Introducción |
El cáncer de próstata (CP) es el segundo cáncer más común en hombres de todo el mundo. Su prevalencia es mayor en el norte de Europa, Australia, Caribe y América del Norte, y predomina en hombres mayores (edad media 67 años).
En autopsias, el 59 % de los hombres >79 años tiene signos histológicos de CP.
El CP es altamente hereditario y >50 % del riesgo de CP se debería a factores genéticos, habiéndose identificado 451 variantes genómicas asociadas al riesgo de CP. El 11,8 % de pacientes con CP metastásico (CPM) tiene alterado un gen reparador del ADN, como el BRCA2.
Se recomiendan pruebas genéticas germinales basadas en paneles para todos los pacientes con CP localizado o CPM de alto riesgo, independientemente de sus antecedentes familiares, para informar las pruebas de cascada genética para familiares y las terapias de precisión dirigidas a las alteraciones genéticas.
| Cribado |
El cribado del CP mediante tacto rectal es de baja precisión diagnóstica y no se recomienda. Se puede hacer midiendo la concentración sérica del PSA, el que es específico de la próstata, pero también aumenta en ausencia de malignidad. Los inhibidores de la 5α-reductasa, como la finasterida, pueden afectar el nivel del PSA, el que también aumenta con la edad, debido al mayor volumen prostático, lo que hay que considerar a la hora de su interpretación.
Luego de comprobar que el cribado con PSA no es tan preciso y que los beneficios sobre la evolución y mortalidad no son tantos, respecto de la prueba del PSA, las guías fomentan la toma de decisiones compartida.
En EE. UU se recomienda:
- La toma de decisiones compartida y el cribado del PSA c/2-4 años para hombres de 55-69 años.
- NO realizar el cribado del PSA en >70 años, pero sí en poblaciones de alto riesgo, como hombres de raza negra, o con alteraciones de la línea germinal en genes implicados en la reparación del daño del ADN (en particular, BRCA1 o BRCA2) o, aquellos con antecedentes familiares de CP.
- Si se opta por la prueba del PSA, la basal debe hacerse entre los 40 y los 45 años.
| Evaluación diagnóstica |
En pacientes con PSA moderado (4-10 ng/ml), a los pocos meses debe volver a hacerse una prueba confirmatoria. Si en dicha prueba el PSA está elevado se debe hacer la derivación al urólogo para una biopsia de próstata, transrectal o transperineal con guía ecográfica.
Se recomienda tomar 10-12 biopsias nucleares, simétricamente, de todas las áreas prostáticas. La evaluación histopatológica se basa en el sistema Gleason. Los grados van de 1 (se asemeja al tejido prostático normal) a 5 (láminas de células con pocas o ninguna glándula reconocible).
La resonancia magnética (RM) previa a la biopsia puede detectar cáncer clínicamente significativo. Aún no ha quedado establecido el beneficio de la RM antes de la biopsia, y no hay consenso acerca de los pacientes candidatos.
| Estratificación del riesgo |
Para estratificar el riesgo se considera:
- Grado de aumento del PSA.
- Tamaño tumoral por tacto rectal.
- Puntaje y grado de Gleason.
La clasificación más usada es la de la NCCN (National Comprehensive Cancer Network). Los pacientes con enfermedad de riesgo intermedio o alto desfavorable deben someterse a una estadificación basada en una tomografía computarizada (TC) de tórax, abdomen y pelvis, y una gammagrafía ósea con radionúclidos.
El uso de la PET con PSA de membrana (PSMA) es de uso creciente. Las guías consideran apropiado cualquier abordaje (PET o TC y gammagrafía ósea). La PET con PSMA es más reciente y utiliza un radiotrazador que se une a la proteína PSMA en las células de origen prostático. Respecto de la TC y la gammagrafía, su sensibilidad y especificidad son superiores (56% u 93%, respectivamente).
| Tratamiento |
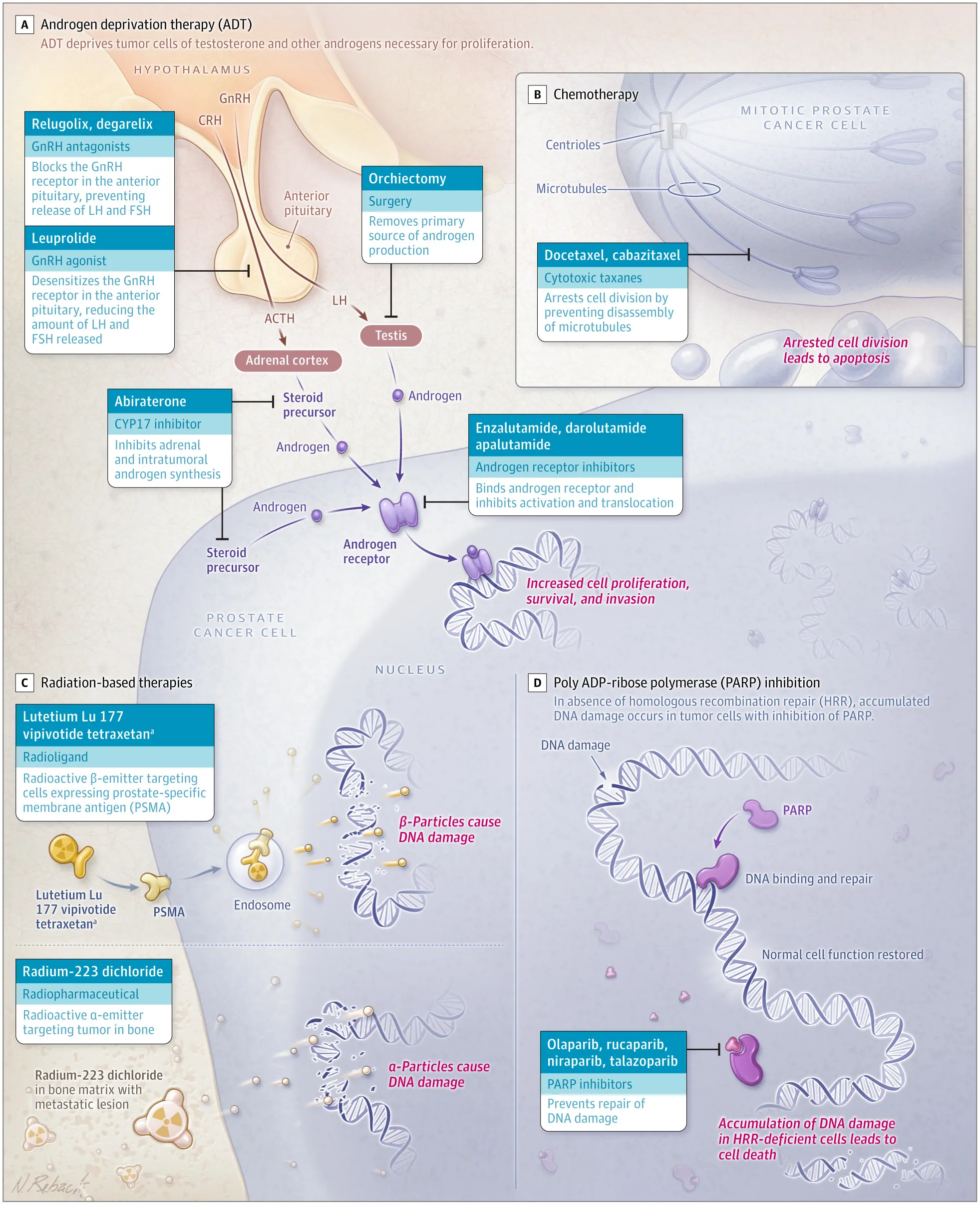
- Terapia de deprivación androgénica (TDA)
El crecimiento del adenocarcinoma de próstata es dependiente de andrógenos. La TDA puede ser quirúrgica (orquiectomía) o farmacológica (un agonista de la hormona liberadora de gonadotrofina [pleuprolida] o un antagonista [degarelix]) para alcanzar una testosterona sérica ≤50 ng/ml.
El beneficio de la TDA es mayor en pacientes con enfermedad localizada de alto riesgo sometidos a radioterapia (RT), o con metástasis en los ganglios linfáticos detectadas posprostatectomía, y como tratamiento paliativo para aquellos con enfermedad metastásica.
Tiene efectos negativos en la calidad de vida, como disfunción eréctil (>70 %), sofocos (60 %), ginecomastia (10 %), cambios en la composición corporal (aumento del 9 % de grasa corporal), osteopenia, osteoporosis y mayor incidencia de fracturas. Se recomienda descartar la osteoporosis y controlar cada 1-2 años. El riesgo de diabetes y enfermedades cardiovasculares también aumenta.
El CP progresivo a pesar de la TDA (CP resistente a la castración: CPRC) sigue siendo dependiente de la activación del receptor de andrógenos, por la posible producción intratumoral de andrógenos o cambios en el receptor. Para su tratamiento se han desarrollado terapias hormonales (inhibidores de la vía del receptor de andrógenos [ARPI, por sus siglas en inglés]), que incluyen inhibidores del receptor de andrógenos (enzalutamida, darolutamida, apalutamida) e inhibidores de la biosíntesis de andrógenos (abiraterona).
- Manejo de la enfermedad clínicamente localizada
Las tasas de supervivencia específicas a 5 años del CP localizado se acercan al 100 %. El tratamiento puede ser local, con intención curativa (RT o cirugía), vigilancia activa u observación. La elección se basa en estratificar el riesgo, la preferencia del paciente y la esperanza de vida.
La vigilancia activa cada vez es más utilizada, sobre todo en hombres con CP recién diagnosticado de bajo riesgo. Implica la combinación de pruebas seriadas de PSA, tacto rectal, biopsia de próstata y RM.
Para la enfermedad progresiva, las guías recomiendan tratamiento local definitivo con prostatectomía radical o RT, en caso de riesgo intermedio y esperanza de vida >10 años o para casos de mayor riesgo y esperanza de vida >5 años.
La decisión entre prostatectomía radical y RT se toma considerando los efectos adversos, las comorbilidades y la tolerancia al tratamiento, además de la opinión de un equipo multidisciplinario. La prostatectomía radical se asocia con riesgos quirúrgicos.
Las complicaciones que provocan muerte o fallo orgánico son <1 %. La prostatectomía radical se ha asociado con incontinencia urinaria de esfuerzo y disfunción eréctil. Sin embargo, la prostatectomía puede mejorar los síntomas del tracto urinario inferior y evita la TDA, que suele ser recomendada para pacientes con enfermedad de alto riesgo sometidos a RT.
En hombres con CP y ganglio linfático positivo en la prostatectomía se puede considerar la TDA adyuvante. La RT puede preferirse a la cirugía en pacientes mayores o con comorbilidades quirúrgicas, pero la RT se asocia con toxicidad intestinal (urgencia rectal, diarrea, hematoquecia, irritación u obstrucción genitourinarias).
Para el CP localizado se puede utilizar la RT de haz externo, con o sin implante de semillas radiactivas (braquiterapia). La braquiterapia sola puede usarse en casos de riesgo intermedio o como refuerzo de la RT externa en pacientes de alto riesgo. En pacientes de alto riesgo que optan por la RT se les debe ofrecer TDA concurrente.
- Manejo de la enfermedad localmente avanzada
La afectación ganglionar regional (enfermedad N1) también puede mejorar con el tratamiento local definitivo. El agregado del inhibidor de la biosíntesis de andrógenos abiraterona también puede usarse en pacientes con afectación ganglionar regional, que cumplan 2 de estos 3 criterios: nivel de PSA ≥40, estadio tumoral T3 o T4 o, grado 4 o 5 de Gleason y en pacientes bajo RT local.
- Vigilancia post TDA
El principal método de vigilancia tras la terapia local definitiva es la medición seriada del PSA. Se debe controlar cada 6-12 meses durante 5 años y luego anualmente (si no hay aumento respecto del nivel basal). Posprostatectomía, el PSA se debe controlar a las 6 semanas y debe permanecer indetectable.
Un PSA estable ≤0,2 ng/ml puede indicar retención de tejido prostático benigno, pero si es >0,2 ng/ml se considera CP recurrente. Para definir la recurrencia tras la RT debe constatarse un umbral de PSA más alto, o un PSA nadir >2 ng/ml, ya que puede quedar tejido prostático normal.
- Recurrencia bioquímica
Se trata de un nivel elevado de PSA como único indicador de enfermedad recurrente. Aparece en el 20-40 % de los pacientes sometidos a la terapia definitiva. En el caso de recurrencia bioquímica posprostatectomía radical está indicada la RT de rescate del lecho quirúrgico. En el CP localizado, recurrente y comprobado por biopsia, que fuera inicialmente tratado con RT, las opciones de rescate son la prostatectomía radical, la crioterapia y otros tipos de ablaciones.
El momento ideal para iniciar la terapia de reemplazo hormonal (TRH) en personas con recurrencia bioquímica ya sometidas a la TDA o que no son candidatas a la terapia local de rescate es incierto. El tratamiento combinado con enzalutamida y leuprolida mejoró la supervivencia libre de metástasis comparado con leuprolida sola.
Con imágenes PET con PSMA más sensibles, casi el 68 % de los pacientes que antes se habrían catalogado con recurrencia bioquímica presentan enfermedad metastásica, y su manejo óptimo es poco claro.
- Cáncer de próstata metastásico hormonosensible
Casi el 10 % de los pacientes con CP tienen metástasis y la tasa de supervivencia a los 5 años es del 37 %. El riesgo de metástasis se correlaciona con un grado de Gleason.
El tratamiento de primera línea del CPM es la TDA indefinidamente. La NCCN20 recomienda la prueba del PSA cada 3-6 meses y estudios por imagen. En el 60-80 % de los pacientes con CP, la TDA sola reduce 50 % el nivel del PSA, pero a los 12 a 24 meses se convierte en un CPRC. La NCCN20 recomienda usar la TDA con un ARPI con o sin quimioterapia con docetaxel. Los ARPI enzalutamida y apalutamida mejoraron la supervivencia global en pacientes con CPM de reciente diagnóstico sensible a la castración comparado con la TDA sola. Abiraterona, enzalutamida y apalutamida son fármacos apropiados para esta población.
La quimioterapia se basa en el volumen de la enfermedad, clasificada como de alto volumen (metástasis viscerales o ≥4 lesiones óseas y ≥1 lesión localizada más allá de los cuerpos vertebrales y la pelvis) y enfermedad de bajo volumen. El docetaxel mejoró la supervivencia global de pacientes con enfermedad de alto volumen, pero no con enfermedad de bajo volumen. Un estudio mostró mejor supervivencia global con TPA, docetaxel y abiraterona. Otro ensayo mostró mejor supervivencia con el inhibidor de la recaptación de plaquetas darolutamida combinado con docetaxel vs. docetaxel solo, en los subgrupos de alto y bajo volumen.
La terapia triple parece superior a la TAD más docetaxel. La TDA más un ARPI y la terapia triple son una opción adecuada para el CPM hormonosensible recién diagnosticado y el CPRC.
Aún con tratamiento, todos los pacientes con PCM desarrollan CPRC y su tratamiento depende de las terapias usadas previamente. Si se recibió TDA sola, se puede agregar docetaxel y ARPI. Los ARPI nzalutamida y abiraterona están aprobados para personas con o sin exposición previa al docetaxel. Si antes se usó un ARPI, se puede cambiar a otro ARPI de diferente clase (por ejemplo, de abiraterona a enzalutamida), probablemente con baja respuesta. Esta estrategia no está indicada en pacientes sintomáticos.