Agora existem evidências de que a miocardite e a miopericardite são complicações raras da vacina de mRNA contra a doença coronavírus 2019 (COVID-19), especialmente em jovens adultos e adolescentes do sexo masculino.
O artigo teve como objetivo fornecer mais detalhes sobre este fenômeno e seus potenciais mecanismos subjacentes. O artigo também discutiu o equilíbrio do risco de miocardite com vacinação versus os riscos cardíacos e outros da infecção viral COVID-19.
| Epidemiologia e apresentação clínica da miocardite após a vacinação contra COVID-19 |
Historicamente, a miocardite pós-vacinação tem sido relatada como um evento adverso raro após diversas vacinações, especialmente na vacinação contra varíola, gripe, hepatite B ou outras.1 Na população em geral, a miocardite é diagnosticada em aproximadamente 10 a 20 indivíduos por 100.000 por ano,2 e ocorre mais comumente em homens de idade mais jovem em comparação com mulheres.3
Na era pré-COVID-19, entre 620.195 relatórios arquivados no Sistema de Notificação de Eventos Adversos de Vacinas (VAERS) entre 1990 e 2018, 0,1% foram atribuíveis à miopericardite.1 Dessas notificações de miopericardite, 79% eram do sexo masculino.1 No entanto, VAERS é principalmente um sistema de detecção de segurança e de geração de hipóteses e não pode ser usado para determinar se uma vacina causou um evento adverso.4 Através deste relatório passivo, os Centros para Controle e Prevenção de Doenças (CDC) e o US Food and Drug Administration (FDA) conduz o monitoramento da segurança da vacina. Existem vários métodos e técnicas estatísticas são usados para analisar os dados VAERS, que o CDC e o FDA usam para orientar mais avaliações de segurança, como Vaccine Safety Datalink e informar as decisões sobre as recomendações de vacinas e a ação regulatória. Portanto, os dados VAERS devem ser interpretados com cautela devido às limitações inerentes da vigilância passiva.4 VAERS está sujeito a viés de relatório, incluindo subnotificação e supernotificação de eventos adversos ou relatórios estimulados que podem ocorrer em resposta a intensa atenção da mídia e aumento da consciência pública.4
Recentemente, um Comitê Consultivo sobre Práticas de Imunização do CDC identificou uma provável associação entre as 2 vacinas de mRNA COVID-19 da Pfizer-BioNTech e Moderna e casos de miocardite e pericardite.5 Os relatórios dos pacientes no VAERS foram categorizados de acordo com às definições de caso de trabalho do CDC como miocardite provável, miocardite confirmada ou pericardite aguda5 (Figura 1). De acordo com o Comitê Consultivo de Imunização, após ≈300 milhões de vacina de mRNA COVID-19 doses administradas até 11 de junho de 2021, houve 1226 notificações de casos prováveis de miocardite/pericardite em VAERS, 67% dos quais seguiram a segunda dose.5 Desses casos, 79% eram do sexo masculino, com a maioria em indivíduos <30 anos de idade com uma idade mediana de 24 anos. Até o início dos sintomas foi uma mediana de 3 dias, com a taxa mais alta no dia 2 após a vacinação e entre os pacientes com 16 a 18 anos de idade. Em 484 provável miocardite/casos de pericardite entre pacientes ≤29 anos de idade que foram revisados e caracterizados pelo CDC, 86% tinham relatos de dor no peito na apresentação, 61% tiveram relatos de alterações das ondas ST ou T no ECG, 64% tiveram relatos de enzimas cardíacas elevadas e 17% tiveram relatos de imagens cardíacas anormais.5 Em 323 dos relatórios que atenderam a definição do CDC de miocardite/pericardite confirmada, 96% foram hospitalizados, mas a maioria recebeu alta com resolução dos sintomas.5 A miocardite observada/os relatos de pericardite foram maiores do que as taxas de casos esperadas para homens em comparação com mulheres, e mais alto quando mais jovem comparadas com idades mais velhas (Tabelas 1).5

Figura 1: Definições de casos do Center for Disease Control and Prevention para miocardite aguda e pericardite aguda. Adaptado do Centro de Controle e Prevenção de Doenças com permissão.

Tabela 1: Número esperado versus número observado de casos de miocardite/ pericardite na janela de risco de 7 dias após a segunda dose da vacinação de mRNA COVID-19
* Relatórios preliminares de miocardite/ pericardite ao Sistema de Notificação de Eventos Adversos de Vacinas dos EUA após vacinação com a 2 dose das vacinas mRNA esperados vs números observados de casos usando janela de risco de 7 dias com dados até 11 de junho de 2021.Inclui relatórios preliminares totais identificados pelo Comitê Consultivo de Práticas de Imunização por meio do Sistema de Notificação de Eventos Adversos de vacina do CDC de dados sobre miocardite/ pericardite e relatórios pré selecionados do sistema de notificação de eventos adversos de vacinas com sinais e sintomas consistentes com miocardite/pericardite. Os casos obervados podem incluir casos prováveis e casos confirmados pela CDC. Adaptado do Centro de Controle e Prevenção de Doenças com permissão.
• Baseado nas taxas de incidência de fundo de doenças baseadas na população dos EUA para uso na avaliação de segurança de vacinas COVID-19 e contagens esperadas entre mulheres de 12 a 29 anos de idade ajustadas para prevalências mais baixa em relação aos homens por faltor de 1,73. Adaptado do Centro de Controle e Prevenção de Doenças com permissão.
Análises adicionais do CDC Vaccine Safety Datalink com dados de 9 participantes de organizações de saúde integradas revelaram um risco aumentado de miocardite/ eventos de pericardite entre indivíduos de 12 a 39 anos de idade no intervalo de risco de 7 dias após a vacinação de mRNA contra COVID-19 comparados com indivíduos não vacinados ou vacinados com vacinas não mRNA contra COVID-19.6 As taxas, baseadas na International Classification of Disease s- 10º revisão, também foram maiores em homens do que em mulheres. Todos os casos confirmados por prontuário com acompanhamento tiveram resolução dos sintomas; e entre aqueles que tiveram acompanhamento de ECG/ecocardiografia e testes laboratoriais, a maioria retornou ao normal ou basal.5
Vários casos de miocardite após a vacinação COVID-19 foram publicados em periódicos revisados por pares,8-19 com relatos predominantemente após a segunda dose da vacina mRNA COVID-19 (mRNA de BNT162b2-PfizerBioNTech e o mRNA-1273-Moderna). Os pacientes nesses relatórios, invariavelmente, apresentavam dor no tórax, geralmente 2 a 3 dias após uma segunda dose, algumas precedidas de febre e mialgia 1 dia após a vacinação. Estes eram predominantemente homens jovens que requerem hospitalização por miocardite e sem história de COVID-19 ou comorbidades. A maioria tinha níveis de anticorpos de pico para síndrome respiratória aguda grave coronavírus-2 (SARS-CoV-2) sugerindo imunização eficaz. Todos tinham troponina cardíaca elevada, o nível mais alto atingindo o pico geralmente 3 dias após a vacinação. O ECG foi anormal com elevações de ST na maioria das apresentações. Um ecocardiograma foi anormal em apenas 40%, com apenas uma pequena porcentagem com fração de ejeção do ventrículo esquerdo <50% na apresentação. A ressonância magnética cardíaca foi anormal em todos os pacientes testados, com achados sugestivos de miocardite, como realce tardio com gadolínio e edema miocárdio. Os níveis de peptídeo natriurético tipo B ou peptídeo natriurético N-terminal pró-tipo B estavam apenas ligeiramente elevados em aproximadamente dois terços dos pacientes quando medido. Os níveis de proteína C reativa estavam elevados na maioria e diminuiu junto com a troponina através do hospital. Quase todos os pacientes tiveram resolução dos sintomas e sinais e melhora nos marcadores de diagnóstico e imagem com ou sem tratamento.
O Ministério da Saúde de Israel também relatou 148 casos de miocardite entre 10,4 milhões de indivíduos vacinados, a maioria após uma segunda dose, principalmente em homens de 16 a 30 anos de idade.20 A maioria dos casos exigia hospitalização de até 4 dias, mas foram considerados leves. O relatório sugeriu uma possível ligação entre a vacina de segunda dose de mRNA e miocardite entre homens de 16 a 30 anos de idade,20 com uma ligação mais forte para idades de 16 a 19, e decrescente associação com idade avançada.16,20 A prevalência de miocardite foi de 1/20000 para o grupo de 16 a 30 anos em comparação com 1/100000 na população em geral que recebeu a mesma vacina. Da mesma forma, o Departamento de Defesa dos EUA relatou 23 militares do sexo masculino diagnosticados com miocardite após 2,8 milhões de doses de Vacinações COVID-19 administradas nas Forças Armadas, principalmente após a segunda dose.18
| COVID-19 associada a miocardite |
Esperava-se que o SARS-CoV-2 causaria doença predominantemente respiratória, semelhando ao que é visto com a síndrome respiratória aguda grave (SARS) em 2020.21 No entanto, enquanto a pandemia avançava na Europa e em Nova York, observou-se cada vez mais que havia envolvimento cardíaco e complicações tromboembólicas.22 Portanto, COVID-19 surgiu como um vírus patógeno afetando a vasculatura e resultando em lesão miocárdica, exigindo abordagens terapêuticas muito diferentes em comparação com SARS.22,23 Historicamente, pré-COVID-19, os coronavírus não têm sido comumente associados a danos miocárdicos significativos. SARS infectou> 8.000 indivíduos sem incidência significativa de miocardite. Em 1 série de autópsias, SARS-CoV-1 foi amplificável por reação em cadeia da polimerase em 7 de 20 (35%) corações, mas não estava associado a miocardite linfocítica, a marca registrada da miocardite viral clássica.24 Da mesma forma, a síndrome respiratória do Oriente Médio por coronavírus infectou > 2.000 indivíduos, com apenas 1 relato de caso de síndrome respiratória do Oriente Médio diagnosticada por ressonância magnética e miocardite por coronavírus.25
Por outro lado, dados sugerem que ≈12% a 20% dos pacientes hospitalizados com COVID-19 têm evidências de lesão cardíaca, conforme indicado por níveis elevados de troponina.23,26 Além disso em jovens atletas em recuperação de infecção COVID-19, 27 anormalidades de ressonância magnética cardíaca consistentes com miocardite foram relatadas em uma prevalência maior do que o esperado, em ≈1% a 3% dos atletas.28-32 Foi reconhecido que a COVID-19 pode resultar em uma síndrome inflamatória multissistema em crianças e jovens adultos. É raro, mas é uma condição séria definida por resposta hiperinflamatória excessiva que pode afetar múltiplos órgãos, como pulmão, rim, cérebro, pele, sistema gastrointestinal e sistema cardiovascular, resultando em disfunção ventricular, aneurisma coronariano e choque.33,34
Embora alguns investigadores tenham proposto a invasão de vírus como o mecanismo mais provável, outros enfocam em informações sobre as respostas das células inflamatórias do hospedeiro. Dados emergentes indicam que uma resposta imune mal-adaptativa do hospedeiro alimentado pela ativação excessiva das vias imunológicas inatas, juntamente com aumento de citocinas pró-inflamatórias, tromboinflamação desregulada, microangiopatia trombótica e a disfunção endotelial pode desempenhar um papel na patogênese da lesão cardíaca relacionada ao COVID-19.35,36 Outros mecanismos hipotetizados incluem isquemia de demanda e lesão miocárdica induzida por estresse e hipóxia.23 As comorbidades de linha de base, como síndrome metabólica, hipertensão e doença cardiovascular provavelmente também desempenham um papel.
Embora o SARS-CoV-2 possa entrar no cardiomiócito por meio de uma enzima conversora de angiotensina e cópias SARS-CoV-2 foram detectadas no tecido do coração,37-39 estudos de histopatologia cardíaca relataram a ausência de miocardite linfocítica difusa tradicionalmente vista na miocardite viral ou necrose de miócitos confluentes esperado em miocardite fulminante.38,40-43 Corações de pacientes que morreram de COVID-19 revelaram um maior número e distribuição difusa de células CD68 + em comparação com o controle ou outras condições de miocardite, indicando que as células de linhagem de monócitos/macrófagos em vez de linfócitos pode ser dominante neste cenário.35 Outros estudos revelaram que as células intersticiais, pericitos e macrófagos no miocárdio contêm SARS-COV-2 RNA por hibridização in situ, e que pericitos infectados por SARS-CoV-2 podem desempenhar um papel na célula endotelial capilar ou disfunção microvascular e necrose celular individual.39,42,44 É importante notar que os macrófagos possam mediar as respostas locais e sistêmicas à infecção viral, também são capazes de fixar o complemento, e portanto, pode causar a morte direta de miócitos próximos através da ativação de complexos de ataque apoptótico.35 Estas descobertas sugerem que COVID-19 pode incitar uma forma de miocardite que é diferente da típica miocardite linfocítica associada a outras apresentações de miocardite viral e pode, em vez disso, estar associada a células difusamente infiltrativas de linhagem de monócitos/ macrófagos.35,41,44
| Mecanismos potenciais da vacina COVID-19 na miocardite |
Vacinas mRNA contra o SARS-CoV-2 é composta de mRNA modificado com nucleosídeo, que codifica a glicoproteína de pico viral do SARS-CoV-2, mas contém não o vírus vivo ou o DNA. Eles são encapsulados em nanopartículas lipídicas que atuam como veículos de entrega para transportar mRNA para as células e pode incluir ingredientes como tampão e sais. Uma vez dentro da célula hospedeira, o mRNA da vacina faz com que as células construam a proteína de pico que estimula um a resposta do sistema imunológico adaptativo para identificar e destruir um vírus expressando pico da proteína. Anticorpos IgG de proteína de pico induzidos por vacina evitam a ligação de SARS-COV-2 à sua célula hospedeira por aumentar a ligação da proteína ao receptor da enzima de conversão 2 da angiotensina e, assim, neutralizar o vírus.
As moléculas de RNA selecionadas podem ser imunogênicas e estimular o sistema imunológico inato dos mamíferos, destruindo o mRNA antes que ele atinja as células-alvo, evitando a proteína do pico e a produção de anticorpos neutralizantes. Modificações de nucleosídeos de mRNA foram inovadoras, demonstrando reduzir a imunogenicidade inata e resultam em menos ativação de citocinas, pavimentando o caminho para o desenvolvimento de vacina de mRNA.
As vacinas de mRNA COVID-19 têm se mostrado altamente eficazes e seguras em ensaios em grande escala.46,47 Reações sistêmicas à vacina, que são geralmente leves e transitórios, foram relatados mais comumente entre a população mais jovem e com mais frequência após a segunda dose. Efeitos cardiovasculares adversos nos ensaios foram isolados, com incidências <0,05%, e não incluiu miocardite.46,47
Embora as modificações de nucleosídeos do mRNA demonstraram reduzir sua imunogenicidade inata,45 em certos indivíduos com predisposição genética, 48 o sistema imunológico a resposta ao mRNA não pode ser desativada e pode conduzir a ativação de um sistema imunológico inato e adquirido uma resposta aberrante. As células dendríticas ou receptor Toll-like expressam as células expostas ao RNA e ainda tem a capacidade de expressar citocinas e marcadores de ativação em certos indivíduos, embora isso possa ser marcadamente menos quando exposto ao mRNA com modificações de nucleosídeos do que quando tratado com RNA não modificado.45 O sistema imunológico pode, portanto, detectar o mRNA na vacina como um antígeno, resultando na ativação de cascatas pró-inflamatórias e vias imunológicas que podem desempenhar um papel no desenvolvimento de miocardite como parte de uma reação sistêmica em certos indivíduos.45,48 Será importante monitorar a possibilidade de tal complicações porque o uso revolucionário de mRNA está sendo considerado para outras vacinações e terapias.
Em relatórios publicados de miocardite após a vacinação com COVID-19, a biópsia cardíaca foi relatada em apenas 2 casos e não demonstrou infiltrado miocárdico11 ou qualquer evidência de miocardite. Isso pode ser atribuído a uma amostra erro nestes poucos casos, ou um mecanismo diferente causando lesão miocárdica detectada por biomarcadores cardíacos e ressonância magnética, não se manifestando como miocardite linfocítica ou eosinofílica tradicional ou mionecrose na histopatologia cardíaca. Reação em cadeia da polimerase e sorologia viral para outras causas, incluindo hepatite, vírus Epstein-Barr, citomegalovírus, parvovírus, micoplasma, HIV, influenza A/B, vírus sincicial respiratório, rinovírus, enterovírus (Coxsackie A, Coxsackie B), adenovírus e outras causas foram negativas para infecção aguda ou ativa, quando testado, argumentando contra miocardite causada por COVID-19 ou outras infecções.10,14-18 A sorologia para doenças autoimunes com anticorpos antinucleares e fator reumatoide foi negativa, sem evidência de predileção por indivíduos com doenças autoimunes preexistentes.10 Também não houve evidência de leucocitose, eosinofilia, anemia, trombocitopenia ou elevação da transaminase.19,12 O d-Dímero estava ligeiramente elevado em 2 pacientes sem evidência de embolia pulmonar ou eventos tromboembólicos venosos, 12,14 e a taxa de hemossedimentação foi levemente elevada em alguns casos.14 Em 1 relato de caso, um painel de testes para variantes em 121 genes potencialmente ligado à cardiomiopatia foi negativo,17 argumentando contra uma predisposição existente para cardiomiopatia atribuível a variantes de genes conhecidas nesse caso.
Em um relato de caso, os níveis de anticorpos neutralizantes de IgM e IgG de pico de SARS-CoV-2 não foram significativamente diferentes no paciente com miocardite do que em indivíduos sem miocardite pós-vacinação com mRNA COVID-19,17 argumentando contra uma resposta hiperimune.17 No mesmo relatório, o paciente com miocardite tinha níveis elevados de IL-1 (interleucina 1) antagonista do receptor, IL-5, IL-16, mas não de citocinas pró-inflamatórias, como IL-6, fator de necrose tumoral, IL-1B, IL-2, ou níveis de interferon-γ. No entanto, o paciente tinha níveis diminuídos do fator inibidor de leucemia, variando perfis bidirecionais para IL-10, fator inibidor da migração de macrófagos e fator de crescimento endotelial vascular em relação a um indivíduo não vacinado ou um indivíduo vacinado sem miocardite.17 Este paciente também tinha níveis mais elevados de anticorpos contra alguns autoantígenos, como aquaporina 4, antígeno de células endoteliais e proteína proteolipídica 1.17
Historicamente, foram relatados autoanticorpos circulantes reativos ao coração com maior frequência em pacientes com miocardite e têm várias implicações na patogênese.49 Esses autoanticorpos são geralmente dirigidos contra vários antígenos, alguns dos que pode ter efeitos funcionais nos miócitos cardíacos.49 Assim, a geração de autoanticorpos pode ser um dos mecanismos pelos quais a miocardite pode se desenvolver em indivíduos suscetíveis após a vacinação. No entanto, deve-se notar que no paciente estudado, os níveis de autoanticorpos atingiram o pico no dia 2 junto com os sintomas, mas eles não diminuíram conforme o esperado, à medida que o quadro clínico melhorou, embora o acompanhamento foi bastante curto. Autoanticorpos são mais frequentemente encontrados em pacientes com parentes de primeiro grau com cardiomiopatia em comparação com a população saudável, levantando a possibilidade de que a miocardite pode se desenvolver em um subgrupo de pacientes com a fundo genético apropriado. Além disso, os autoanticorpos podem não ser patogênico e também podem ser visto como resultado de inflamação do miocárdio. Além disso, neste caso, o paciente teve um aumento de 2 vezes na frequência de células natural killer (NK). O aumento nas células NK pode ter contribuído para a patologia ou o processo de resolução da doença. Não está claro se as diferenças observadas neste paciente em relação a aumentos relativos nas células NK, autoanticorpos e um perfil de citocinas desregulado refletem um fator de resposta imune patológico causal ou respostas adaptativas reativas a inflamação do miocárdio.
Outro potencial mecanismo para a miocardite é o mimetismo molecular entre a proteína do pico do SARS-CoV-2 e autoantígenos.50 Anticorpos contra as glicoproteínas de pico SARS-CoV-2 demonstraram apresentar reação cruzada com sequências de proteínas peptídicas de humanos, incluindo α-miosina.50 No entanto, eventos adversos graves ou reações autoimunes têm sido muito raros.46,47
É possível que a vacinação possa desencadear vias desreguladas preexistentes em certos indivíduos com predisposição, resultando em uma expansão policlonal de células B, formação de complexo imune e inflamação.48
Estudos anteriores em animais das vacinas para SARS-CoV-1 e coronavírus da síndrome respiratória do Oriente Médio sugeriram preocupações com o aumento da doença com a reexposição ao vírus do tipo selvagem após a vacinação.51,52 Estes foram desencadeados por diferentes mecanismos, incluindo neutrofílicos e eosinofílicos em infiltrados celulares, possivelmente ligados a respostas Th17, ou anticorpos não neutralizantes, resultando no aumento da citotoxicidade celular induzida por anticorpos e ativação aberrante do sistema imunológico inato e adquirido.53-56
Nenhuma evidência de qualquer realce da imunidade celular ou realce dependente de anticorpos de imunidade em estudo de primatas após a vacinação ou após a infecção foi observada.58 Esses achados levaram a um estudo nacional ACTIV do Institutes of Health (Painel de intervenções terapêuticas e vacinas) para concluir que o risco de aumento imunológico após COVID-19 eram baixas, mas que exigiam farmacovigilância e monitoramento contínuos.58 Até o momento, nenhuma doença COVID-19 e nem as novas vacinas COVID-19 mostraram evidências de aumento da imunidade dependente de anticorpos ou outras formas de aumento do sistema imunológico com reexposição. Pessoas infectadas com SARS-CoV-2 não relataram o desenvolvimento do aumento da imunidade dependente de anticorpos na exposição repetida e descoberta da vacina COVID-19, os casos são raros e leves. Além disso, não há evidências de infecção aguda por COVID-19 durante a apresentação de casos de miocardite após a vacinação com COVID-19, argumentando contra uma infecção disruptiva como causa.
Os relatórios, até o momento, não sugerem uma reação de hipersensibilidade retardada, como uma reação semelhante à doença do soro ou miocardite eosinofílica como causa de miocardite após a vacinação. Embora rara, reações de hipersensibilidade cutânea retardadas localizadas foram descritas com a vacinação de mRNA COVID-19 com uma latência mediana de 7 dias,59 ao contrário da miocardite emergindo mais cedo dentro de 3 a 4 dias após a vacinação. Nenhum dos relatos de caso publicados até o momento tinha evidência de eosinofilia no sangue periférico ou deposição de imunocomplexos ou infiltrados eosinofílicos em amostras de biópsia endomiocárdica que argumentam contra hipersensibilidade, miocardite alérgica ou eosinofílica.8-17 Nanopartículas lipídicas ou adjuvantes usadas em vacinas de mRNA não demonstraram resultar uma resposta imune ou inflamatória e também não foram associadas a miocardite.
Ocorrências raras de trombocitopenia trombótica imunológica induzida por vacina foram relatadas após a vacinação com o vetor adenoviral recombinante que codifica o antígeno de proteína de pico de SARS-COV-2.60 Embora complicações trombóticas muito raras foram relatadas após vacinações de mRNA COVID-19, esses pacientes não têm trombocitopenia ou anticorpos antiplaquetários.61,62
Nenhum dos casos de miocardite relatados após a vacinação de mRNA apresentou evidência de eventos trombóticos, trombocitopenia ou coagulação intravascular disseminada.
Esses pacientes também não apresentavam febre persistente além nos primeiros dias, linfadenopatia, hepatoesplenomegalia, citopenias (anemia, leucopenia e trombocitopenia), hipofibrinogenemia, transaminite, elevação extrema na ferritina ou deficiência de múltiplos órgãos para sugerir uma tempestade de citocina, linfo-histiocitose hemofagocítica ou síndrome de ativação macrofágica que resulta da superativação de linfócitos T e macrófagos.63,64
Predominância masculina em casos de miocardite/pericardite foi descrito em estudos clínicos e experimentais antes, e as razões são desconhecidas. Uma possível explicação importante relaciona-se às diferenças de hormônios sexuais.3,65,66 Acredita-se que a testosterona desempenha um papel, por uma combinação de mecanismo de inibição de células anti-inflamatórias3,65-67 e compromisso com uma resposta imune do tipo Th1.68 O estrogênio tem efeitos inibitórios nas células T pró-inflamatória, resultando em uma diminuição da imunidade mediada pelas células; e a incidência de pericardite é maior em mulheres durante o período da pós-menopausa.69 Outro fator contribuinte poderia ser o subdiagnóstico em mulheres. Por nossa análise do banco de dados VAERS, em 6 de junho de 2021, foram 6.235 casos relatados de dor no peito, 69% dos quais eram em mulheres, contra 30% em homens.70 Apesar de uma maior prevalência de dor no peito em mulheres, a avaliação diagnóstica, incluindo ECG, biomarcadores laboratoriais, ecocardiografia, e ressonância magnética, foi realizada e relatada com mais frequência em homens do que em pacientes femininos que apresentam dor no peito após a vacinação COVID.
| Avaliando o risco |
Apesar desses casos raros de miocardite, a avaliação do benefício-risco para vacinação COVID-19 mostra um equilíbrio favorável para todos os grupos de idade e sexo5 (Figuras 2 e 3). Dado o risco potencial conhecido de complicações com infecção por COVID-19, incluindo hospitalizações e morte mesmo em adultos mais jovens (a mortalidade permanece 0,1-1 por 100.000 para pessoas de 12 a 29 anos de idade), a decisão do risco-benefício permanece favorável a vacinação. Portanto, a vacinação COVID-19 é atualmente recomendada para todas as pessoas com idade ≥ 12 anos5 (Figura 3). A vacinação com COVID-19 não apenas previne hospitalizações e morte relacionadas ao COVID-19, mas também evita as complicações relacionadas ao COVID-19, como miocardite, síndrome inflamatória multissistema33 e sequelas pós-agudas da infecção por SARS-CoV-2 ou COVID-19.74
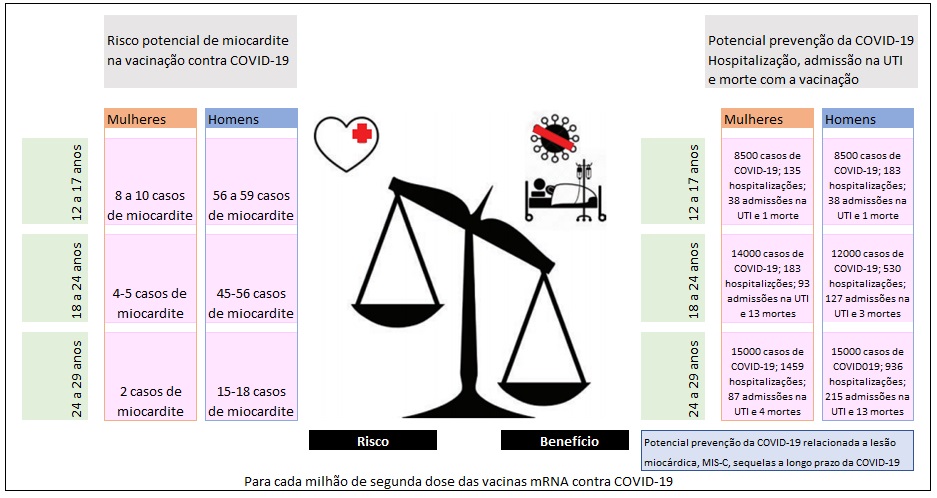
Figura 2: benefícios previstos na redução das hospitalizações e mortes relacionadas à COVID-19 e risco de miocardite após a segunda dose de vacinação de mRNA COVID-19 por faixa etária.
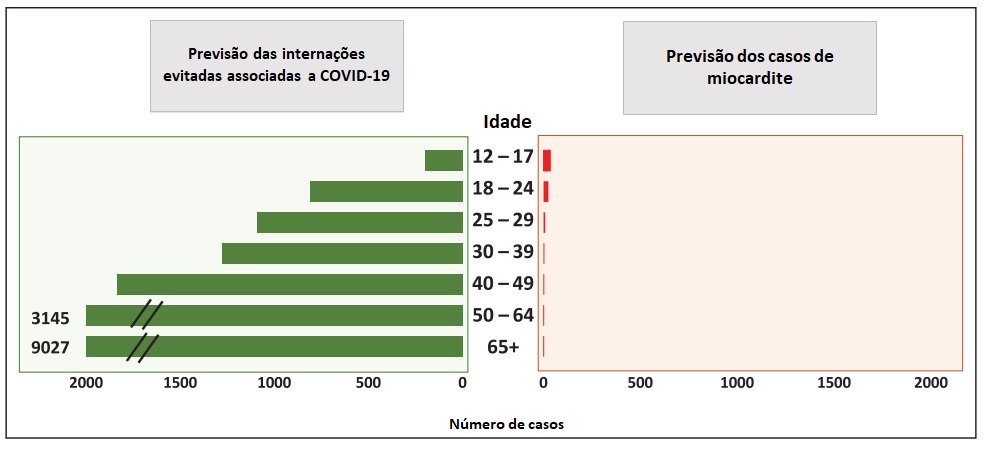
Figura 3: Risco potencial de miocardite com a vacinação de mRNA contra COVID-19 nos 120 dias após a vacinação e prevenção prevista de casos de COVID-19 em relação a hospitalização, admissões na UTI e mortes de acordo com idade e sexo.
| Estratégias de gestão |
Embora raro, os médicos devem estar cientes do risco de miocardite e pericardite, que deve ser considerado em indivíduos que apresentam dor no peito dentro de uma semana após a vacinação, especialmente na população mais jovem. Para a avaliação inicial, ECG e nível de troponina cardíaca devem ser obtidas, e marcadores inflamatórios, como C-reativo a taxa de sedimentação de proteínas e eritrócitos pode ser útil.5 Para casos suspeitos, consulta de cardiologia e avaliação com ecocardiografia e ressonância magnética cardíaca devem ser considerados. Uma avaliação para infecção aguda por COVID-19 (via reação em cadeia da polimerase de amostra do trato respiratório) e doença anterior (via nucleocapsídeo SARS-CoV-2 e anticorpos de proteína de pico) seria útil. Avaliação e manejo podem variar dependendo da idade do paciente, apresentação clínica, outras causas potenciais e comorbidades, estabilidade hemodinâmica e de ritmo e curso clínico. Pacientes com dor no peito, evidência de lesão do miocárdio, alterações de ECG, anormalidade de imagem cardíaca, arritmia, instabilidade hemodinâmica após vacinação com COVID-19 provavelmente exigirá hospitalização e acompanhamento rigoroso.
Em relatos de casos publicados, além do cuidado suporte, antiinflamatórios não esteróides, esteróides e colchicina foram usados para o gerenciamento de alguns dos pacientes com miocardite após vacinação com COVID-19. Poucos pacientes foram tratados com imunoglobulina intravenosa e aspirina, e alguns foram iniciados com β-bloqueador e terapia com inibidor da enzima de conversão da angiotensina por causa da disfunção sistólica do ventrículo esquerdo. Embora não há estudos prospectivos ou randomizados, é razoável considerar essas terapias, especialmente em pacientes com sintomas e descobertas significativas. Entre pacientes com resolução rápida dos sintomas, com função cardíaca preservada e biomarcadores normais ou resolução da anormalidade do biomarcador cardíaco, a terapia pode ser adiada. Em pacientes com sintomas leves persistentes sem instabilidade hemodinâmica, arritmia, disfunção ventricular esquerda significativa ou insuficiência cardíaca, colchicina, antiinflamatórios não esteróide e esteróides podem ser considerados. Em pacientes com disfunção ventricular esquerda, insuficiência cardíaca, arritmia de início recente ou instabilidade hemodinâmica, esteróides intravenosos e imunoglobulina intravenosa ao longo com outras medidas de suporte cardíaco ou circulatório pode ser considerado. Em pacientes com disfunção ventricular sistólica, a terapia orientada por diretrizes, incluindo β-bloqueadores e inibidores da enzima de conversão da angiotensina deve ser iniciada. A gestão deve incluir um cardiologista para avaliação inicial, avaliação, tratamento e acompanhamento e um especialista em doenças infecciosas para orientação sobre estratégias de imunização subsequentes.
Embora o curso clínico pareça leve, com provável resolução dos sintomas e sinais, é razoável restringir ou adiar atividades físicas extenuantes e esportes competitivos até após a resolução completa dos sintomas, sinais, anormalidades hemodinâmicas, rítmicas, diagnósticas e de biomarcadores. Se uma pessoa desenvolve miocardite ou pericardite após a primeira dose de uma vacina de mRNA, o CDC recomenda que a segunda dose ser adiada e que a segunda dose poderia ser reconsiderado na resolução dos sintomas, sinais e descobertas, sob certas circunstâncias.75 Há uma evolução de evidências de que uma vacina de mRNA de dose única não oferece proteção adequada na população em geral contra novos variantes do SARS-COV-2, e mais estudos são necessários para determinar a eficácia de uma única contra 2 doses da vacina de mRNA em diferentes grupos etários.75 O CDC recomenda que todos os casos de miocardite e pericardite pós-vacinação com COVID19 sejam notificados ao VAERS.5
| Direções futuras |
Estudos são necessários para elucidar a incidência, fatores de risco, incluindo predisposição genética, prognóstico, potencial mecanismos, razões para diferenças de sexo, curso clínico, estratégias de tratamento e impacto a longo prazo da miocardite após a vacinação.5
Estudos futuros devem ser concebidos e apoiados especificamente para:
- Caracterizar o papel das populações de células imunológicas, suas semelhanças e diferenças no desenvolvimento de COVID-19, imunidade pós-vacinação contra COVID-19, lesão miocárdica e síndrome inflamatória multissistêmica em crianças relacionadas ao COVID-19 e miocardite relacionada às vacinas COVID-19;
- Caracterizar a histopatologia, imunohistoquímica, ultraestrutural e alterações funcionais do miocárdio no contexto de lesão miocárdica relacionada a COVID-19 e miocardite relacionada;
- Às vacinas COVID-19, e sua correlação com os achados de imagem e biomarcadores cardíacos;
- Triagem prospectiva para o desenvolvimento de miocardite e lesão miocárdio após vacinação contra COVID-19 em diferentes populações com ênfase específica nas diferenças relacionadas ao sexo e à idade;
- Explorar fatores predisponentes para o desenvolvimento da lesão miocárdica com COVID-19 ou miocardite com vacinas contra COVID-19 (por exemplo, fatores genéticos, comorbidades, imunidade ou perfil de autoimunidade);
- Explorar os mecanismos para o desenvolvimento de miocardite relacionada a vacinação mRNA contra COVID-19, incluindo, mas não se limitando a, mimetismo, formação de autoanticorpos, reatividade imune de mRNA, gatilho de processos imunológicos desregulados preexistentes; isto também é importante para determinar se esses fatores são específicos para entrega de pico por meio da tecnologia de mRNA ou possivelmente um evento raro de vacinações de mRNA;
- Caracterizar prospectivamente o curso clínico e os defechos a curto e longo prazo de lesão miocárdica relacionada ao COVID19 e miocardite relacionada às vacinas COVID-19;
- Explorar estratégias adequadas de tratamento e gestão para lesão miocárdica relacionada a COVID-19 e miocardite relacionada a vacinas contra COVID-19;
- Caracterizar biomarcadores cardíacos, função cardíaca e estrutura em pacientes com sintomas prolongados após COVID-19 ou miocardite relacionado à vacina COVID-19, se houver;
- Determinar uma relação risco-benefício para diferentes grupos de idade e sexo com diferentes doses de vacinação COVID-19;
- Fornecer orientação sobre retorno às atividades para os pacientes com evidência de lesão miocárdica relacionada a COVID-19 e miocardite relacionada às vacinas COVID-19.
Um registro colaborativo de miocardite relacionada a vacinação contra COVID-19 com dados demográficos, apresentação clínica, biomarcadores, incluindo troponina cardíaca, achados diagnósticos de ECG, ecocardiografia e ressonância magnética cardíaca, biomarcadores, com um bioregistro pareado com sangue e amostras de tecido cardíaco seriam muito valiosos e ajuda a responder algumas dessas perguntas.
| Conclusão |
Em resumo, > 177 milhões de pessoas receberam pelo menos 1 dose da vacina COVID-19 (> 300 milhões de doses) nos Estados Unidos. CDC e outras organizações internacionais continuam a monitorar a segurança das vacinas COVID-19 por qualquer problema de saúde incluindo casos raros de miocardite após a vacinação.75 Apesar dos raros casos de miocardite, a avaliação de risco-benefício da vacinação contra COVID-19 mostra um equilíbrio favorável para todos os grupos de idades e sexo, portanto, a vacinação COVID-19 é atualmente recomendada para todas as pessoas com 12 anos de idade ou mais.