Introdução
O conhecimento dos testes de diagnóstico para coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2) continua evoluindo, e é importante um entendimento claro da natureza dos testes e da interpretação de seus achados.
Esta visão descreve como interpretar 2 tipos de testes de diagnóstico comumente usados para infecções por SARS-CoV-2: reação em cadeia da polimerase com transcriptase reversa (RT-PCR) e ensaio de imunoabsorção enzimática IgM e IgG (ELISA) - e como os resultados podem variar ao longo do tempo.
Detecção de RNA viral por RT-PCR
Até agora, o teste mais comumente utilizado e confiável para o diagnóstico de COVID-19 foi o teste de RT-PCR realizado com amostras nasofaríngeas ou outras amostras do trato respiratório superior, como coletas da garganta ou, mais recentemente, saliva.
Diferentes fabricantes usam uma variedade de alvos genéticos de RNA, com a maioria dos testes visando um ou mais genes: envelope (ENV), nucleocapsídeo (N), proteínas estruturais (S), RNA polimerase RNA-dependente (RdRp) e ORF1.
A sensibilidade dos testes aos genes individuais é comparável de acordo com os estudos comparativos, exceto os primers e as sondas RdRp-SARSr (Charité Institute), que possuem uma sensibilidade um pouco menor provavelmente devido a uma incompatibilidade no primer reverso (1).
Na maioria das pessoas com infecção sintomática por COVID-19, o RNA viral medido pelo limiar do ciclo (Ct) é detectado logo no primeiro dia dos sintomas e alcança seu pico na primeira semana dos sintomas. O Ct é o número de ciclos de replicação necessários para produzir um sinal fluorescente, valores mais baixos de Ct representam cargas de RNA viral mais altas. Um valor de Ct inferior a 40 é clinicamente relatado como PCR positivo.
Os resultados positivos começam a diminuir na semana 3 e depois se tornam indetectáveis. No entanto, os valores de Ct obtidos em pacientes hospitalizados gravemente enfermos são inferiores aos valores de Ct em casos leves, e os positivos do PCR podem persistir além de 3 semanas após o início da doença, quando a maioria dos casos leves produzirão um resultado negativo (2). No entanto, um resultado "positivo" de PCR reflete apenas a detecção de RNA viral e não indica necessariamente a presença de vírus viáveis (3).
Em alguns casos, o RNA viral foi detectado por RT-PCR mesmo após a semana 6 depois do primeiro teste positivo. Alguns casos também foram relatados positivos após 2 testes negativos consecutivos de PCR realizados com 24 horas de intervalo. Não está claro se é um erro de teste, uma reinfecção ou uma reativação.
Em um estudo de 9 pacientes, as tentativas de isolar o vírus em cultura não tiveram sucesso após o dia 8 depois da aparição da doença, o que se correlaciona com o declínio na infectividade após a primeira semana (3).
É em parte por isso que a "estratégia baseada em sintomas" do CDC indica que os profissionais de saúde podem voltar ao trabalho “se pelo menos 3 dias (72 horas) se passaram desde a recuperação, definida como resolução da febre sem o uso de medicamentos e melhora dos sintomas respiratórios (por exemplo, tosse, falta de ar) e pelo menos 10 dias terem se passado desde o início dos sintomas" (4).
A cronologia da positividade do PCR é diferente em outras amostras que não o esfregaço nasofaríngeo. A positividade do PCR diminui mais lentamente no escarro e ainda pode ser positiva após as amostras nasofaríngeas serem negativas (3).
Em um estudo, foram observados positivos no PCR em fezes de 55 de 96 (57%) pacientes infectados e permaneceram positivos nas fezes além do swab nasofaríngeo por 4 a 11 dias, mas não estava relacionada à gravidade clínica (2). Constatou-se que a persistência da positividade da PCR no escarro e nas fezes foi semelhante, conforme avaliado por Wölfel et al (3).
Em um estudo de 205 pacientes com infecção confirmada por COVID-19, a positividade da RT-PCR foi maior nas amostras de lavado broncoalveolar (93%), seguidas de escarro (72%), esfregaço nasal (63%) e esfregaço faríngeo (32%) (5). Os resultados falso-negativos foram produzidos principalmente devido ao momento inadequado da coleta de amostras em relação ao início da doença e à deficiência na técnica de amostragem, principalmente nos swabs nasofaríngeos.
A especificidade da maioria dos testes de RT-PCR é de 100%, porque o design do primer é específico para a sequência do genoma SARS-CoV-2. Resultados falsos positivos ocasionais podem ocorrer devido a erros técnicos e contaminação do reagente.
Detecção de anticorpos contra o SARS-CoV-2
A infecção por COVID-19 também pode ser detectada indiretamente, medindo a resposta imune do hospedeiro à infecção por SARS-CoV-2.
O diagnóstico sorológico é especialmente importante para pacientes com doença leve a moderada que podem apresentar tardiamente, depois das primeiras 2 semanas do início da doença.
O diagnóstico sorológico também está se tornando uma ferramenta importante para entender o alcance do COVID-19 na comunidade e para identificar pessoas que são imunes e potencialmente "protegidas" da infecção.
O marcador sorológico mais sensível e mais precoce são os anticorpos totais, cujos níveis começam a aumentar a partir da segunda semana do início dos sintomas. 6
Embora tenha sido encontrado que IgM e IgG por ELISA são positivos inclusive no quarto dia após o início dos sintomas, os níveis mais altos ocorrem na segunda e terceira semana de doença.
Por exemplo, a soroconversão de IgM e IgG ocorreu em todos os pacientes entre a terceira e a quarta semana após o início da doença clínica, medidos em 23 pacientes por To et al (7) e em 85 pacientes por Xiang et al (8). A IgM começa a diminuir e atinge níveis mais baixos na semana 5 e quase desaparece na semana 7, enquanto a IgG persiste por mais de 7 semanas (9).
Em um estudo de 140 pacientes, a sensibilidade combinada de PCR e IgM por ELISA ao antígeno nucleocapsídeo (N) foi de 98,6% versus 51,9% com um único teste de PCR. Durante os primeiros 5,5 dias, o PCR quantitativo apresentou uma taxa de positividade mais alta que o IgM, enquanto o IgM (ELISA) apresentou uma taxa de positividade mais alta após o dia 5,5 da doença (10).
Os testes de anticorpos IgM e IgG baseados em ELISA têm uma especificidade maior que 95% para o diagnóstico de COVID-19. O teste de amostras de soro unidos com o primeiro e o segundo PCR duas semanas depois, pode aumentar ainda mais a precisão do diagnóstico. Normalmente, a maioria dos anticorpos é criada contra a proteína mais abundante no vírus, que é o N.
Portanto, testes que detectam anticorpos para N seriam os mais sensíveis. No entanto, o domínio de ligação ao receptor da proteína S (RBD-S) é a proteína de ligação ao hospedeiro, e os anticorpos contra o RBD-S seriam mais específicos e espera-se que sejam neutralizantes. Portanto, o uso de um ou de ambos os antígenos para detectar IgG e IgM resultaria em alta sensibilidade (7). No entanto, os anticorpos podem ter reatividade cruzada com SARS-CoV e possivelmente com outros coronavírus.
Os testes rápidos para detecção de anticorpos foram amplamente desenvolvidos e comercializados e têm qualidade variável. Muitos fabricantes não divulgam a natureza dos antígenos utilizados. Esses testes são de natureza puramente qualitativa e podem apenas indicar a presença ou ausência de anticorpos contra SARS-CoV-2.
A presença de anticorpos neutralizantes só pode ser confirmada por um teste de neutralização de redução de placa. No entanto, foi demonstrado que os altos títulos de anticorpos IgG detectados por ELISA tem correlação positiva com anticorpos neutralizantes (7).
A persistência a longo prazo e a duração da proteção conferida pelos anticorpos neutralizantes são desconhecidas.
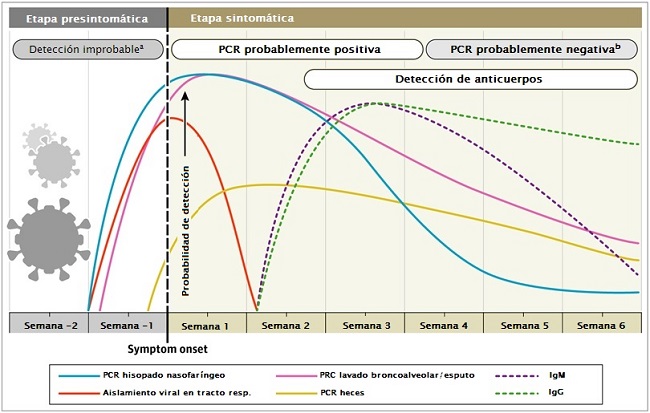
Gráfico. Os intervalos de tempo estimados e as taxas de detecção viral são baseados em dados de vários relatórios publicados. Devido à variabilidade dos valores entre os estudos, os intervalos de tempo estimados devem ser considerados aproximações e a probabilidade de detecção da infecção por SARS-CoV-2 são apresentadas qualitativamente. a) A detecção ocorre apenas se os pacientes forem monitorados proativamente a partir do momento da exposição b) É mais provável que você relate um resultado negativo do que positivo de PCR com swab nasofaríngeo.
|
Conclusões
|