| Microbioma intestinal |
O microbioma intestinal pode ser visto como um órgão real do corpo que, de forma dinâmica, contribui para o bem-estar do organismo hospedeiro. Os trilhões de bactérias, fungos e vírus que colonizam o trato gastrointestinal influenciam processos locais e sistêmicos: transformação de nutrientes, fornecimento de vitaminas, maturação da imunidade da mucosa, comunicação intestino-cérebro e até progressão tumoral.
| Disbiose |
A disbiose refere-se ao desequilíbrio dessas espécies devido à redução da diversidade microbiana. Uma infinidade de doenças e síndromes, incluindo doenças inflamatórias intestinais (DII) e síndrome do intestino irritável, mas também distúrbios metabólicos, como obesidade e diabetes, estão associados à disbiose intestinal. A perda desse equilíbrio pode ser causada por:
• fatores do hospedeiro: antecedentes genéticos, estado de saúde (infecções, inflamação) e hábitos de vida,
• fatores ambientais: dieta (p.ex. alto teor de açúcar, baixo teor de fibra), higiene e uso de medicamentos – notadamente antibióticos.
| Impacto do uso de antibióticos na microbiota de crianças e adultos |
A antibioticoterapia é uma das principais causas de disbiose, causando impacto nas comunidades microbianas, espalhando genes resistentes a antibióticos que podem ser transmitidos a outras bactérias, alterando o microbioma.1 (Figura 1)
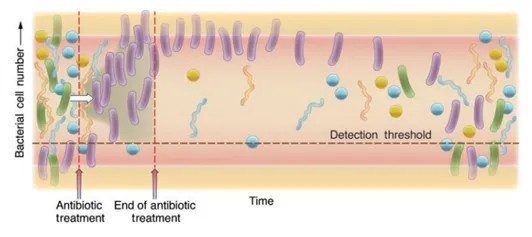

Figura 1. Impacto da administração de antibióticos na comunidade bacteriana do cólon. Após o início do tratamento, há um aumento de bactérias resistentes (bastonetes roxos). Esse aumento se deve ao fato de uma bactéria suscetível (bastonetes verdes) se tornar resistente ou de bactérias resistentes, aumentarem em número devido à sua capacidade de sobreviver à pressão seletiva fornecida pelo antibiótico. A resistência adquirida deve-se a transferência horizontal de genes ou eventos de mutação (seta branca). Imagem adaptada de: Microbiology (2010), 156, 3216–3223.
> Crianças
A colonização microbiana durante o desenvolvimento pós-natal inicial representa um processo dinâmico, que evolui para uma configuração semelhante à do adulto dentro de 3 anos após o nascimento. A colonização por comensais é necessária para o amadurecimento imunológico e a homeostase metabólica do hospedeiro. O tratamento com antibióticos no início da vida está associado a alterações na microbiota que, mesmo que transitórias, podem levar a alterações persistentes na função imunológica. Consequentemente, tais acontecimentos podem regular a susceptibilidade mais tarde na vida a doenças atópicas, imunomediadas, metabólicas e potencialmente doenças neoplásicas, bem como distúrbios neuropsiquiátricos.2
> Adultos
A antibioticoterapia em adultos a curto prazo causa:
1. Diarreia associada a antibióticos (AAD): diarreia está associada a antibióticos frequentemente utilizados na prática clínica (p.ex. amoxicilina + clavulanato, claritromicina e Azitromicina) sendo causa de internações prolongadas e aumento de custos de saúde.3-4
2. Infecção pelo Clostridioides difficile.
3. Supercrescimento de Cândida (p.ex. candidíase vaginal)
4. Resposta inadequada a vacinas: Thomas Hagan et al., (2019) demonstraram que o uso de antibióticos induziu alterações da microbiota intestinal que afetaram adversamente a resposta imunológica à vacinação anti-influenza.5
5. Pior resposta aos inibidores de checkpoints imunológicos em pacientes oncológicos. O tratamento com antibióticos administrado dentro de 30 dias a partir do início da imunoterapia foi associado a uma sobrevida global significativamente pior e a um maior risco de doença refratária.6
6. Suscetibilidade a infecções. Um estudo de coorte populacional no Reino Unido demonstrou que pacientes com uso prévio frequente de antibióticos tiveram maiores taxas de internação relacionada a complicações infecciosas nos 6 meses subsequentes.7
A longo prazo, há estudos relacionando a antibioticoterapia ao risco aumentado de desenvolvimento de DII, Diabetes, adenomas de cólon, distúrbios cognitivos e psiquiátricos. 8-11
| Papel da microbiota na resistência aos antibióticos |
O aumento da resistência antimicrobiana é uma ameaça crescente à saúde e é uma consequência do uso excessivo de agentes antimicrobianos na medicina atual. A microbiota intestinal é um reservatório significativo de genes de resistência antimicrobiana. A coleção de genes ou material genético que confere a resistência antimicrobiana constitui o resistoma intestinal e pode envolver os patógenos ou comensais do trato intestinal. A diversidade deste resistoma intestinal é influenciada por vários fatores ambientais, incluindo a dieta e a exposição a antibióticos.12
O uso indevido de antibióticos pode selecionar bactérias multirresistentes e modificar o repertório desses genes no intestino. Isso ocorre por transferência horizontal de genes de resistência antibiótica entre bactérias. O desenvolvimento de intervenções eficazes para manipular o microbioma intestinal nos permitiria modificar o risco de resistência antimicrobiana.
Nesse aspecto, um estudo demonstrou que a adição de S. boulardii CNCM-I 745 à terapia anti H. pylori reduziu a abundância de genes de resistência antibiótica, particularmente aqueles genes que conferem resistência a lincosamidas, tetraciclinas, macrolídeos e alguns genes da classe dos beta-lactâmicos.13
| Probióticos: uso na estratégia de co-prescrição com antibióticos |
Os probióticos podem impactar a restauração da microbiota normal, afetando positivamente o ecossistema intestinal. Por definição, são “microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro”.14 Os probióticos são bactérias (p.e.x. Lactobacillus, Bifidobacterium) e leveduras (p.ex. Saccharomyces boulardii) e o conhecimento de sua origem é fundamental na estratégia de co-prescrição com antibióticos. Há evidências sobre essa conduta nas seguintes situações clínicas, destacadas no recém-publicado guideline sobre Probióticos e prebióticos da World Gastroenterology Organisation Global Guidelines (Fevereiro, 2023):
• Prevenção da diarreia associada a antibióticos. Metanálises concluíram que os probióticos podem fornecer um efeito moderado na prevenção da diarreia associada a antibióticos em crianças, adultos e idosos.15-17
• Prevenção da diarreia por C. difficile. Uma metanálise de 2017 concluiu que os probióticos são eficazes na prevenção da diarreia associada ao C. difficile em pacientes que recebem antibióticos.18 O uso de probióticos em pacientes não imunocomprometidos ou gravemente debilitados pareceu ser seguro. Os autores também citaram a necessidade de mais pesquisas, mas concluíram que os dados indicam que os pacientes com alto risco de desenvolver diarreia associada ao C. difficile se beneficiariam se fossem informados sobre os potenciais benefícios e malefícios dos probióticos.
• Erradicação do Helicobacter pylori. O Consenso de Maastricht VI/Florença de 2022 sobre o tratamento da infecção por H. pylori concluiu que certos probióticos demonstraram ser eficazes na redução dos efeitos colaterais gastrointestinais causados pelas terapias de erradicação do Helicobacter pylori e, portanto, ter um efeito benéfico no tratamento.19
| Uso racional dos Probióticos na co-prescrição com antibióticos |
Os probióticos demonstraram vários padrões de sensibilidade aos antibióticos (tabela 1).20 Os de origem bacteriana são geralmente suscetíveis à maioria dos antibióticos prescritos administrados por via oral, enquanto os probióticos de levedura, como Saccharomyces boulardii, são resistentes. Deve ser dada especial atenção às co-prescrições de antibióticos e probióticos para garantir que a estirpe probiótica também não seja suscetível.
Nesse sentido, em comparação com os probióticos bacterianos, a levedura probiótica S. boulardii, por exemplo, pode ser co-prescrita com antibióticos orais sem ser afetada. Consequentemente, esta abordagem impede oportunidades de transferência horizontal de genes de resistência.
Os probióticos apresentam um excelente perfil de segurança, mas devem ser usados com cautela em pacientes gravemente imunocomprometidos e neonatos prematuros. Em pacientes frágeis, existe risco de bacteremia por alguns Lactobacillus spp. (p.ex., Lactobacillus rhamnosus GG e Lactobacillus casei). O S. boulardii deve ser evitado em pacientes gravemente enfermos, em nutrição parenteral ou com cateteres venosos centrais devido ao risco de fungemia.

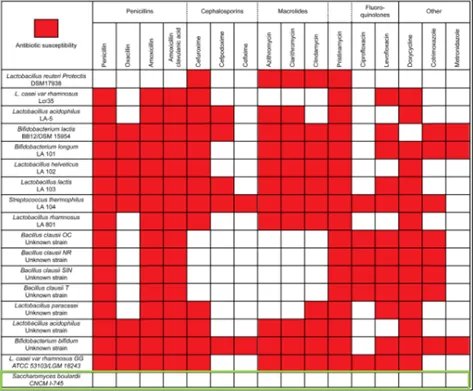
 Tabela 1. Mapa da suscetibilidade aos antibióticos de cada cepa probiótica. Tabela adaptada de: C. Neut et al. / Médecine et maladies infectieuses 47 (2017) 477–483.
Tabela 1. Mapa da suscetibilidade aos antibióticos de cada cepa probiótica. Tabela adaptada de: C. Neut et al. / Médecine et maladies infectieuses 47 (2017) 477–483.
|
Conclusão Deve-se considerar, conscientemente, riscos e benefícios sempre que for necessário prescrever um curso de antibiótico. Além disso, o uso de probióticos é um complemento valioso à antibioticoterapia. Já há evidências de benefício dessa associação na prevenção da diarreia associada a antibióticos, na prevenção da diarreia por C. difficile e na redução dos efeitos colaterais relacionados à erradicação do H. pylori. Estudos adicionais que avaliem a seleção de cepas por métodos moleculares, dosagem ideal, duração do tratamento e mais populações-alvo certamente revelarão todo o potencial dos próbioticos nessa indicação de co-prescrição. |

