A microbiota intestinal desempenha um papel crucial na regulação da saúde humana. Avanços em técnicas moleculares têm permitido uma compreensão mais profunda das complexas interações entre o hospedeiro e os microrganismos presentes no intestino. A disbiose, o desequilibio da microbiota, está diretamente relacionada a uma série de doenças, como obesidade, diabetes tipo 2, esteatose hepática, doenças intestinais inflamatórias e diversos tipos de câncer.
Nesse contexto, a pesquisa de Vos e colaboradores (2022) explorou os mecanismos moleculares que explicam as possíveis relações de causa e efeito entre as bactérias intestinais e o surgimento dessas doenças. Foram examinados metabólitos bem estabelecidos (como ácidos graxos de cadeia curta, ácidos biliares, trimetilamina N-óxido) e atores moleculares mais recentes (como endocanabinoides, lipídios bioativos, compostos fenólicos, produtos derivados da glicação avançada e enterosinas) e seus receptores específicos, como o receptor alfa ativado por proliferador de peroxissoma (PPARα) e gama (PPARγ), o receptor de hidrocarboneto de arila (AhR) e os receptores acoplados à proteína G (como GPR41, GPR43, GPR119, receptor acoplado à proteína G 5 de Takeda).
> Microbiota intestinal humano
Microrganismos, seus genes e produtos colonizam o corpo humano desde o nascimento. Embora todos os locais organismo sejam colonizados, o intestino abriga a maior quantidade desses seres.
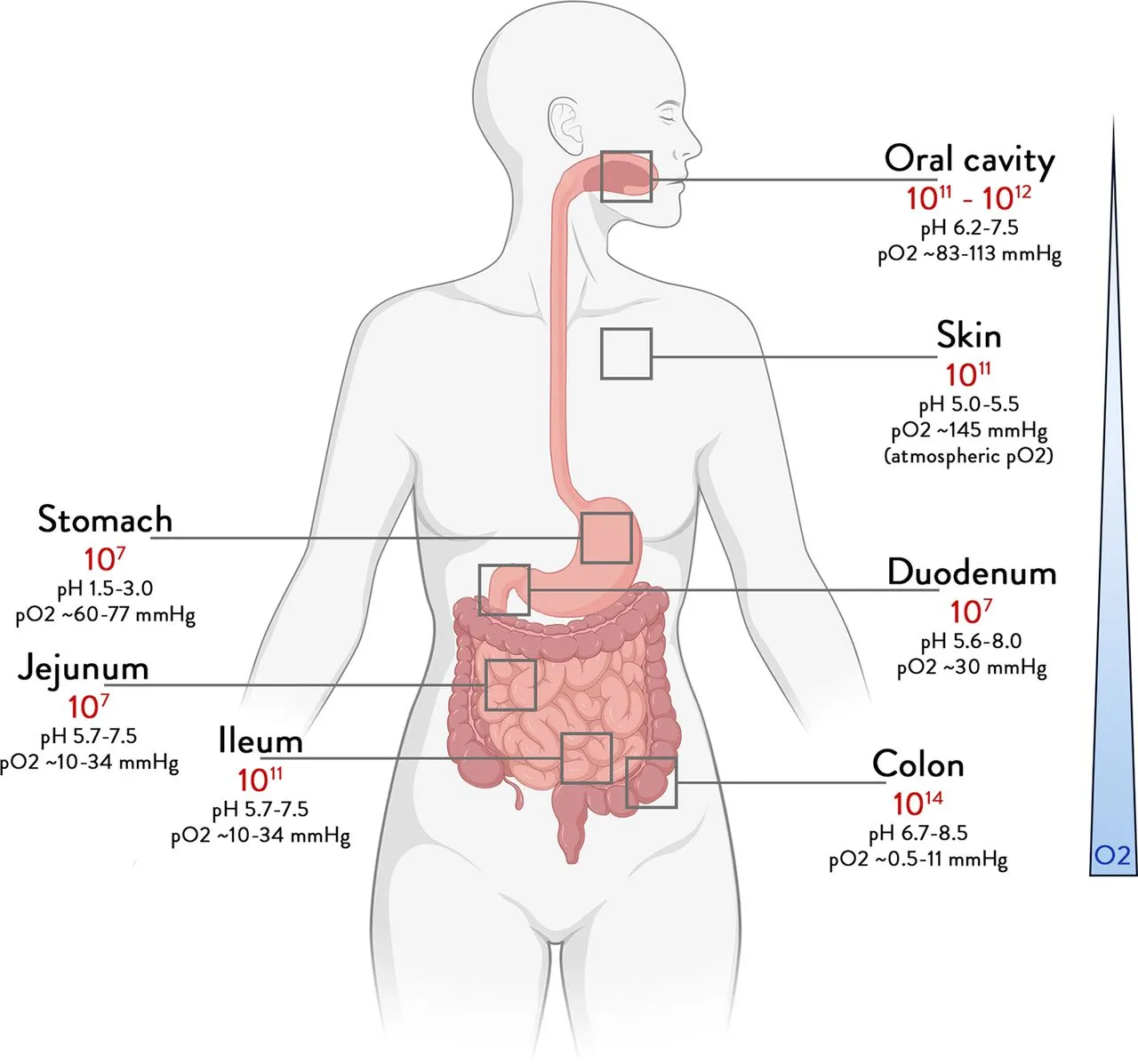
.jpg)
Figura 1: Abundância total de bactérias de acordo com os diferentes locais do corpo. Limites para o número de bactérias em diferentes órgãos, derivados de concentrações e volumes bacterianos. Imagem adaptada de Vos e colaboradores (2022).
> Associação entre a microbiota intestinal intestinal e doenças intestinais e extraintestinais
Diversos estudos relataram que a microbiota intestinal foi alterada na maioria dos distúrbios gastrointestinais específicos. As doenças inflamatórias intestinais foram associadas à uma composição anormal da microbiota intestinal, com relatos de crescimento de bactérias anaeróbicas e distúrbios de metabólitos, incluindo ácidos biliares (ABs), ácidos graxos de cadeia curta (AGCCs) e vias de acilcarnitina. A síndrome do intestino irritável, foi ligada a alterações específicas no subtipo de SII na microbiota intestinal, afetando especialmente o metabolismo de purinas. O câncer colorretal, o tumor mais prevalente no intestino inferior, foi fortemente associado a uma microbiota intestinal desregulada, incluindo certas bactérias, como Fusobacterium nucleatum, Escherichia coli ou Bacteroides fragilis. Doenças hepáticas crônicas, como a cirrose, mostraram mudanças profundas na microbiota, e estudos de intervenção com prebióticos, probióticos e antibióticos estabeleceram o seu papel nesses distúrbios. O adenocarcinoma pancreático também foi conectado a uma microbiota prejudicada, pois a sua composição afetou a resposta imunológica do hospedeiro e a evolução da doença.
A microbiota intestinal foi amplamente explorada nos últimos anos no contexto da obesidade e distúrbios associados, como diabetes mellitus tipo 2 (DT2) e doença hepática gordurosa não alcoólica (DHGNA). Diversos estudos relacionaram a alteração da microbiota com a obesidade, e intervenções com certas cepas bacterianas, como Akkermansia muciniphila, demonstraram impactos em fatores ligados à obesidade.
No DT2, variações na microbiota foram fortemente associadas à resistência à insulina, e vários estudos indicaram que essa alteração intestinal influenciou a regulação da glicose. A DHGNA foi vista como um exemplo paradigmático de distúrbio metabólico que se encontra na interseção da obesidade, síndrome metabólica e DT2. Há cada vez mais indícios de que a relação entre a microbiota, intestino e fígado desempenha um papel importante na DHGNA, especialmente em casos de fibrose e progressão para estágios avançados, como a esteatose hepática não alcoólica. Estudos recentes confirmaram que a DHGNA é marcada por um aumento em certas bactérias da família Enterobacteriaceae, incluindo E. coli, e uma diminuição na presença de F. prausnitzii.
A comunidade bacteriana presente no intestino desempenha um papel crucial na regulação de diversos aspectos dos distúrbios metabólicos. Essa regulação está ligada à produção de uma ampla gama de metabólitos e às suas interações com receptores presentes nas células do hospedeiro. Essas podem ativar ou inibir vias de sinalização, trazendo impactos positivos ou negativos para a saúde do hospedeiro.
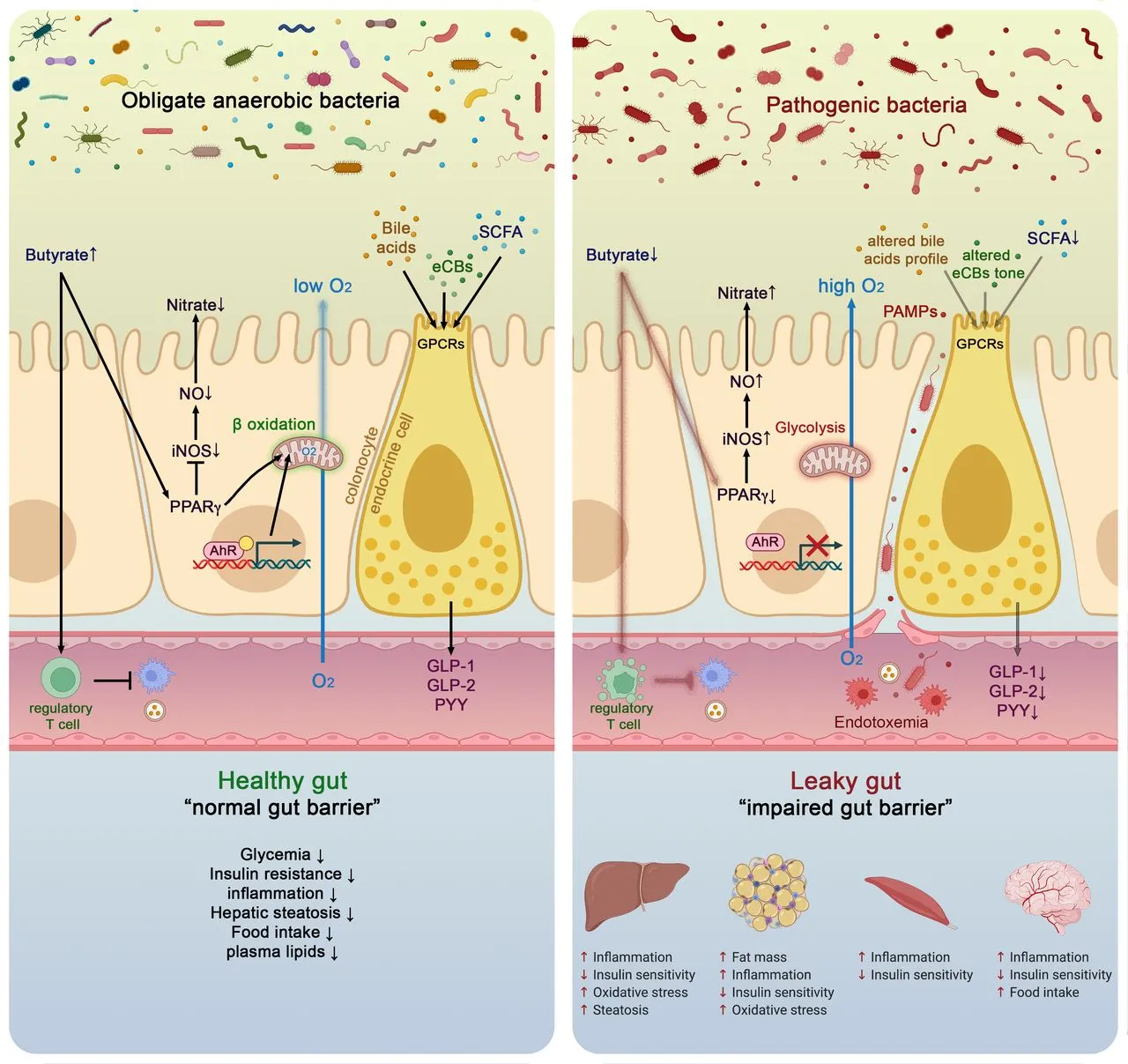
.jpg)
Figura 2: Mecanismos moleculares que ligam a microbiota intestinal e a saúde do hospedeiro em situações saudáveis e patológicas. Imagem adaptada de Vos e colaboradores (2022).
Os ácidos graxos de cadeia curta (AGCCs) estimulam a secreção de peptídeos intestinais ao atuarem em receptores específicos acoplados à proteína G presentes na superfície das células L enteroendócrinas, as quais são especialmente abundantes no íleo terminal e no cólon.
Os AGCCs são subprodutos resultantes da fermentação bacteriana de alimentos não digeridos no intestino grosso, como as fibras alimentares. Acetato, propionato e butirato são os principais ácidos graxos encontrados no cólon.
Além de suas funções e mecanismos de ação amplamente conhecidos, alguns AGCCs também podem desempenhar papéis diferentes do que se pensava anteriormente. Por exemplo, o butirato foi considerado uma fonte essencial de energia para a proliferação das células colônicas e para a manutenção da barreira intestinal. No entanto, evidências recentes indicaram que esse ácido graxo também exerce uma forte influência sobre a microbiota, interagindo com as células colônicas.
O butirato contribui para o controle das condições anaeróbicas no cólon ativando a ß-oxidação na mitocôndria. Ao ativar o receptor nuclear peroxisome proliferator-activated receptor gamma (PPARγ) nas células colônicas, limita a difusão de oxigênio dos colonócitos para a parte luminal, mantendo, assim, as condições anaeróbicas. A ativação do PPARγ também reprime a expressão do gene que codifica a sintase do óxido nítrico induzível, reduzindo, assim, a produção de óxido nítrico (NO) e, em última instância, os níveis de nitrato na luz intestinal, que são fontes de energia específicas usadas para a proliferação de possíveis bactérias anaeróbicas facultativas patogênicas (Enterobacteriaceae).
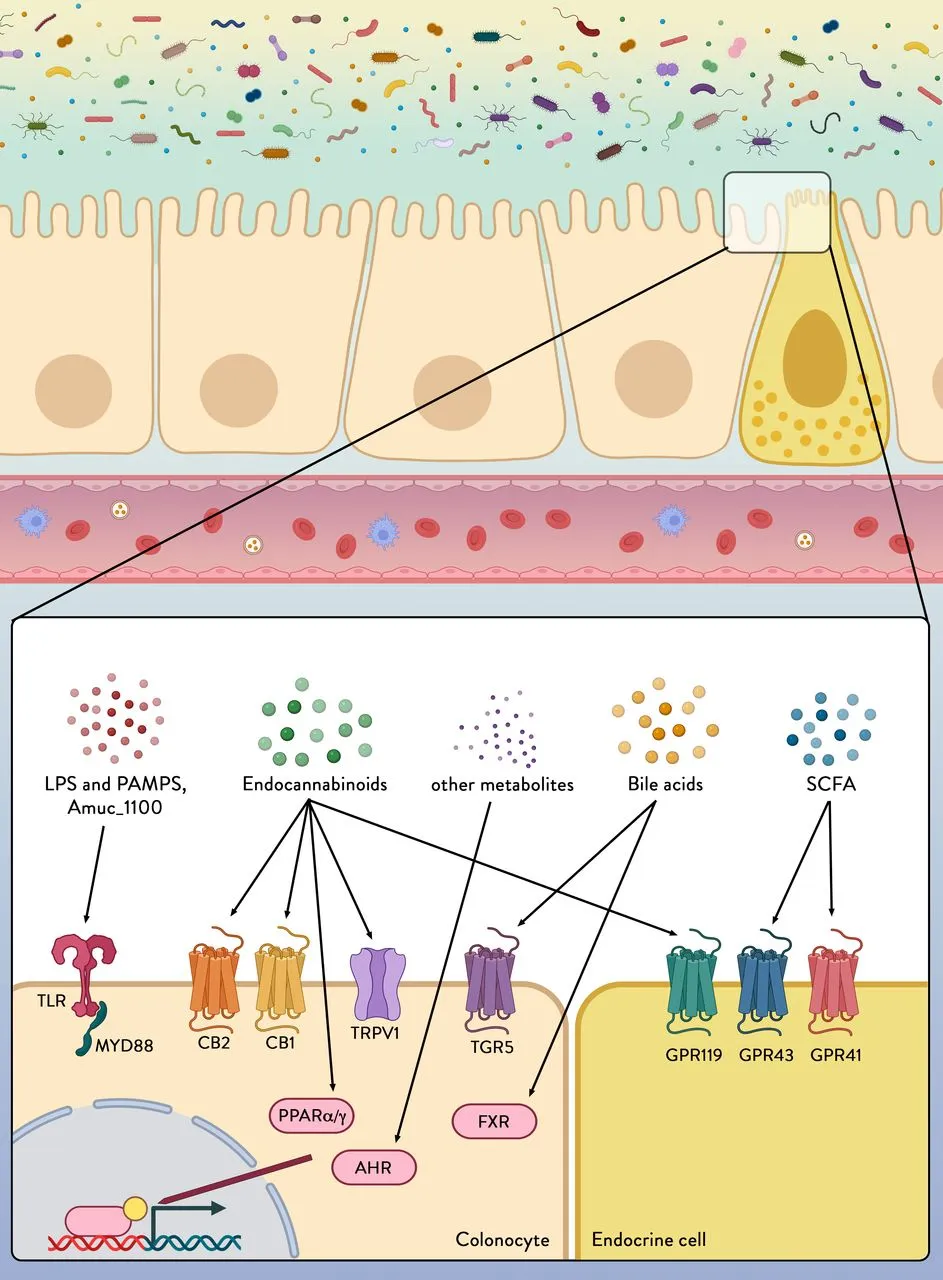

Figura 3: Os colonócitos e as células endócrinas expressam uma variedade de receptores capazes de detectar e transmitir sinais do ambiente microbiano. Imagem adaptada de Vos e colaboradores (2022).
Observações semelhantes foram registradas em humanos com inflamação intestinal severa, como ocorre em doenças intestinais inflamatórias, câncer, obesidade e diabetes, nos quais fora observado um aumento na presença de Enterobacteriaceae.
De maneira surpreendente, diversos estudos indicaram que todas essas doenças também estão correlacionadas com uma redução na quantidade de bactérias produtoras de AGCCs, especialmente propionato e butirato.
| Conclusão |
Ao longo das últimas duas décadas, significativos avanços foram realizados no campo da microbiota humana, evoluindo para conexões causais irrefutáveis da disbiose em certas doenças. A progressão da correlação para a causalidade continua a ser um passo crucial e necessário para aprimorar o desenho de intervenções baseadas na modulação da microbiota intestinal ou no uso de compostos ativos específicos.
Graças a inúmeros esforços e ao avanço nas análises, a comunidade científica está gradualmente se dirigindo à medicina personalizada, e a era da microbiota claramente integra uma parte essencial da mudança do paradigma no futuro da medicina e das abordagens nutricionais.