Introducción
El sueño está controlado por dos sistemas reguladores principales:
- Un sistema circadiano que controla la periodicidad de 24 horas (Proceso C).
- Un sistema homeostático (Proceso S) que garantiza la obtención de cantidades adecuadas de sueño.
Ambos procesos se alteran en pacientes críticos, potencialmente debido a la exposición a medicamentos que alteran el sueño (por ejemplo, propofol), la estructura del entorno de la unidad de cuidados intensivos (UCI) (por ejemplo, flujo de trabajo), agravación de un trastorno del sueño preexistente, y / o efectos de la enfermedad aguda (p. ej., sepsis).
Como resultado, los pacientes pueden experimentar delirio, mala función respiratoria y reactividad desregulada del sistema inmunitario.
Existen varios métodos para medir el sueño en la UCI, aunque todos presentan sus propios desafíos. Se han explorado varias terapias basadas en la intervención para mejorar el sueño de la UCI y las alteraciones del ritmo circadiano, incluidos los protocolos de reducción de ruido, la musicoterapia, el tratamiento de la luz y diferentes modos de ventilación mecánica. Estos estudios han tenido un éxito limitado.
Fisiología del sueño
El cerebro está activo durante el sueño. El sueño está regulado por varios centros en el tronco del encéfalo, el hipotálamo, el tálamo y el cerebro anterior. La participación y la regulación negativa del sistema de activación reticular ascendente (ARAS) es importante para la regulación del sueño y la vigilia e involucra a varios núcleos en los sistemas hipocretinérgico, GABAérgico, histaminérgico, adrenérgico y colinérgico.
Juntos, estos sistemas organizan el sueño en las fases principales del movimiento de movimientos oculares rápidos (REM) y el sueño no REM (NREM), descritos clásicamente por las Reglas de Rechtschaffen y Kales (reglas de R&K) [1]. El sueño NREM se divide en tres etapas: subniveles N1, N2 y N3. La subestación N3 se conoce como sueño de onda lenta (SWS) [1]. La arquitectura normal del sueño consiste en etapas que ocurren en ciclos de 90 a 120 minutos cada una [1, 2].
Los ritmos circadianos se refieren a las fluctuaciones autosostenidas con un período de aproximadamente (cira) 1 día (diem) en varios procesos fisiológicos. En los seres humanos, el sistema circadiano está compuesto por muchos relojes individuales específicos de tejidos, y su fase está controlada por el marcapasos circadiano maestro, el núcleo supraquiasmático (SCN) del hipotálamo.
El ritmo circadiano más evidente en los seres humanos es el ciclo sueño-vigilia. El SNC regula directamente varios sistemas de neurotransmisores que conducen o modulan el sueño, incluido el eje hipotálamo-pituitario-suprarrenal (HPA) y la melatonina de la glándula pineal.
Los genes del reloj circadiano identificados en los tejidos periféricos humanos hasta la fecha incluyen Period (Per-1-3), Cryptochrome (Cry-1 and Cry-2), Clock y Bmal1, que se coordinan con el marcapasos circadiano maestro [2].
Los factores externos que se denominan "cronometradores" o zeitgebers, como el ciclo de luz / oscuridad, interactúan con los relojes internos al sincronizar sus diferentes fases de oscilación. Los ritmos circadianos tienen una duración de aproximadamente 24 horas y pueden evaluarse mediante análisis cronobiológicos de las series temporales de melatonina, cortisol y temperatura.
Sueño alterado en la UCI
La arquitectura normal del sueño varía entre los individuos. Una etapa de sueño "normal" en un adulto joven sano podría ser: 2–5% N1, 45–55% N2, 3–15% N3 o SWS y 20–25% REM [3]. La transición normal de la activación de despertar a sueño ocurre dentro de los 10 a 20 min, y el primer período de REM ocurre típicamente dentro de los 90 a 120 min.
Aunque el tiempo total de sueño dentro de un período de 24 horas en la UCI es similar al de un individuo no hospitalizado, existen diferencias marcadas en la arquitectura del sueño.
Tanto como la mitad del sueño de un paciente crítico se produce durante las horas diurnas, con N1 y N2 que representan un porcentaje mayor del tiempo total de sueño. La duración y la frecuencia tanto del sueño SWS como del sueño REM se reducen, y las despertares frecuentes conducen a una alta fragmentación del sueño.
Los patrones alterados de sueño durante una estadía en la UCI tardan días en normalizarse y, en ciertos casos, pueden persistir después de la transferencia al piso / sala general.
En un estudio reciente de Wilcox et al. al caracterizar la calidad y la cantidad de sueño en los sobrevivientes de la UCI dentro de los 7 días posteriores al alta hospitalaria, aproximadamente dos tercios (61%) de los pacientes tenían trastornos persistentes del sueño. Además, los pacientes continuaron experimentando poco o nada de sueño SWS y / o REM, independientemente de factores externos (por ejemplo, la frecuencia de la medición de los signos vitales o el número de camas en la habitación).
Los pacientes críticamente enfermos experimentan una interrupción del ritmo circadiano probablemente secundaria a la ausencia de zeitgebers eficaces en el entorno de la UCI. Además, la inflamación sistémica también puede alterar la ritmicidad circadiana de los marcadores cronobiológicos.
En un estudio realizado por Haimovich et al., la administración de endotoxina intravenosa en voluntarios humanos alteró dramáticamente la expresión del gen del reloj circadiano en leucocitos de sangre periférica, lo que sugiere una desalineación de los relojes centrales y periféricos en la modulación de la respuesta inflamatoria.
Mundigler et al. evaluó la alteración circadiana en 17 pacientes sépticos, 7 pacientes no sépticos y 21 controles ingresados en una UCI. La 6-sulfatoxymelatonina (6-SMT) urinaria mostró una pérdida de la ritmicidad circadiana sin disminución durante el día en pacientes sépticos.
Recientemente, Li et al. Medición de los niveles plasmáticos de melatonina, factor de necrosis tumoral (TNF) -α, interleucina (IL) -6 y ARN mensajero de los genes circadianos Cry-1 y Per-2 durante 24 h en pacientes con UCI séptica y no séptica (n = 22). El ritmo circadiano alterado de la secreción de melatonina, la expresión reducida de Cry-1 y Per-2, y los niveles elevados de TNF-α e IL-6 se observaron en pacientes con sepsis.
Además, la expresión del gen circadiano periférico se suprimió independientemente de la ritmicidad de la melatonina, lo que confirma que, al menos en la fase aguda de la sepsis, hay un desacoplamiento del reloj maestro central y los genes del reloj periférico específico del tejido.
Mecanismos y sus consecuencias fisiológicas
Ciclo de luz-oscuridad
La luz se mide en unidades de lux. En un día soleado a principios de primavera, los niveles de luz varían de 32,000 a 60,000 lux. En la UCI, los niveles de luz diurnos informados varían desde los niveles de iluminación promedio de 30–165 lux; los niveles de luz nocturna varían de 2.4 a 145 lux; y durante los procedimientos (por ejemplo, inserción de línea central), los dispositivos de luz pueden entregar hasta 10,000 lux, lo que definitivamente puede alterar el ritmo circadiano de un paciente.
Se ha demostrado que diferentes estudios que modulan la exposición a la luz disminuyen el delirio incidente, posiblemente a través de un vínculo mecánico con la modulación del sueño.
Por ejemplo, la exposición nocturna a la luz disminuye la secreción de melatonina, una hormona secretada por la glándula pineal en respuesta a la oscuridad, que en última instancia puede resultar en la interrupción del sueño; la interrupción del ritmo circadiano observada en pacientes con sepsis grave (n = 7) se reflejó en las primeras 48 h de ingreso en la UCI por una variación diurna desordenada de la excreción urinaria de 6-SMT.
En modelos animales, la interrupción del ritmo circadiano debido a la exposición constante a la luz llevó a una expresión reducida de Per-2 en el SCN y los síntomas conductuales subsiguientes del delirio (es decir, disfunción ejecutiva y deterioro de la memoria).
Los síntomas clínicos se revirtieron con nobiletina, un potenciador conocido de la función Per-2. Se han informado hallazgos de trastornos diurnos en lesiones cerebrales traumáticas (LCT), traumatismos y poblaciones de pacientes médicos. Aún no se ha demostrado ninguna asociación entre la interrupción diurna y el resultado (por ejemplo, el uso de sedantes, la incidencia de delirio o la duración de la estadía) en estas poblaciones de pacientes.
Ruido en la UCI
Se ha informado que el ruido es un factor importante que contribuye a la alteración del sueño en la UCI. Las fuentes más comunes que contribuyen a la interrupción del sonido son las conversaciones del personal, las alarmas y las intervenciones de atención al paciente.
|
Experiencia sensoriomotora
Sedación
A diferencia del sueño natural que cumple una función biológica esencial, la sedación a menudo conduce a patrones de electroencefalograma (EEG) atípicos que no se observan con frecuencia en el sueño normal. Las benzodiazepinas y el propofol, ambos agonistas del GABA, se usan con frecuencia para la sedación en pacientes críticamente, y las directrices actuales recomiendan el propofol como agente de primera línea.
La administración de benzodiazepinas produce una disminución de la latencia del sueño, pero afecta negativamente a la arquitectura del sueño, disminuyendo las etapas de sueño del SWS y REM.
El propofol también es un potente supresor de SWS y en dosis altas puede inducir la supresión de la rotura de EEG.
Los opioides, comúnmente administrados junto con los sedantes en pacientes críticos, se unen a los receptores μ de la vía de activación ponto-tálamica, una vía clave en la generación REM. De una manera dependiente de la dosis, los opioides pueden suprimir tanto SWS como REM [17].
En un estudio observacional (n = 21) de pacientes con UCI médica ventiladas mecánicamente sobre sedación y analgesia intravenosas, se observó una desorganización temporal pronunciada y una escasez de hallazgos de EEG de sueño normal. Aunque el ritmo circadiano se conservó en este estudio, los pacientes mostraron un retraso de fase en su excreción de 6-SMT urinario, lo que sugiere que sus marcapasos circadianos funcionaron libremente.
La dexmedetomidina es uno de los agentes de sedación más recientemente introducidos en la UCI. Es un potente y altamente selectivo agonista α-2-adrenérgico, con la acción de la sedación dependiente de la dosis, anti-ansiolisis y analgesia adjunto. Se ha demostrado que la dexmedetomidina crea más sueño natural que otros agentes agonistas de GABA.
En dos estudios piloto pequeños, un estudio demostró una mejora en la eficiencia del sueño y el tiempo de sueño en la noche con dexmedetomidina y otro estudio también demostró una mejora en la eficiencia del sueño y el sueño en la etapa 2, así como una modificación del patrón de sueño, cambio del sueño (es decir, más de 75% del tiempo total de sueño) a las horas de la noche. Recientemente, se descubrió que la dexmedetomidina nocturna en dosis bajas reduce la incidencia de delirio en la UCI, sin afectar la calidad del sueño informada por el paciente.
Numerosas preguntas pendientes permanecen en la investigación de la interacción entre el sueño, el ritmo circadiano y los sedantes en la UCI. Los esfuerzos realizados hasta la fecha se han centrado en minimizar la administración de estos agentes, mientras que las investigaciones mecanicistas están en curso.
Uso de restricciones físicas
Las condiciones encontradas por un paciente en la UCI podrían parecerse a las creadas deliberadamente para experimentos de privación sensorial y perceptiva. El uso de restricciones físicas priva a los pacientes de una interacción sensorial normal con su entorno.
Se demostró que la inmovilización de brazos a corto plazo en voluntarios sanos reduce la actividad sináptica local en áreas sensoriomotoras, lo que sugiere que la plasticidad cortical puede estar relacionada con la regulación local del sueño.
Un estudio que explore el impacto de las restricciones físicas en la cantidad y calidad del sueño ayudaría a informar las recomendaciones de cuidado.
Ventilacion mecanica
Las alteraciones del sueño en pacientes con ventilación mecánica son claves; sin embargo, la interacción entre el sueño y la ventilación mecánica es compleja. Existe un vínculo fisiopatológico entre la interacción paciente-ventilador y las alteraciones del sueño directamente o por la necesidad de dosis más altas de medicamentos sedantes.
Además, las perturbaciones del sueño en sí mismas y el delirio incidental, posiblemente debido a la necesidad de una mayor sedación, pueden conducir a un ciclo prolongado de destete y a una mayor duración de la ventilación mecánica.
Sistema inmune
La melatonina, además de mediar los efectos del fotoperíodo, también desempeña un papel importante en la respuesta adaptativa de un organismo. Los estudios experimentales han demostrado que la unión de la melatonina a receptores específicos en las células T colaboradoras T del tipo 1 activadas por antígeno (Th-1) aumenta la producción de citoquinas proinflamatorias y mejora la fagocitosis y la presentación de antígenos.
Los modelos animales han demostrado un efecto protector de la melatonina contra la encefalitis viral letal, la hepatitis infecciosa y el shock hemorrágico o séptico; se ha demostrado que inhibe el TNF-α y que reduce los niveles de IL-6 después de la descarga, la producción de superóxido en la aorta y la sintasa de óxido nítrico inducible (iNOS) en el hígado, lo que previene el choque circulatorio inducido por endotoxinas.
Se ha encontrado que los patrones alterados de iluminación en la UCI eliminan la regulación fisiológica de la secreción de melatonina en respuesta a la oscuridad y la luz; esta vía está directamente vinculada a la respuesta inflamatoria y posiblemente a la mortalidad.
Nutrición
Si bien las directrices recomiendan que la nutrición enteral se inicie dentro de las 24 a 48 h en el paciente crítico, no existe una recomendación específica sobre el momento de la entrega de la nutrición (por ejemplo, las horas diurnas en comparación con las alimentaciones continuas de 24 h).
Los osciladores circadianos periféricos son sensibles a los estímulos asociados con la ingesta de alimentos, lo que permite a los animales desacoplar los ritmos de comportamiento y fisiología de los ciclos de luz-oscuridad y, en cambio, alinearlos con las comidas predecibles.
Según nuestra experiencia, la práctica actual en la UCI es administrar los alimentos, según lo tolerado, durante un período de 24 horas con múltiples interrupciones durante el día para procedimientos (por ejemplo, broncoscopia), administración de medicamentos (por ejemplo, levotiroxina) o pruebas radiográficas.
Puede ser razonable considerar la restricción de los alimentos a las horas del día para ayudar en el reentrenamiento del SCN. Actualmente, la literatura está preparada para una encuesta de las prácticas de la UCI sobre el momento de la alimentación (por ejemplo, durante el día, las 24 horas), ya que esta información puede ayudar a informar la mejor manera de estudiar el impacto de la distribución de la nutrición en la interrupción del ritmo circadiano en la UCI.
Delirio y otras secuelas neuropsicológicas
Los estudios han encontrado una correlación entre la privación del sueño y los cambios en el estado mental en la UCI.
El delirio se caracteriza por la falta de atención, el estado mental fluctuante, el pensamiento desorganizado y un nivel alterado de conciencia, hallazgos que también son características de la privación del sueño. Los trastornos del sueño son comunes en pacientes delirantes.
Si bien la privación del sueño se considera un factor de riesgo potencialmente modificable para el desarrollo del delirio, también es posible que el delirio en sí contribuya a trastornos del sueño experimentados. Los estudios realizados principalmente en pacientes quirúrgicos cardíacos indican que la falta de sueño puede causar, ser el resultado de o simplemente reducir el umbral para la transición al delirio. Se ha hipotetizado que la disminución del sueño SWS y el sueño REM contribuyen al desarrollo del delirio.
Un estudio reciente de pacientes de UCI demostró una asociación entre el delirio y la reducción severa del sueño REM (<6% del tiempo total de sueño), sin embargo, no se estableció claramente una relación causal. La asociación entre la alteración del sueño y el delirio no está clara, pero es posible que su relación comparta una vía patofisiológica común.
Existe evidencia considerable que relaciona los trastornos respiratorios relacionados con el sueño y la mala calidad del sueño con el deterioro cognitivo en muchas poblaciones de pacientes. Los dominios cognitivos particularmente asociados con la interrupción del sueño incluyen la memoria de trabajo, la memoria semántica, la velocidad de procesamiento y las capacidades visuoespaciales.
Los estudios experimentales apoyan una serie de mecanismos neurobiológicos potenciales, incluida la acumulación de beta-amiloide, anomalías de laproteína tau, anomalías sinápticas, cambios en la potenciación a largo plazo del hipocampo, neurogénesis del hipocampo alterada y cambios en la expresión génica.
Pocos estudios han evaluado rigurosamente la prevalencia de la interrupción del sueño después de una enfermedad crítica y su posible papel en la potenciación del deterioro cognitivo. Una revisión sistemática reciente realizada por Altman y sus colegas informó sobre 22 estudios que examinaron el sueño después del alta hospitalaria en sobrevivientes de enfermedades críticas; sin embargo, ninguno de estos estudios informó resultados cognitivos.
A pesar de que los trastornos del sueño mejoraron con el tiempo, hasta dos tercios (61%) de los pacientes informaron persistentemente mal dormir a los 6 meses de seguimiento. Los análisis de los factores de riesgo para los trastornos del sueño han tenido resultados contradictorios, pero los trastornos persistentes del sueño se asociaron sistemáticamente con comorbilidades psicológicas posteriores al alta y con una calidad de vida deficiente.
El riesgo de desarrollar morbilidad psicológica después del alta de cuidados intensivos es tan alto como 60%. La morbilidad psicológica incluye depresión, ansiedad y trastorno de estrés postraumático.
Numerosos estudios de seguimiento han demostrado una asociación entre los síntomas depresivos y el aumento de los niveles de fatiga, estrés y ansiedad en participantes sanos sujetos a restricción de sueño.
El mecanismo subyacente entre el sueño, la interrupción del ritmo circadiano y la depresión no se comprende bien; se ha teorizado que la generación de trastornos del sueño y de la salud mental comparten mecanismos neuronales que se superponen, de modo que los defectos en estas vías endógenas dan como resultado patologías en ambos comportamientos.
El sueño y la interrupción del ritmo circadiano después de una enfermedad crítica pueden contribuir a trastornos psicológicos posteriores a la UCI, como la depresión; los riesgos asociados pueden ser difíciles de entender, dadas las complejidades de las condiciones comórbidas preexistentes y las exposiciones en la UCI (por ejemplo, la sedación).
Esfuerzos para mejorar la calidad del sueño en la UCI
Varios estudios han evaluado las intervenciones dirigidas a la optimización del sueño en la UCI, incluidos los paquetes de sueño no farmacológicos, la terapia de luz brillante, los tapones para los oídos, la terapia farmacológica, las técnicas de relajación y los diferentes modos de ventilación mecánica, con resultados mixtos.
Si bien es probable que un programa exitoso de mejora del sueño tenga que abordar factores internos y externos que perturban el sueño en la UCI, ningún estudio ha demostrado su eficacia como intervención (Fig. 1).
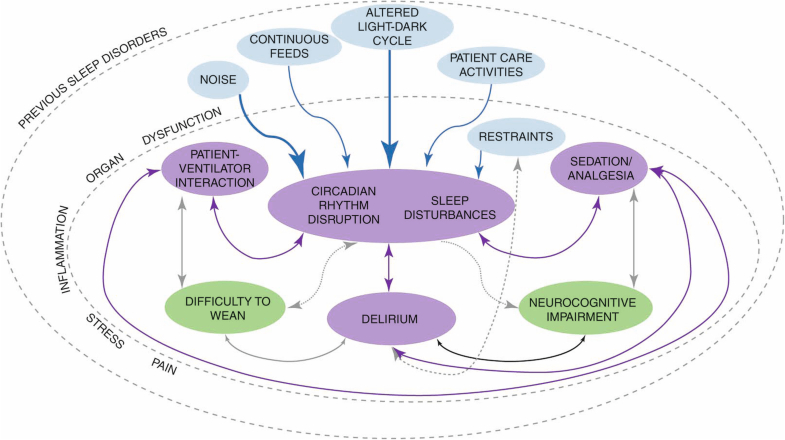
Determinantes y consecuencias fisiológicas del sueño y las interrupciones del ritmo circadiano en la unidad de cuidados intensivos (UCI). Se muestra la interacción entre los determinantes (azul claro) y las posibles consecuencias (verde claro) del sueño y las interrupciones del ritmo circadiano. Curiosamente, la mayoría de las interacciones son bidireccionales, lo que significa que los determinantes pueden predisponer al paciente a tales trastornos y ser una consecuencia de ellos. Se muestra una relación íntima entre el sueño, la interrupción del ritmo circadiano y el delirio (púrpura). Las principales interacciones están representadas por flechas más gruesas y continuas. Las interacciones más complejas y menos probadas tienen flechas discontinuas. La mayoría de los determinantes están modificados por factores relacionados con el proceso de la enfermedad, como el dolor, la inflamación y la disfunción del órgano terminal. Además, muchos pacientes ingresados en la UCI tienen trastornos previos del sueño, lo que probablemente aumentará el riesgo de tenerlos en la UCI.
El uso generalizado de un protocolo de sueño específico de la UCI requeriría un compromiso sustancial por parte del centro individual para su implementación. Es probable que la precipitación de tal cambio cultural requiera la demostración de un beneficio de resultado sustancial que justifique un cambio en el flujo de trabajo de larga data y los hábitos de provisión de atención.
Reducir el impacto ambiental en el sueño
Como la duración, la intensidad y la longitud de onda de un estímulo luminoso modulan el ritmo circadiano a través del reloj circadiano central, tiene sentido intuitivo intentar restaurar la desorganización temporal de los marcapasos circadianos mediante la modulación de la exposición a la luz en la UCI.
Un estudio de intervención aleatorizado de un solo centro (n = 11) que evaluó dos exposiciones a la luz diferentes en pacientes postoperatorios con cáncer de esófago, mostró que los sujetos que recibieron luz más intensa tenían delirio incidental más bajo. Además, en un estudio prospectivo multicéntrico de 523 pacientes no intubados, la incidencia de delirio se redujo en las personas expuestas a la luz solar visible en su habitación de hospital.
Sin embargo, en contraste, un gran estudio de pacientes de UCI médicos (n = 3577) expuestos a diferentes niveles de luz ambiental, con una diferencia de aproximadamente tres veces mayor en los niveles de luz media debido a diferentes orientaciones de la habitación (orientada al sur 399.2 ± 146 lux en comparación con la orientación este) salas 30,6 ± 1,3 lux), no hubo diferencias asociadas en el uso de sedantes, analgésicos o neurolépticos, lo que sugiere que no hay impacto en la incidencia de delirio.
A la inversa, en un pequeño estudio prospectivo en un solo centro de pacientes ancianos ingresados ??por enfermedades agudas cardíacas, respiratorias o renales (n = 10), las disminuciones en los umbrales de iluminación nocturna llevaron a una resincronización progresiva del ritmo circadiano. Los ritmos circadianos se modificaron severamente durante las primeras 24 h, pero se volvieron a sincronizar progresivamente el día 5.
Los efectos de las estrategias de reducción de ruido en el sueño en la UCI siguen siendo controvertidos. Demoule et al. encontró que en pacientes con UCI no sedados, agregar tapones para los oídos y máscaras para los ojos a la atención estándar redujo la ansiedad y mejoró la calidad del sueño, reduciendo específicamente los despertares prolongados y aumentando la duración del SWS.
Los efectos beneficiosos de la reducción del ruido pueden limitarse a la etapa temprana de ingreso en la UCI. Las limitaciones de estos estudios incluyen tamaños de muestra pequeños, falta de medidas estándar y diseño de estudio antes y después. Se necesitan ensayos bien diseñados de intervenciones ambientales con tamaños de muestra adecuados.
Consideraciones farmacológicas
La terapia farmacológica para el sueño y la interrupción del ritmo circadiano incluye una revisión cuidadosa de los tratamientos farmacológicos existentes, incluida la omisión de medicamentos crónicos que pueden llevar a la sintomatología de abstinencia.
Como muchos de los medicamentos administrados en la UCI tienen efectos sobre la fisiología normal del sueño, si no se pueden suspender medicamentos como los opioides o los sedantes, su administración debe limitarse a una dosis mínima efectiva.
Los medicamentos que se usan específicamente para los trastornos agudos del sueño deben usarse por períodos cortos con una reevaluación continua de la necesidad. Además, cualquier medicamento recetado para dormir debe ir acompañado de intervenciones no farmacológicas (por ejemplo, movilización durante el día e intentos de mantener la vigilia durante el día). Aunque los medicamentos para los trastornos agudos del sueño pueden aumentar el tiempo total de sueño, es posible que no mejoren la calidad del sueño.
Como ejemplo, un pequeño ensayo controlado aleatorio pudo demostrar que los pacientes que recibieron 10 mg de melatonina oral en comparación con el placebo demostraron una mejora en la eficiencia del sueño nocturno según lo medido con BIS. Los análisis farmacocinéticos sugirieron que la dosis de 10 mg era demasiado alta y que se podrían usar 1 a 2 mg de melatonina en estudios futuros. Los estudios de melatonina, sueño y delirio están en curso.
Ventilacion mecanica
La ventilación mecánica representa otra causa potencial importante de la interrupción del sueño. Se ha demostrado que la reducción de la asincronía del paciente y el ventilador mediante la optimización de la configuración ventilatoria mitiga el impacto de la ventilación mecánica en el sueño.
Se ha logrado mejorar la eficiencia del sueño ya sea limitando la cantidad de soporte ventilatorio o alterando los modos de ventilación (por ejemplo, ventilación de asistencia proporcional o modos de asistencia de ventilación ajustados neutralmente).
Sorprendentemente, pocos estudios han examinado el efecto de la hora del día en la ventilación por minuto. Recientemente, los pacientes traqueostomizados difíciles de destetar se reconectaron al ventilador por la noche para mejorar la eficiencia del sueño.
Se sabe que el calibre de la vía aérea varía en seres humanos sanos a lo largo de un período de 24 horas. En los asmáticos, la obstrucción del flujo de aire tiende a empeorar temprano en la mañana, lo que corresponde a los cambios circadianos en la función pulmonar y la abundancia de células inmunitarias en las vías respiratorias. Poco se sabe acerca de cómo el reloj molecular controla la función fisiológica de los pulmones y cómo su interrupción podría influir en la mecánica respiratoria durante los procesos de ventilación o destete.
Conclusión
- Existen interacciones complejas entre los factores fisiológicos, de comportamiento y ambientales que contribuyen al sueño y las alteraciones del ritmo circadiano en pacientes de UCI.
- Poco se sabe sobre los mecanismos exactos que conducen a estas interrupciones o la importancia de cada factor individualmente en la perturbación experimentada del sueño.
- La relación entre el sueño, el ritmo circadiano y el resultado después de una enfermedad crítica requiere un estudio adicional. Además, la medición de la cantidad y calidad del sueño es
técnicamente difícil, lo que crea más desafíos para delinear las relaciones.
- Los esfuerzos hasta la fecha se han centrado en estrategias no farmacológicas y farmacológicas para mejorar el sueño, con algunos resultados prometedores; sin embargo, para una implementación más amplia es necesario que ocurra un cambio en la cultura.
- Se ha prestado menos atención a la comprensión de los mecanismos biológicos subyacentes del sueño perturbado y la alteración circadiana.
- Diseñar intervenciones basadas en principios biológicos básicos podría resultar más eficaz para mejorar el sueño en la UCI.
- Sin pruebas sólidas de beneficios para facilitar los cambios en la práctica, la implementación de paquetes de mejoras específicas para el sueño será un desafío.
 Según la Organización Mundial de la Salud, los niveles de sonido no deben superar los 30 decibelios ponderados A (dBA).
Según la Organización Mundial de la Salud, los niveles de sonido no deben superar los 30 decibelios ponderados A (dBA).