≈ Introducción
Los grandes descubrimientos han cambiado la comprensión de la enfermedad de Parkinson (EP) y sus determinantes. Si bien los estudios genéticos han revelado la heterogeneidad de la EP y proveyó más conocimientos sobre su patogénesis y etiología, las investigaciones epidemiológicas han proporcionado evidencia de que los factores conductuales y ambientales representan un papel clave en la patogénesis y la progresión de la enfermedad.
Esta evidencia se ve reforzada y complementada por haber observado que el 90% de los casos no tiene ninguna causa genética identificable, y que muchos factores asociados con un riesgo alterado de EP poseen propiedades neuroprotectoras o neurotóxicas en los modelos animales de la enfermedad.
Debido a que la mayoría de los estudios epidemiológicos no distingue A la EP idiopática de la EP debida a mutaciones genéticas, y basados más en criterios clínicos que en criterios diagnósticos patológicos, de aquí en adelante los autores se refieren a la EP sin más especificación, entendiendo que las conclusiones impulsadas por la definición de EP esporádica más comúnmente definida desde el punto de vista clínico, podría no aplicarse a las formas monogenéticas, y pueden estar afectadas por la exactitud del diagnóstico clínico, que típicamente es solo del 80-90% cuando se compara con los hallazgos patológicos.
Esta revisión se basa principalmente en estudios realizados dentro de cohortes bien definidas de individuos sin EP que han proporcionado muestras biológicas o información sobre las exposiciones de interés en el momento del reclutamiento, y luego fueron seguidos prospectivamente para detectar la ocurrencia de la EP de reciente diagnóstico; esta Incluye estudios de control de casos anidados dentro de estas cohortes. La validez de estas investigaciones requiere información precisa sobre las exposiciones y factores de confusión potenciales y sus cambios en el tiempo, la duración e integridad del seguimiento y la averiguación de la EP y su diagnóstico correcto.
Las debilidades de uno o más de estos aspectos son comunes y por lo tanto la comprensión de los factores de riesgo requiere una evaluación de cada investigación y la exploración de posibles explicaciones alternativas de los resultados reportados.
La mayor disponibilidad de grandes bases de datos electrónicas ha proporcionado una fuente adicional de información de datos epidemiológicos, que son particularmente útiles para investigar la relación entre los medicamentos recetados y otros eventos (por ej., el traumatismo craneano) y el riesgo de EP, pero carecen de información precisa sobre los factores de confusión y las fechas de comienzo de la enfermedad.
La fecha de inicio de la enfermedad suele ser equiparada a la a fecha del diagnóstico o del primer tratamiento de la EP, que en algunos individuos puede ser años después del comienzo de los síntomas. Teniendo en cuenta estas limitaciones, los autores se han referido a estos estudios para complementar la inferencia que podría hacerse de cohortes prospectivas.
► Epidemiología descriptiva de la enfermedad de Parkinson. Las diferencias metodológicas dificultan las comparaciones de la incidencia de la EP en todos los estudios. Sin embargo, se pueden hacer algunas inferencias. La EP es la segunda enfermedad neurodegenerativa (después de la enfermedad de Alzheimer), con una tasa de incidencia media anual estandarizada por edad en países de altos ingresos de 14/100.000 habitantes de la población total y 160/100.000 personas ≥65 años.
Quizá una medida más interpretable que la frecuencia de la enfermedad sea el riesgo durante toda la vida que fue estimado en 2% para los hombres y 1,3% para las mujeres, para los individuos de 40 años en EE. UU., teniendo en cuenta los riesgos competitivos (por ej., muerte por otras causas como las enfermedades cardiovasculares o el cáncer).
La prevalencia de la EP, que refleja tanto la incidencia como la mortalidad, parece ser más baja en África que en Europa y las Américas. La incidencia en Asia es similar a la de estas dos últimas. Los datos sobre la incidencia por raza o etnia son escasos e inconsistentes. En un estudio realizado en Nueva York se halló mayor incidencia entre las personas de raza negra que en las de raza blanca, mientras que en los participantes de una gran organización de salud de EE. UU. la incidencia más elevada de EP ajustada por la edad y el sexo fue entre los hispanos (16,6/100.000 personas), seguida por las personas de raza blanca no hispanas (13,6), asiáticos, (11,3) y personas de raza negra (10,2).
En un estudio basado en los beneficiarios de Medicare de EE. UU. se halló mayor incidencia en las personas de raza blanca que en las de raza negra o asiáticos. Una disminución anual del 6% en el aumento de la EP desde 1999 a 2009 en el Reino Unido fue atribuida al mejor diagnóstico de los diferentes ´síndromes parkinsonianos, ya que la incidencia global del parkinsonismo se mantuvo constante. En contraste, tanto el parkinsonismo como la EP disminuyeron entre la década de 1990 y 2000-10 en Rotterdam, Países Bajos, y aumentaron desde 1976 a 2005 en Minnesota, EE.UU.
La incidencia de EP es baja antes de los 50 años pero aumenta rápidamente con la edad, llegando en la mayoría de los estudios a los 80 años, probablemente debido al subdiagnóstico con el aumento de la edad. Es probable que la disminución espuria de la incidencia de EP con el aumento de la edad ocurra debido a la prevalencia creciente de demencia, la cual, cuando se presenta en el momento del inicio de los síntomas motores, es un criterio de exclusión para el diagnóstico de la EP. El cociente de la incidencia hombre:mujer (H:M) oscila entre 1,3 y 2.0 en la mayoría de los estudios, pero se han observado tasas tan bajas como 0,95 en Asia, posiblemente como reflejo de las diferencias sexuales en el tabaquismo.
≈ Factores de riesgo
► Productos lácteos
El riesgo de EP aumenta en los Individuos con un consumo elevado de leche y lácteos. En un metaanálisis de los resultados de Nurses’ Health Study y del Health Professionals Follow-up Study (HPFS); el Honolulu-Asia Ageing Study (HAAS) y el Cancer Prevention Study II Nutrition mostraron un riesgo relativo (RR) de EP de 1,6 comparando la categoría de mayor consumo de lecha con la de menor consumo de leche.
Ni la vitamina D (agregada a la leche en EE. UU) ni la ingesta de calcio explicaron esta asociación. Una asociación positiva para el consumo de leche, también en la cohorte de la Finnish Mobile Clinic y el consumo de leche y otros productos lácteos en la cohorte del European Prospective Investigation into Cancer and Nutrition-Greece.
Un metaanálisis actualizado que incluyó todos los estudios anteriores avaló una asociación entre la ingesta elevada de productos lácteos y el riesgo de EP, que fue mayor en los hombres que en mujeres. La asociación inversa entre el consumo de leche y la densidad neuronal en la sustancia negra entre los no fumadores de la cohorte del HAAS.
En el mismo estudio, la detección de residuos de heptacloro-epóxido, más comúnmente en el cerebro de los que bebieron más leche comparados con los que no bebían leche, mostró que este contaminante podría ser una causa relacionada con el riesgo de EP. Aunque la posibilidad de que un contaminante de la leche intervenga en la asociación entre el consumo de lácteos y el riesgo de EP no pueda excluirse, en general los resultados de múltiples cohortes y países son más consistentes con el aumento del riesgo de EP asociado con los efectos de la disminución del urato de los productos lácteos.
≈ Plaguicidas
La hipótesis de que la exposición a los plaguicidas y otros químicos ambientales aumenta el resigo de EP fue sugerida por el descubrimiento de los efectos neurotóxicos de un metabolito de 1-metil, -4-fenil-1,2,3,6-tetra hidropiridina (MPTP), que en el cuerpo se convierte a una molécula pro-parkinsoniana, con una estructura similar al herbicida paraquat. En la cohorte HAAS, el riesgo de EP aumentó con la mayor duración del trabajo en las plantaciones (RR 1,9 para ≥20 años vs. ninguno) y, aunque de manera no significativa, con la exposición autonotificada a los plaguicidas.
En Francia se halló una asociación positiva no dependiente de la dosis entre la exposición a los plaguicidas─estimada a través de un modelo exposición laboral─y el riesgo de EP. En la cohorte del CPS-IIN, la exposición a los plaguicidas en 1982, que fue autorreportada por el 6% de los participantes, se asoció con una duplicación del riesgo de EP después de 1992; no se halló asociación para la exposición a otros 11 productos químicos.
En el Agricultural Health Study, el riesgo de EP aumentó uniformemente con el mayor número de días de exposición a los plaguicidas; El RR fue 2,3 durante más de 397 días vs. menos de 64 días de exposición durante toda la vida. En una investigación prospectiva de Finlandia, las concentraciones sanguíneas de plaguicidas organoclorados (los únicos plaguicidas para los que una sola concentración de sangre proporciona una medida razonable de la exposición a largo plazo) no se asociaron al riesgo de EP, lo que indica que son otras clases de plaguicidas las que aumentan el riesgo de EP.
En el Agricultural Health Study se hallaron asociaciones positivas entre el riesgo de enfermedad y la exposición a plaguicidas que se sabe afectan el complejo mitocondrial I (incluida la rotenona) o causan estrés oxidativo (incluyendo el paraquat) . En general, la evidencia de que la exposición a plaguicidas aumenta el riesgo de EP es importante, pero sigue siendo incierto cuál es el riesgo asociado de compuestos específicos.
≈ Metanfetamina
La metanfetamina se une al transportador de la dopamina presináptica aumentando así las concentraciones de dopamina extracelular, y en animales experimentales daña las neuronas dopaminérgicas de la substancia negra produciendo cambios patológicos similares a los observados en el cerebro de los pacientes con EP. En dos estudios se halló una asociación entre el uso de anfetaminas o metanfetaminas y el riesgo de EP.
Los fumadores tienen un riesgo marcadamente reducido de EP
≈ Cáncer
Ha quedado documentado que existe un riesgo mayor de EP entre los Individuos con melanoma. En un gran estudio danés que incluyó más de 8.000 pacientes con EP, el diagnóstico de melanoma se asoció a un riesgo 44% mayor de desarrollar EP. Asociaciones similares fueron reportadas en un estudio nacional en Suecia. Por otra parte, se ha reportado un riesgo más elevado de melanoma en Individuos con EP temprana (generalmente definida como EP en los 5 años siguientes al diagnóstico y con síntomas no suficientemente graves como para un tratamiento dopaminérgico) enrolados en estudios aleatorizados.
La causa subyacente de estas asociaciones positivas todavía se desconoce. Un factor de riesgo compartido por la EF y el melanoma es el color del pelo (el riesgo de ambos aumenta desde el negro hasta el castaño, rubio y rojo). El hallazgo de un aumento del riesgo de EP entre los individuos con antecedentes familiares de melanoma sugiere una predisposición genética común, pero las asociaciones entre los alelos del pelo rojo o el riesgo de melanoma y la EP no han sido probadas, y los alelos conocidos de susceptibilidad a la EP parecen no estar relacionados con el riesgo de melanoma. Por otra parte, en un estudio nacional no hubo un aumento del riesgo de melanoma entre los hermanos de pacientes con EP.
Otros factores de riesgo comunes o biomarcadores de la EP y el melanoma incluyen el tabaquismo (inverso), la cafeína (inverso) y los telómeros más cortos (inverso).
Debido a que los fumadores tienen un riesgo marcadamente reducido de EP, los cánceres relacionados con el EP tienden a estar inversamente asociados. Los datos sobre la relación entre los cánceres no relacionados con el tabaco y el riesgo de EP son inconsistentes, aunque una revisión mostró que la reducción general del riesgo de cáncer en las personas con EP no está completamente explicada por el tabaquismo.
≈ Lesión cerebral traumática
Las lesiones cerebrales traumáticas pueden causar alteración de la barrera hematoencefálica, inflamación cerebral prolongada, alteración de la función mitocondrial, mayor liberación de glutamato y acumulación de α-sinucleína en el cerebro, todo lo cual podría contribuir a una mayor Incidencia de EP luego de este tipo de lesión. Sin embargo, los resultados de varias investigaciones sugieren que el riesgo de EP parece aumentar enseguida después de una lesión cerebral traumática, pero gradualmente disminuye con el tiempo.
En un estudio danés de 13.000 casos de EP, el RR de la enfermedad después de la concusión fue 6,6, dentro de los 3 meses siguientes a la lesión; 1,9 entre 4 y 12 meses; 1,8 entre 1 y 4 años; 1,4 entre 5 y 9 años; después de 10 años de cualquier tipo de lesión craneana no hubo aumento del riesgo de EP. En un estudio similar realizado en Suecia sobre 18.000 casos de EP, el RR para la enfermedad fue 3,34 dentro de los 12 meses tras una hospitalización por lesión cefálica, pero disminuyó a 1,28 en 1-4 años; 1,18 en 5-9 años y 1,17 después de 10 años.
Probablemente, el aumento del riesgo de EP en ambos estudios pueda explicarse por la mayor frecuencia de caídas y traumas craneanos en individuos con EP temprana (causalidad inversa), pero es difícil establecer si existe un aumento del riesgo de EP a largo plazo. Un estudio danés comprobó que muchos pacientes tienen síntomas de EP varios años antes del registro de su diagnóstico y que la primera prescripción farmacológica para la EP a menudo precedió a la fecha de la primera consulta hospitalaria por dicha enfermedad. La causalidad inversa también podría explicar los resultados de otros estudios con un seguimiento corto después de una lesión cerebral traumática.
≈ Índice de masa corporal y diabetes
Existe una relación compleja entre la resistencia a la insulina y la EP
Los resultados de estudios longitudinales no han hallado asociación entre el índice de masa corporal (IMC) y el riesgo de EP. La excepción es una cohorte de Finlandia, en la que el sobrepeso (IMC 27-29,9) y la obesidad (IMC ≥30) fueron factores de riesgo de EP. El hallazgo de un aumento del riesgo de EP en los individuos con aumento del espesor del pliegue cutáneo en el tríceps o del cociente cintura:cadera sugiere que la distribución adiposa podría ser un mejor Indicador del riesgo de EP que la masa gasa total.
En un estudio de cohortes finlandés, el síndrome matabólico se asoció con un riesgo 50% menor de EP; esta asociación fue principalmente impulsada por la hiperglucemia en ayunas. Por el contrario, en una cohorte de Finlandia, en investigaciones de bases de datos de Dinamarca y Taiwán, en el Physician Health Study y en la cohorte NIH-AARP se ha reportado un mayor riesgo de EP en individuos con diabetes tipo 2 (DM2), lo que no fue comprobado en dos grandes cohortes prospectivas estadounidenses.
Estos resultados conflictivos sugieren que existe una relación compleja entre la resistencia a la insulina y la EP, que quizás está modificada por otros factores, como la hiperuricemia, que es un factor de riesgo de DM, pero inversamente asociada a la EP. La DM y la EP podrían tener mecanismos celulares comunes: disfunción mitocondrial y subexpresión del regulador de la transcripción PPARγ coactivador 1α (PGC1α), que estimula la biogénesis mitocondrial y la respiración. Por otra parte, el riesgo de EP en la DM podría reducirse mediante el uso de fármacos antidiabéticos como la metformina, la exenatida o los inhibidores de la dipeptidil peptidasa.
≈ Colesterolemia e hipertensión
En la cohorte de Rotterdam y el HAAS se ha comprobado un riesgo más bajo de EP en los participantes con colesterolemia elevada mientras que en una gran cohorte de Finlandia se halló un aumento marcado y significativo de dicho riesgo. En el Nurses’ Health Study y el HPFS (n = 530 para ambas cohortes combinado), el riesgo de EP disminuyó con el aumento del colesterol en la sangre pero no se asoció con el antecedente de hipercolesterolemia o hipertensión arterial. Estos resultados discordantes sugieren que hay factores de confusión desconocidos que modifican la asociación de la colesterolemia con el riesgo de EP.
≈ Alcohol
En general, los resultados de estudios longitudinales muestran que el riesgo de EP desciende un poco en los bebedores en comparación con los no bebedores, un resultado que coincide con los efectos de la elevación del urato en las bebidas alcohólicas. Sin embargo, en un estudio basado en el Registro Nacional de Pacientes Internados de Suecia, con la inclusión de más de 1.000 casos de EP, el abuso de alcohol (definido como la hospitalización por trastornos por el uso de alcohol) ha sido asociado con el aumento del riesgo de EP.
≈ Hormonas posmenopáusicas y factores reproductivos
La mayor incidencia de EP en los hombres que en las mujeres sugiere la existencia de determinantes hormonales del riesgo de EP. El 33% de las participantes del Cancer Prevention Study que recibieron estrógenos mostró un aumento del riesgo de muerte por EP comparadas con las mujeres que no recibieron estos fármacos. En las mujeres del Nurses´ Health Study y las de cohorte de Dinamarca y del NIH-AARP, el uso de hormonas en la posmenopausia se asoció con un aumento no significativo del riesgo de EP.
Los resultados de estos estudios indican que el uso de hormonas en la posmenopausia aumenta el riesgo de EP, más que un riesgo disminuido sugerido por la diferente prevalencia entre hombres y mujeres. La asociación entre el uso de estrógenos y la EP podría estar modificada por la cafeína. En general, no hay pruebas convincentes de la asociación entre el riesgo de la EP y los factores reproductivos, incluyendo la edad de la menarca, el uso de anticonceptivos orales, el historial de embarazos o la menopausia.
≈ Vitaminas y otros micronutrientes
La ingesta total de vitaminas antioxidantes, incluyendo las vitaminas C y E, y de carotenoides no se asoció con el riesgo de EP en las cohortes del Nurses´ Health Study y HPFS. Los hallazgos de estudios longitudinales indican que no hay asociación entre el riesgo de EP y el ácido fólico y las vitaminas B, excepto por una relación inversa entre la ingesta de vitamina B6 y la EP en la cohorte de Rotterdam.
La ingesta de vitamina D y de calcio tampoco parece estar relacionada con el riesgo de EP. En una cohorte finlandesa, la concentración de 25(OH)D sérica, un marcador del estado de la vitamina D, se asoció inversamente con el riesgo de EP. La deficiencia de vitamina D es común en la EP y se ha postulado que podría tener valor pronóstico. En la EP, el hierro se acumula en la sustancia negra y se ha postulado que la sobrecarga de hierro es un mecanismo potencial en la patogénesis de la EP.
Esta hipótesis se debilita en ausencia de la asociación entre el número de donaciones de sangre─inversamente correlacionadas con la ferritina y el hierro corporal total─y el riesgo de EP. En el único estudio longitudinal que evaluó la ingesta de hierro, el hierro total no se asoció con el riesgo de EP. La información sobre la asociación de otras vitaminas y minerales con el riesgo de EP es escasa o no está disponible.
≈ Grasas y otros macronutrientes
En el HPFS y el Nurses 'Health Study, el l reemplazo de la grasa poliinsaturada por grasa saturada se asoció con el riesgo de EP en los hombres, pero no en las mujeres. En la cohorte de Rotterdam, el riesgo de EP disminuyó con el aumento de la ingesta de grasa total o de grasas poliinsaturadas mientras que en el Singapore Chinese Health Study, el riesgo de EP estuvo inversamente relacionado con la ingesta de grasas monoinsaturadas para los cuartilos más alto al más bajo; pero no con las grasas poliinsaturadas.
En el HAAS, la ingesta de grasas poliinsaturadas se asoció con el riesgo de EP pero solo entre los no fumadores. Por el contrario, en la cohorte NIH-AARP se observó una asociación positiva entre la poca ingesta de grasas poliinsaturadas y el riesgo de EP. En general, no hay pruebas convincentes de que la ingesta de grasa total o de ácidos grasos diferentes o de otros macronutrientes esté relacionada con el riesgo de EP.
≈ Otros factores
Hay muchos factores posibles de riesgo de EP para los cuales la evidencia todavía es escasa o inconsistente. Estos factores son los factores que influyen en edades tempranas como la estación del nacimiento, el peso al nacer, la edad paterna y varias infecciones como el sarampión (asociación inversa), infecciones del SNC, hepatitis C y Helicobacter pylori. La influenza ha sido asociada a un mayor riesgo de parkinsonismo pero no a la EP. El manganeso puede causar parkinsonismo pero las pruebas no son concluyentes respecto del riesgo de EP.
En estudios basados en registros suecos y en estudios de rosácea en Dinamarca se halló que los individuos con enfermedades autoinmunes y los de mayor nivel socioeconómico tienen un aumento de los factores de riesgo de EP. Por último, existe un creciente interés, pero no hay datos longitudinales, en el papel potencial de los disolventes (por ej., tricloroetileno) como factores de riesgo adverso y del microbioma intestinal como un modulador del riesgo de EP.
≈ Factores protectores
► Tabaco
En varias investigaciones prospectivas se informó un riesgo bajo de EP entre fumadores de tabaco, y también ha sido reportado en usuarios de tabaco sin humo (por ej., tabaco de mascar) . Los resultados de estas investigaciones mostraron que el riesgo de la enfermedad disminuye hasta un 70% con la mayor duración del tabaquismo y el lapso transcurrido desde que los ex fumadores dejaron de fumar. La estrecha asociación, en clara dosis-respuesta, y la robustez para el ajuste multivariado crean confusión en cuanto a que los factores de riesgo conocidos de EP sean una explicación poco probable de esta disminución del riesgo. Por otra parte, la relación inversa entre el tabaquismo y la EP en gemelos monocigotas hace que la explicación genética sea altamente improbable.
Aunque los individuos predispuestos a la EP tienden a tener puntajes de riesgo opuesto y de búsqueda de sensación bajos (consistentes con una personalidad premórbida de EP), y por lo tanto son menos inclinados a iniciar o continuar el consumo de cigarrillos, el ajuste por el puntaje de búsqueda de sensación solo atenuó ligeramente la relación inversa entre el tabaquismo y la EP, lo que sugiere que estos factores actúan de manera independiente. De manera similar, los rasgos de personalidad tales como la inestabilidad emocional y la a introversión no explican la relación entre fumar y el riesgo de EP. Se ha sugerido que hay menor capacidad de respuesta a la nicotina durante la fase prodrómica de la enfermedad, de manera que la cesación de fumar podría ser un aspecto preclínico de la EP.
Esta hipótesis, sin embargo, no explica el riesgo más bajo de EP en los fumadores comparados con los no fumadores; debido a que la edad más frecuente para comenzar a fumar está por debajo de los 30 años, de manera que la fase prodrómica de la EP tendría que comenzar en la década de los 20 años para explicar esta asociación. Alternativamente, las diferencias constitucionales ocurridas al azar ya se manifiestan en la década de los 20 años y quizás podría determinar la susceptibilidad tanto a la adicción a la nicotina como al riesgo bajo de EP. Sin embargo, hay dos conclusiones importantes que parecen contradecir la hipótesis prodrómica y constitucional de la enfermedad. Si el tabaquismo redujo el riesgo de EP, un cambio en la conducta con el cigarrillo en la relación H:M cambiaría la incidencia de la EP en la relación H:M, pero no se esperaría ningún cambio si no hay una relación causal.
En un estudio ecológico, sobre la base de los cambios sustanciales producidos en el consumo de cigarrillos en la relación H:M de los diferentes países y cohortes de nacimiento se halló una correlación significativa entre la relación H:M observada en la incidencia de EP y el hábito de fumar. En general, los resultados sugieren que fumar reduce un 74%. El riesgo de EP. Aunque no se puede excluir la confusión de otros factores con tendencias geográficas e históricas similares a fumar, estos datos apoyan un papel causal del tabaquismo en la reducción del riesgo de EP.
Por otra parte, si la asociación inversa entre la a incidencia de EP se debió a una disminución de la respuesta a la nicotina en los individuos con EP prodrómica o constitucionalmente predispuestos a esa enfermedad, no es de esperar que el tabaquismo de los padres sea un predictor del riesgo de EP en los hijos (a menos que se postule que la predisposición constitucional a la EP sea heredada, lo que se contradice con los resultados de los estudios en gemelos). La asociación inversa entre el tabaquismo de los padres y el riesgo de EP proporciona evidencia indirecta de un efecto protector del tabaco─el menor riesgo de EP se explicaría por la mayor frecuencia de tabaquismo entre los hijos de fumadores.
Aunque ninguno de estos argumentos en sí mismo proporciona una prueba incuestionable, la evidencia de que el uso de tabaco disminuye el riesgo de EP es convincente. Los posible efectos terapéuticos de la nicotina, que en algunos modelos animales de EP se mostró como un neuroprotector, está siendo investigada en un ensayo aleatorizado en pacientes con EP (18 meses de diagnóstico), pero no se puede excluir el papel de otros componentes del tabaco.
►Café y cafeína
En varias cohortes prospectivas se ha comprobado que los bebedores de café tienen un riesgo más bajo de EP en comparación con los no bebedores, lo que se atribuye al consumo de cafeína. La asociación es más fuerte y estrecha en los hombres (sobre todo en los de consumo más elevado de café o cafeína) que en las mujeres, probablemente debido a una interacción entre la cafeína y las hormonas posmenopáusicas.
El consumo de cafeína se asoció con una reducción del riesgo de EP entre las mujeres que no usan hormonas en la posmenopausia pero no en las que usan hormonas. Sin embargo, esta interacción entre la cafeína y las hormonas no fue corroborada en la cohorte NIH-AARP.
En estudios longitudinales y Singapur se hallaron asociaciones inversas entre el consumo de cafés y cafeína y el riesgo de EP. Por el contrario, en la cohorte de gemelos suecos no se halló asociación entre el consumo de café y el riesgo de EP, pero el poder del estudio estuvo limitado por el hecho de que solo el 3% de los os participantes reportó ningún consumo de café. En general, la evidencia que relaciona el consumo de café con el riesgo de EP es sólida, pero la incertidumbre sigue en relación a posibles interacciones con las hormonas sexuales y la dosis-respuesta.
Un efecto neuroprotector de la cafeína, que es un antagonista del receptor de adenosina, está bien documentado en modelos de EP y probablemente esté mediada por el bloqueo del receptor A2A de la adenosina. Este efecto es más fuerte en ratones machos que en ratones hembras y, como en las mujeres, en los roedores parece haber una interacción entre la cafeína y los estrógenos. Aunque la cafeína es el componente neuroprotector más probable del café, también pueden contribuir otros constituyentes (por ej., el cafestol).
Las dosis bajas de cafeína tienen beneficios sintomáticos en la marcha congelada, la bradicinesia o la rigidez. Otros antagonistas del receptor A2A más selectivos (por ej., istradefilina y tozadenante) brindan beneficios sintomáticos en ensayos clínicos de pacientes con EP tratados con levodopa. La posibilidad de que la cafeína (un antagonista inespecífico de la adenosina) u otros antagonistas de los receptores A2A más selectivos tengan efectos neuroprotectores no ha sido rigurosamente investigada en ensayos con individuos con EP. Teniendo en cuenta el perfil de seguridad bien establecido de la cafeína y sus probables efectos benéficos en la prevención de las condiciones comunes entre los individuos con EP, como la depresión, sus efectos neuroprotectores potenciales en individuos que no son habituales consumidores de cafeína merecen más investigación.
► Té verde y té negro
El riesgo de EP es menor en los bebedores de té que entre los no bebedores, aunque esta asociación es más aparente en individuos que no son bebedores de café. En un estudio de cohortes de Singapur, el consumo de té negro se asoció con una reducción del riesgo de EP no así con el consumo de té verde. Debido a que la asociación persistió después del ajuste por el consumo total de cafeína, los autores llegaron a la conclusión de que los que contribuyen en la reducción del riesgo de EP sean los componentes del té que no se hallan en el café. Este análisis preliminar─que parece contradecir los primeros estudios experimentales sugiere efectos protectores de los componentes del té verde, como la epicatequina y el galato de epigalocatequina─necesita ser fundamentado mediante más investigaciones.
► Urato
El urato (ácido úrico), el producto final del metabolismo de las purinas como es la adenosina es un potente antioxidante y circula en el cuerpo en concentraciones elevadas. Estudios de laboratorio de modelos celulares y roedores con EP han proporcionado pruebas consistentes de que el urato puede proteger contra la degeneración dopaminérgica de las neuronas, probablemente por la activación de la Nrf2/respuesta antioxidante. Debido a que se cree que el estrés oxidativo representa un papel en la patogénesis de la EP, se espera que las concentraciones elevadas de urato se asocien con un riesgo menor de EP.
En la cohorte HAAS se observó una tendencia inversa entre el urato sérico medido al inicio y la incidencia de la enfermedad en los 30 años siguientes. Esta observación fue apoyada por los resultados del estudio de Rotterdam y el HPFS. En la cohorte HPFS de 18.000 hombres, el riesgo de EP fue 55% menor en los hombres en el cuartil más alto del plasma en comparación con los de los cuartilos más bajos. Po otra parte, esta asociación inversa fue independiente de la edad, el IMC, el tabaquismo, el consumo de café y otros aspectos del estilo de vida (por ej., actividad física y consumo de alcohol) que han sido relacionados con la EP y la uricemia.
Un metaanálisis de 2007 de datos prospectivos sobre el urato y el riesgo de EP mostró un riesgo sustancialmente menor de la enfermedad en las personas con concentraciones plasmáticas de urato más elevadas, una reducción del 20% en la proporción de la tasa de EP por cada desviación estándar (1,3 mg/dL) en la concentración de urato sanguíneo. Varios estudios prospectivos de cohortes más recientes han proporcionado evidencia adicional del urato sérico como un factor de riesgo inverso de EP, particularmente en los hombres. El riesgo de la enfermedad también se redujo en las personas con gota, como se muestra en dos estudios de cohortes prospectivas independientes, pero este hallazgo no se halló en un tercio de los participantes.
Además de la concentración sérica de urato en sí, los determinantes genéticos y ambientales (dietéticos) de la concentración de urato también han sido relacionados con el riesgo de EP, apoyando la hipótesis de una relación causal y modificable entre la concentración de urato y la EP. SLC2A9 es un transportador de urato y la variación en su gen es el determinante genético de la concentración de urato sanguíneo conocido más importante. Los polimorfismos SLC2A9 predictivos de mayores concentraciones séricas de urato se han asociado con un comienzo más tardío de los síntomas.
Del mismo modo, un índice genético compuesto de las concentraciones más bajas de urato, incluyendo el polimorfismo de un solo nucleótido en SLC2A9 y 8 genes diferentes de los genes asociados al urato, fue significativamente mayor en las personas con EP en comparación con los participantes control. Sin embargo, en un estudio de casos y controles, el polimorfismo de un solo nucleótido de SLC2A9 no se asoció con EP. Complementando estos denominados enlaces de genes de urato a la EP, el consumo elevado de urato contenido en los alimentos (por ej., fructosa) se asoció con un riesgo reducido de EP en la cohorte del HPFS seguida en forma prospectiva).
La asociación epidemiológica con el riesgo de EP en poblaciones saludables impulsó la investigación de la relación entre el urato y la progresión de la enfermedad en los participantes de dos estudios clínicos muy rigurosos, a largo plazo, conocidos como Parkinson Research Examination of CEP-1347 Trial (PRECEPT)1 y el Deprenyl and Tocopherol Antioxidative Therapy of Parkinson’s Disease (DATATOP). Estos 2 estudios juntos incluyeron a más de 1.600 pacientes con EP temprana, y en ambos estudios, el cociente de riesgo de alcanzar el objetivo primario del estudio─por ej., el desarrollo de la suficiente discapacidad para requerir el tratamiento dopaminérgico─disminuyó con el aumento de la concentración de urato sérico.
La similitud de las características de la población y del diseño de ambos estudios permitió el análisis agrupado y la justificación de una tasa decreciente de progresión de la discapacidad en función de la concentración de urato sérico en la fase temprana de la enfermedad. En un análisis por sexo, se observó que los hombres tenían una reducción más robusta y progresiva del cociente de riesgo con la concentración creciente de urato, lo que no fue corroborado en las mujeres.
Sin embargo, esta diferencia entre ambos sexos puede deberse a que se incluyeron menos mujeres y a que las concentraciones de urato fueron más bajas en las mujeres que en los hombres. En un subgrupo de participantes PRECEPT, se observó una firme asociación inversa similar entre el urato basal y la pérdida del iodo123-marcado 2ß-carboximetoxi-3ßß- (4-iodofenil) tropano ([¹²³I] β-CIT) estriatal, un marcador del transportador presináptico de dopamina.
En DATATOP, la concentración sérica de urato fue muy predictiva de una velocidad de declinación clínica menor en los participantes que no recibieron vitamina E, pero no en aquellos que reciben 2.000 UI por día, coherente con una interacción competitiva entre los efectos protectores putativos del urato y la vitamina E como antioxidante. De hecho, en contraste con los resultados del DATATOP para la cohorte completa, en aquellos en el quintil más bajo del urato sérico, el tratamiento con vitamina E pareció disminuir significativamente la velocidad de la progresión clínica.
Un estudio aleatorizado mendeliano de 735 participantes DATATOP y PRECEPT con el ADN disponible dirigió la causalidad de la relación entre las concentraciones elevadas del urato sérico y la progresión más lenta de la EP utilizando una variante genética del transportador de urato SLC2A9 como proxy inconfundible de las concentraciones de urato sérico. Consistente con los estudios de población previos, las variaciones en SLC2A9 se asociaron estrechamente con las concentraciones séricas de urato.
Los alelos de SLC2A9 asociados a las concentraciones más bajas de urato sérico también se asociaron con una progresión clínica más rápida. En un ensayo en fase II, aleatorizado, doble ciego, en general la inosina fue segura, tolerable y eficiente en elevar las concentraciones de urato en el suero y el líquido cefalorraquídeo en la EP temprana. Se está realizando un ensayo en fase 3, en individuos con EP temprana. Para evaluar si la elevación del urato con inosina es una terapia potencial modificadora de la EP. Los resultados preliminares sugieren que las mayores concentraciones de urato podrían ser beneficiosas para prevenir y tratar otras afecciones neurodegenerativas, incluyendo la enfermedad de Alzheimer, la enfermedad de Huntington y la esclerosis lateral amiotrófica.
► Actividad física
La relación inversa entre la cantidad de actividad física y el riesgo de EP fue Informada primero prospectivamente en el Nurses 'Health Study y el HPFS, y luego demostrada en 5 estudios longitudinales adicionales (Harvard Alumni Health Study, CPS-IIN, NIH-AARP Diet and Health Study, Finnish Mobile Clinic Study y el Swedish National March Cohort). Los resultados combinados de estos estudios muestran que la actividad física frecuente moderada o vigorosa se asocia con una reducción del 34% de EP. El hecho que el riesgo de EP en la edad adulta tardía se asocie estrechamente en forma inversa con la escolaridad secundaria y la actividad universitaria, o con las edades entre los 35 y los 39 años argumenta contra de la causalidad inversa.
Si bien la posibilidad de que los individuos predispuestos a la EP tiendan a evitar la actividad física extenuante en la edad adulta temprana no puede ser excluida, estos resultados son consistentes con el efecto neuroprotector de la actividad física, una Interpretación apoyada por los resultados experimentales en modelos animales de EP. Entre los mecanismos propuestos para este efecto neuroprotector se hallan el aumento del urato sérico, la mayor liberación de factores neurotróficos (por ej., el factor neurotrófico derivado del cerebro; del inglés: BDNF), la regulación positiva de PGC1α, y la regulación de la rotación de dopamina. Los beneficios potenciales del ejercicio en las personas con EP son un tema de investigación activa, incluyendo ensayos aleatorizados.
► Fármacos antiinflamatorios no esteroideos (AINE)
Frecuentemente, en la EP, la degeneración neuronal se acompaña de una respuesta glial importante─con predominio de la activación de la microglía─lo que propagaría la neurodegeneración. Por lo tanto, es posible que los AINE puedan contribuir al retraso o la prevención del inicio de la EP clínica suprimiendo las respuestas proinflamatorias de la microglía. En la primera investigación prospectiva evaluatoria de la eficacia de los AINE para la prevención o el retraso de la aparición de la EP en los participantes de las cohortes de Nurses’ Health Study u HPFS, los usuarios de AINE (definidos como los que consumen ≥2 veces por semana) tuvieron un riesgo de EP 45% más bajo que los no usuarios.
En la cohorte CPS-II se halló menor riesgo de EP en los usuarios de ibuprofeno, pero no los usuarios de otros AINE. Un resultado similar se halló en las cohortes extendidas del Nurses’ Health Study and HPFS. En un metaanálisis que incluyó datos de las cohortes anteriores y del UK General Practice Research, Group Health Cooperative y el Rochester Project, con un total de >2.700 casos incidentes de EP, el uso regular (de diferente definición en los estudios) de ibuprofeno se asoció con un 27% de reducción del riesgo de EP, mientras que no se halló asociación de otros AINE. Los resultados de dos estudios longitudinales posteriores apoyan la ausencia de una asociación entre el uso de AINE y el riesgo de EP, pero no fueron informados específicamente los resultados para el ibuprofeno.
La discordancia de los resultados obtenidos entre el ibuprofeno y otros AINE sugiere que el ibuprofeno posee propiedades protectoras. Entre los mecanismos propuestos para la Los efectos protectores del ibuprofeno, el principal es la activación de PPARγ, un objetivo terapéutico propuesto para la EP. Entre varios AINE de uso común, el ibuprofeno también está más estrechamente asociado al menor riesgo de enfermedad de Alzheimer y a la menor concentración de sustancia amiloide β en los modelos animales de esta enfermedad. Por lo tanto, el ibuprofeno merece mayor atención como agente neuroprotector potencial para la EP y otras enfermedades neurodegenerativas.
► Bloqueantes de los canales de calcio
Aunque no hay evidencia convincente de que existe una relación entre la hipertensión arterial y el riesgo de EP, el uso del bloqueante de los canales de calcio dihidropiridina─comúnmente indicado como hipotensor─en algunos estudios (pero no en todos) se asoció con una reducción del riesgo de EP. Debido a los posibles mecanismos (bloqueo de los canales de calcio inducido por el estrés metabólico en las mitocondrias de las neuronas dopaminérgicas que degeneran en la EP) y hallazgos que muestran un efecto protector de los bloqueantes de los canales de calcio en los modelos animales, en un ensayo de fase 3 con pacientes con EP se está investigando la isradipina.
► Estatinas
Las estatinas tienen potentes propiedades antiinflamatorias e inmunitarias que modulan los efectos supuestamente beneficiosos para la EP, pero también disminuyen la concentración plasmática de la coenzima Q10. Esta coenzima es un componente esencial de la cadena respiratoria mitocondrial y un potente antioxidante, habiéndose formulado la hipótesis que actúa contra el desarrollo de la EP. Aunque las dosis elevadas de coenzima Q10 no traen beneficios para los pacientes con EP temprana, su reducción podría tener efectos deletéreos.
Se han mezclado los resultados de los estudios epidemiológicos que evalúan el efecto de las estatinas sobre el riesgo de EP. NO se halló ninguna asociación en varios estudios basados en los registros de prescripciones, incluyendo la UK General Practice Research Database, la corte de Rotterdam y los estudios en Canadá y Dinamaca. Por el contrario, en la base de datos de US Veterans Affairs se halló una asociación inversa de la simvastatina, como así también en el Nurses ' Health Study y HPFS, una conclusión apoyada por un metaanálisis y los hallazgos de un estudio realizado en Taiwan.
Sin embargo, se informó mayor riesgo de EP en los usuarios de estatinas del Atherosclerosis Risk in Communities Study. Este aparente efecto adverso se atribuyó a una disminución del colesterol plasmático, el cual, en esta cohorte estaba inversamente relacionado con el riesgo de EP. Este resultado se basó solo en 56 casos incidentales de EP y debe interpretarse con cautela. En general, si el uso de estatinas o las concentraciones del colesterol en la sangre están relacionados con el riesgo de EP sigue siendo incierto. El potencial terapéutico de la simvastatina en la EP está siendo investigada en un ensayo de fase 2.
► Flavonoides
Se ha reportado una asociación inversa moderada entre la ingesta de flavonoides y el riesgo de EP entre los participantes del HPFS comparando el quintil de ingesta más alto vs. el más bajo), pero no en el Nurses 'Health Study. Este resultado no ha sido probado en otras cohortes.
► Patrones dietéticos
En los participantes de las cohortes del HPFS y Nurse´s Helath Study, se consideró un patrón dietético prudente al caracterizado por una ingesta elevada de frutas, verduras y pescado, el cual se asoció con un menor riesgo de padecer EP, para el quintil más alto vs. el más bajo. Los mismos resultados se obtuvieron por un Índice de alimentación sana alternativa en las mismas cohortes.
Ambos resultados necesitan ser confirmados en estudios independientes. Una investigación minuciosa de la relación de la dieta con el riesgo de EP requiere una evaluación completa y actualizada de la dieta y el estado nutricional de grandes poblaciones. Pocos estudios cumplen con estos requisitos. En el Nurses 'Health Study y el HPFS, la dieta ha sido evaluada mediante cuestionarios alimentarios validados, implementados cada 4 años. La cohorte CPSD-IIN ha seguido un enfoque similar.
Otros estudios longitudinales sobre la dieta y EP basados en la frecuencia de los alimentos incluyen el HAAS, el NIH-AARP, el estudio Finnish Mobile Clinic y el estudio EPIC Greece, incluyendo 28.572 hombres y mujeres y 88 casos de EP incidente, pero para la predicción del riesgo de EP durante décadas estos estudios se basaron en una sola evaluación dietética. Aunque esto ha servido para detectar asociaciones fuertes, como la asociación con el café en el HAAS, podría no ser adecuado para detectar asociaciones más moderadas y para ajustar los sesgos por múltiples nutrientes relacionados. Por lo tanto, la relación entre la mayoría de los componentes dietéticos y el riesgo de EP sigue siendo muy incierta.
► Implicancias para la prevención y progresión de la EP
La prevención primaria de la EP plantea varios problemas. Debido a que en la mayoría de las personas envejecidas el riesgo de EP es superado por el riesgo de enfermedad cardiovascular, cáncer o enfermedad de Alzheimer, cualquier intervención en la población general que pudiera obtener incluso efectos adversos modestos sobre el riesgo de EP, el cáncer y la enfermedad de Alzheimer podría ser contraproducente. En la parte superior de la lista de intervenciones beneficiosas no solo para prevenir la EP sino también la mayoría de las otras enfermedades, figura el aumento en la actividad física.
La cafeína también tiene un perfil general favorable para la salud, pero al menos en las sociedades occidentales parece probable que la mayoría de los individuos ya está consumiendo una cantidad bastante óptima (con excepción de las personas que no toleran la cafeína, para quienes el consumo no es una opción), de modo que probablemente el margen de mejoría es pequeño.
Si las asociaciones inversas informadas en relación con la dieta fueran sustanciales, otras intervenciones adicionales podrían incluir la adherencia a un patrón dietético saludable y el aumento de la Ingesta de flavonoides. Alternativamente, las intervenciones más especificas podrían estar dirigidas a individuos con riesgo inusualmente elevado de EP (como las personas con mutaciones LRRK2), o en la fase prodrómica de la EP, que puede ser identificada por una combinación de síntomas no motores, como el estreñimiento, el comportamiento del movimiento ocular rápido durante el sueño, el desorden y la hiposmia y, las técnicas de imagen.
Los estudios epidemiológicos son útiles para ayudar a establecer objetivos biológicos entre los cientos sugeridos por los datos de laboratorio, lo que justifica aumentar las inversiones necesarias para desarrollar ensayos de terapias modificadoras de la enfermedad. Ejemplos de intervenciones desarrolladas predominantemente con datos epidemiológicos son los ensayos en curso de tratamiento con nicotina (prueba del efecto de un parche de nicotina transdérmico que libera 7-28 mg/día sobre el cambio en el puntaje del Unified Parkinson’s Disease Rating Scale [UPDRS] más allá de los 60 meses en 160 pacientes con EP temprana; cafeína (400 mg/día durante 5 años en 119 individuos con EP; el principal cambio será en el resultado principal del Movement Disorder Society [MDS]-UPDRS e inosina, para la elevación del urato en los pacientes con EP.
El ensayo de inosina está inscribiendo Individuos con EP temprana y concentraciones séricas de urato <5,7 mg/dl; la inosina debe ser titulada para lograr una concentración de urato de 7-8 mg/dL, y el resultado primario es la tasa de cambio en el MDS-UPDRS durante un período de 24 meses. Si estos ensayos son exitosos (es decir, demuestran un beneficio clínico), la nicotina, la cafeína o la inosina podrían ser propuestas no solo para el tratamiento sino también para la prevención de la EP.
FIGURA 4
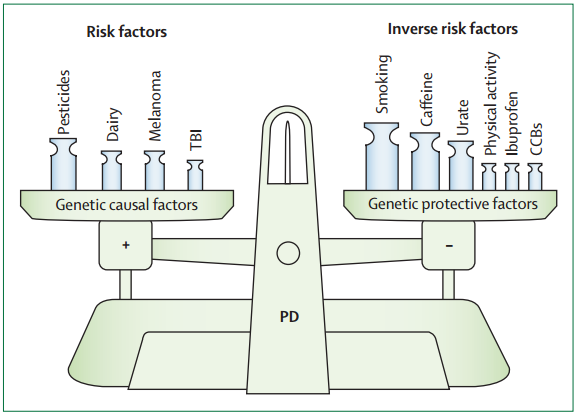
|
Balance de los factores genéticos y ambientales que subyacen en la aparición de la EP Se utilizaron pesas más grandes para los factores de con evidencia de mayor impacto epidemiológico. Se incluyeron solo los factores apoyados por múltiples estudios, pero la presentación no es exhaustiva y es solo con fines ilustrativos. Los factores incluidos podrían o no ser causales. TBI = lesión cerebral traumática. CCB = bloqueantes de los canales de calcio. |
≈ Conclusiones y orientaciones futuras
En los últimos 10 años, varios estudios longitudinales identificaron varios factores de riesgo de EP, incluidos algunos que podrían orientarse a reducir el riesgo de la enfermedad o retardar su progresión.
Aunque la prueba de causalidad es incompleta debido a la escasez de ensayos en seres humanos, la evidencia es suficientemente fuerte como para promover la actividad física y, posiblemente, las dosis moderadas de cafeína para la prevención primaria de la EP. El tratamiento óptimo para las personas con EP debe basarse principalmente en los resultados de los ensayos que ahora están en curso para la elevación del urato, la cafeína, la nicotina, las estatinas, la isradipina y la actividad física.
Se requieren más investigaciones para dilucidar el papel de otros componentes, como el tabaco, el ibuprofeno y los factores dietéticos en la patogénesis y progresión de la EP. Idealmente, esta investigación debe centrarse en los individuos con riesgo elevado o que se hallan en la fase prodrómica de la EP, quienes tienen las mayores posibilidades de recibir beneficios de las intervenciones neuroprotectoras.
Traducción y resumen objetivo: Dra. Marta Papponetti