Abreviaturas:
AOC: Anticonceptivo oral combinado
DHEAS: dehidroepiandrosterona sulfato
HOF: Hiperandrogenismo ovárico funcional
LH: hormona luteinizante
HSCNC: Hiperplasia suprarrenal congénita no clásica
MOP: Morfología del ovario poliquístico
SOP: Síndrome de ovario poliquístico
GFHS: Globulina fijadora de hormona sexual
Introducción
El síndrome de ovario poliquístico (SOP) es la causa más común de anovulación hiperandrogénica crónica y la causa más común de infertilidad en mujeres jóvenes. También es un factor de riesgo para comorbilidades relacionadas con el síndrome metabólico y para el deterioro del bienestar y la mortalidad.
Evidencia considerable sugiere que el SOP tiene diversas causas, surgiendo como un rasgo complejo con contribuciones tanto de factores heredables como ambientales que afectan a la esteroidogénesis ovárica.
El hiperinsulinismo resistente a insulina, en parte relacionado con obesidad coexistente, es el factor no esteroidogénico más común. Sus interacciones complejas generalmente imitan un rasgo autosómico dominante con penetrancia variable: el trastorno se correlaciona en gemelos idénticos; cerca de la mitad de las hermanas son hiperandrogénicas, y la mitad de estas también tienen oligo-amenorrea y por lo tanto SOP; los ovarios poliquísticos parecen heredarse de forma autosómica dominante. Del 3% al 35% de las madres tienen SOP, y la prevalencia de síndrome metabólico es alta en padres y hermanos.
El hiperandrogenismo ovárico funcional primario (HOF) representa la gran mayoría del SOP. Pruebas de la función androgénica ovárica muestran que la mayoría tienen una hiperreactividad de la 17-hidroxiprogesterona a las gonadotrofinas en ausencia de un bloque esteroidogénico (HOF típico) y una supresión subnormal de la dexametasona por la testosterona; sólo una minoría tiene esta última anormalidad (HOF atípico).
Una hiper-respuesta androgénica suprarrenal relacionada a la adrenocorticotrofina (hiperandrogenismo adrenal funcional primario) se asocia a menudo con HOF: ésta es la única fuente de andrógenos en un pequeño subconjunto de SOP.
El síndrome fue descrito por primera vez por Stein y Leventhal. Durante los últimos 25 años, se han desarrollado criterios diagnósticos internacionalmente aceptados para adultos en base a diversas combinaciones de hiperandrogenismo inexplicable, anovulación, y ovario poliquístico, que son todos abarcados por los criterios de consenso Rotterdam. Estos criterios generan 4 fenotipos, que están incluidos en un espectro de especificidad y severidad decreciente en la Tabla 1.
Tabla 1. Criterios diagnósticos para SOP en adultosa
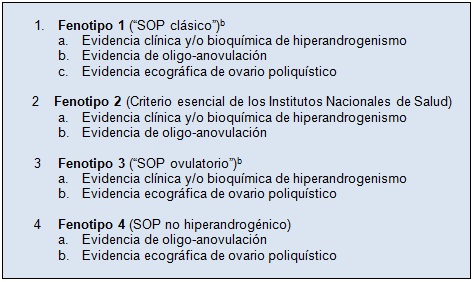
Rosenfield RL. The polycystic ovary morphology-polycystic ovary syndrome spectrum. [Published online ahead of print August 27, 2014]. J Pediatr Adolesc Gynecol. 2015; 28(6): in press. aCriterios Rotterdam: todos involucran la exclusión de otras causas de hiperandrogenismo y anovulación bSociedad de SOP-Exceso de Andrógenos: reconoce sólo los fenotipos hiperandrogénicos
Estos criterios diversos fueron problemáticos cuando se aplicaron en adolescentes. Los ciclos anovulatorios son frecuentes en las adolescentes. Los signos comunes del hiperandrogenismo del adulto son menos confiables en los adolescentes: el hirsutismo se encuentra en una fase de desarrollo, y el acné vulgar es común.
Los niveles séricos de testosterona aumentan durante los ciclos anovulatorios; hay una escasez de información sobre valores confiables para los niveles de andrógenos en las adolescentes, y la medida en que el hiperandrogenismo adolescente predice el hiperandrogenismo adulto es poco clara. Además, la morfología del ovario poliquístico para los estándares de adultos es común en las adolescentes normales.
Las recientes guías clínicas de la Sociedad de Endocrinología sugieren que el SOP en adolescentes sea diagnosticado utilizando los criterios de hiperandrogenismo inexplicable y alteración menstrual anovulatoria persistente basados en los Institutos Nacionales de Salud.
Debido a que la evidencia presentada para apoyar esta conclusión era pobre, la Sociedad de Endocrinología Pediátrica invitó a representantes de sociedades internacionales de endocrinología pediátrica, de adultos y reproductiva, medicina del adolescente, y ginecología orientada a adolescentes para nombrar expertos a fin de definir criterios adecuados para el diagnóstico del SOP en la adolescencia.
Este consenso apoyó el criterio de anormalidad menstrual oligo-anovulatoria hiperandrogénica persistente en base a estándares adecuados de edad y etapa de desarrollo, que se resumen en la Tabla 2. El propósito de esta revisión fue utilizar estos criterios de consenso como un punto de referencia para abordar los conceptos erróneos comunes que se interponen como una barrera para el diagnóstico precoz y el tratamiento del SOP.
Tabla 2. Criterios diagnósticos para SOP en adolescentes
Witchel S, Oberfield S, Rosenfield R, Codner E, Bonny A, Ibáñez L, et al. The Diagnosis of Polycystic Ovarian Syndrome during Adolescence Horm Res Pediatr. 2015; 83 (6):376–389.
EVIDENCIA DE UN GRADO ANORMAL DE ANOVULACIÓN EN ADOLESCENTES
"La anovulación en la mayoría de las adolescentes es asintomática"
La anovulación adolescente fisiológica es un fenómeno bien conocido: la mayor duración de los ciclos menstruales y el mayor grado de irregularidad menstrual en las adolescentes que en las mujeres adultas es debido a la mayor frecuencia de ciclos anovulatorios.
Sin embargo, hay un error muy extendido de que cualquier grado de amenorrea o irregularidad menstrual es aceptable. Más bien, la ciclicidad menstrual normal de las adolescentes sólo difiere ligeramente de la de las mujeres adultas en edad reproductiva: ciclos más cortos de 19 días o de más de 90 días son anormales en cualquier etapa; 75% de los ciclos menstruales varían desde 21 a 45 días durante el primer año post menarca (ginecológico), y el 95% de las niñas alcanzan una ciclicidad menstrual adulta de 21 a 40 días cerca de su quinto año ginecológico.
Por lo tanto, la anovulación en la mayoría de las adolescentes es asintomática, con un sangrado menstrual cíclico que por lo general se produce a intervalos de 21 a 45 días, incluso en los primeros años post menarca. Esta paradoja surge porque la función ovárica cíclica es generalmente inmadura durante estos intervalos.
La mayoría de los ciclos menstruales normales de las adolescentes que no son normalmente ovulatorios por criterios estándar tienen evidencia hormonal de insuficiencia lútea, lo que equivale a antecedente de ovulación con formación de un cuerpo lúteo inmaduro. Los cambios hormonales séricos durante los ciclos menstruales normales de las adolescentes confirman que se produce un desarrollo folicular cíclico inmaduro pero sustancial en este tipo de niñas y en algunas adolescentes sin cuerpo lúteo.
Un patrón de sangrado menstrual anormal ("anovulación adolescente sintomática ") es casi siempre el resultado de ciclos anovulatorios y motivo de preocupación si persiste. Las diversas manifestaciones de un grado anormal de anovulación adolescente, es decir, patrones de sangrado uterino que se producen en < 5% de las adolescentes, se resumen en la Tabla 3. La anovulación adolescente sintomática tiene un tasa de persistencia general a largo plazo de aproximadamente un tercio.
Tabla 3. Tipos de sangrado uterino anormal (SUA) hallados en pacientes adolescentes con SOP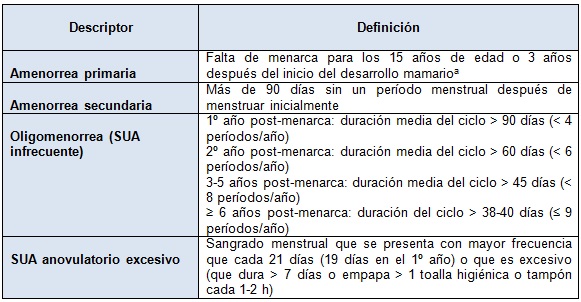
Modificado y reproducido con permiso de Rosenfield RL. Clinical review: Adolescent anovulation: Maturational mechanisms and implications. J Clin Endocrinol Metab. 2013; 98: 3572–3583. SUA: Sangrado uterino anormal. aLa edad ósea de 15 años puede ser sustituida por la edad cronológica en las niñas con una edad promedio de inicio de la pubertad más temprana de lo normal. Abarca SUA frecuente, intermenstrual, excesivo, y/o prolongado. Anteriormente denominado "hemorragia uterina disfuncional."
Sin embargo, el riesgo de anovulación en curso es mayor para las adolescentes anovulatorias hiperandrogenémicas que para las no hiperandrogenémicas.
Entre las niñas evaluadas por sangrado menstrual anormal sin signos clínicos de hiperandrogenismo, aproximadamente la mitad tenían niveles elevados de andrógenos. La reevaluación de estas pacientes ha demostrado que la hiperandrogenemia resuelve en aproximadamente la mitad y que el SOP es la causa más común de trastorno menstrual residual en curso.
Además, en presencia de evidencia clínica de hiperandrogenismo, por ejemplo, hirsutismo o acné grave, la oligo-anovulación hiperandrogénica (es decir, el síndrome de ovario poliquístico) persistió por ≥ 3 años en ≥ 80%. En efecto, en una pequeña serie de adolescentes con testosterona libre elevada y HOF documentado, el seguimiento mostró que todas persistían con el SOP en la edad adulta joven.
Por lo tanto, la curva actuarial que describe el pronóstico para la anovulación sintomática parece comprender 2 componentes: 1 para los casos hiperandrogenémicos, la mitad de los cuales persisten, y otro para los casos no hiperandrogenémicos, algunos de los cuales persisten. Los casos transitorios se deben a anovulación fisiológica. Los casos de hiperandrogenemia persistente son en su mayoría SOP, y los casos sin hiperandrogenemia persistente tienen alguna forma de hipogonadismo.
En resumen, el sangrado uterino a intervalos más frecuentes de 19 días o menos frecuentes de 90 días es anormal incluso en el primer año post-menarca (Tabla 3). En ausencia de evidencia clínica de un trastorno endócrino, el sangrado menstrual anormal persistente durante 1 año lleva a un riesgo de irregularidad menstrual en curso de aproximadamente el 50%, y aproximadamente la mitad de los casos actuales tendrán SOP. Sin embargo, si existe evidencia clínica de SOP, como hirsutismo, el riesgo de alteración menstrual hiperandrogénica es alto.
PRUEBAS CLÍNICAS Y BIOQUÍMICAS DE HIPERANDROGENISMO EN ADOLESCENTES
El hirsutismo debe ser distinguido de la hipertricosis, que se define como el crecimiento excesivo y generalizado del vello con un patrón de distribución no sexual
El desarrollo de vello sexual (pelo terminal que se desarrolla con un patrón tipo masculino) y de la mayoría de las glándulas sebáceas depende de los andrógenos. El hirsutismo es considerado un signo clínico de hiperandrogenismo y equivalente a evidencia bioquímica de hiperandrogenismo en todos los criterios de adultos para SOP (Tabla 1), dado que la documentación de la hiperandrogenemia puede ser problemática.
Sin embargo, este criterio es controvertido porque el hirsutismo leve se debe a factores étnicos o familiares más que a hiperandrogenemia la mitad de las veces, en contraste con el hirsutismo moderado-grave, que por lo general es debido a hiperandrogenemia. Por otra parte, la hiperandrogenemia se acompaña variablemente de hirsutismo: poco más de la mitad de los pacientes con SOP hiperandrogenémico lo presentan.
Evidencia clínica de hiperandrogenismo
El hirsutismo se define como vello sexual excesivo. El crecimiento del vello sexual es graduado comúnmente por la puntuación de Ferriman-Gallwey: una puntuación total de 8-15 define al hirsutismo leve, y de 16 a 24 al hirsutismo moderado en la población adulta general de los EE.UU.
El hirsutismo debe ser distinguido de la hipertricosis, que se define como el crecimiento excesivo y generalizado del vello con un patrón de distribución no sexual, por ejemplo, predominantemente en los antebrazos y pantorrillas.
Este crecimiento del pelo no es debido a un exceso de andrógenos. Puede tener una base étnica/hereditaria, o puede ser el resultado de malnutrición o de ciertos medicamentos, tales como fenitoína o ciclosporina.
Los datos normativos magros que existen en la adolescencia sugieren que un nivel adulto de hirsutismo se alcanza 2 años después de la menarca o a los 15 años de edad: las puntuaciones de 3 a 4 para el labio superior aumentaron durante el transcurso de la pubertad hasta alcanzar una prevalencia adulta de < 3% en adolescentes de raza blanca y negra para el segundo año post-menarca.
El acné, en lugar del hirsutismo, puede ser la única manifestación pilo sebácea de hiperandrogenismo. El acné comedónico es común en niñas adolescentes, pero el acné inflamatorio moderado o grave (es decir, > 10 lesiones faciales, Tabla 4) es infrecuente durante los años peri-menarca.
Las niñas con acné persistente y con mala respuesta al tratamiento tópico son ordinariamente tratadas con anticonceptivos orales combinados (AOC), que llevan a menor producción ovárica de andrógenos, o con el retinoide sistémico Accutane.
Debido a que la terapia con AOC enmascara el hiperandrogenismo del SOP subyacente, se recomienda que las pacientes con acné inflamatorio moderado-grave que no responde a tratamientos tópicos sean evaluadas para hiperandrogenemia antes de instituir tratamientos médicos sistémicos.
Tabla 4. Sistema de Puntuación del Acné para Adolescentes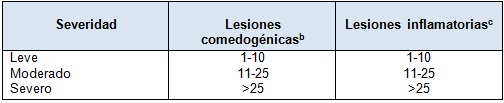
Lucky AW, Biro FM, Simbartl LA, Morrison JA, Sorg NW. Predictors of severity of acne vulgaris in young adolescent girls: Results of a five-year longitudinal study. J Pediatr. 1997;130:30–39; Eichenfield LF, Krakowski AC, Piggott C, et al. Evidence-based recommendations for the diagnosis and treatment of pediatric acne. Pediatrics. 2013; 131(suppl 3):S163–186; Deplewski D, Rosenfield RL. Role of hormones in pilosebaceous unit development. Endocr Rev. 2000; 21:363–392. aLa cara, el pecho, los hombros y la espalda pueden ser clasificados separadamente. bComedones abiertos ("puntos negros") o cerrados ("puntos blancos") (>1 mm de diámetro). cPústulas, pápulas (≤ 5 mm) y nódulos (> 5 mm). La cicatrización debería señalarse por separado.
Evidencia bioquímica de hiperandrogenismo
La testosterona libre elevada en suero es el indicador simple más sensible de hiperandrogenemia
La documentación del hiperandrogenismo requiere pruebas confiables con rangos normales bien definidos. Se recomienda la medición de la testosterona total y/o libre para iniciar la documentación de la hiperandrogenemia.
La testosterona libre elevada en suero es el indicador simple más sensible de hiperandrogenemia porque la porción bioactiva de la testosterona sérica es la fracción libre. Las concentraciones séricas de la globulina fijadora de hormona sexual (GFHS) rigen la fracción de testosterona que está libre; se ven disminuidas por la obesidad y el exceso de andrógenos en sí.
La relación costo-eficacia de medir rutinariamente más andrógenos que testosterona libre y total no ha sido documentada, aunque la androstenediona puede ser considerada y el sulfato de dehidroepiandrosterona (DHEAS) es ampliamente utilizado para evaluar el hiperandrogenismo adrenal. A pesar de que la dihidrotestosterona generada en los tejidos diana media la mayoría de los efectos de la testosterona, su nivel sérico es de poco valor diagnóstico.
Sin embargo, las determinaciones precisas de las concentraciones de la testosterona total y libre son a menudo problemáticas. El ritmo diurno, la fase del ciclo menstrual, y las concentraciones de GFHS son variables biológicas que influyen en las concentraciones de testosterona total. Los problemas metodológicos en relación con las determinaciones de testosterona abundan.
En particular, los ensayos de plataformas multicanal que son en la actualidad comúnmente utilizados por los laboratorios de los hospitales carecen de sensibilidad, especificidad y exactitud para la testosterona, aunque son buenos para la medición de GFHS y DHEAS.
Algunos ensayos directos de testosterona total también son inexactos, pero otros son tan precisos como los radioinmunoensayos post-cromatográficos que han estado disponibles sólo a través de laboratorios especializados o los métodos de espectrometría de masas en tándem que están comenzando a suplantarlos.
Los análisis de testosterona libre confiables calculan la concentración de testosterona libre como el producto de la testosterona total y la fracción que está libre de unión a la GFHS (testosterona libre = testosterona total x porcentaje de testosterona libre).
La mayoría de los métodos comunes calculan el porcentaje de testosterona libre a partir de la concentración de GFHS o determinan el porcentaje de testosterona libre por diálisis. Los ensayos de testosterona libre están menos estandarizados que los ensayos de testosterona total, lo que ha limitado su utilidad.
Los criterios utilizados para definir la hiperandrogenemia en adolescentes mujeres se ven confundidos por consideraciones del desarrollo. Sin embargo, poco después de la menarca, la testosterona sérica de las adolescentes alcanza niveles adultos. Por lo tanto, los niveles adultos de testosterona son un criterio adecuado en el que basar el diagnóstico de hiperandrogenemia.
Sin embargo, los niveles de testosterona aumentan a medida que los ciclos anovulatorios adolescentes se prolongan. Por lo tanto, los pocos datos disponibles sugieren que la anovulación fisiológica prolongada se corresponde con la mitad de los ciclos anovulatorios hiperandrogénicos que resuelven durante la adolescencia, como se discute en la sección anterior.
En resumen, la evidencia bioquímica de hiperandrogenismo, como se indica por elevación persistente de los niveles séricos de la testosterona total y/o libre por encima de lo normal para adultos y determinada por un laboratorio de referencia confiable, proporciona el apoyo más claro para la presencia de hiperandrogenismo en una adolescente con síntomas de SOP.
En la mayoría de los laboratorios de este tipo, el límite superior se aproxima a 55 ng/dl para la testosterona total y a 9 pg/ml para la testosterona libre. Sin embargo, un nivel de andrógenos elevado no debe considerarse una prueba de hiperandrogenismo en una adolescente por lo demás asintomática con síntomas anovulatorios a menos que la hiperandrogenemia y la anovulación persistan.
En ausencia de disponibilidad de ensayos confiables para andrógenos, el hirsutismo moderado-grave constituye una evidencia clínica de hiperandrogenismo. El acné vulgar inflamatorio moderado-grave que no responde a los medicamentos tópicos es una indicación para evaluar una posible hiperandrogenemia.
EL DILEMA DE LA MORFOLOGÍA DEL OVARIO POLIQUÍSTICO EN LA ADOLESCENCIA
Desde un punto de vista histopatológico, el ovario poliquístico se caracteriza por un excesivo número de pequeños folículos antrales que son retenidos antes de la etapa preovulatoria del desarrollo (lo que explica la apariencia poliquística), agrandamiento de los ovarios, engrosamiento capsular, e hiperplasia y luteinización del estroma tecal.
Ecográficamente, la morfología del ovario poliquístico (MOP) ha sido definida en adultos por criterios de consenso como un ovario con un volumen > 10.0 ml por una fórmula simplificada o un recuento de folículos antrales pequeños (2-9 mm de diámetro) ≥ 12 por ovario. Sin embargo, existe evidencia de que estos criterios son problemáticos en las adultas jóvenes, sobre todo porque las técnicas de imágenes vaginales de alta definición más nuevas muestran que recuentos de hasta 24 folículos antrales pequeños son normales.
Los criterios de MOP para adultos son especialmente problemáticos cuando se aplican en adolescentes. Por un lado, no puede definirse un recuento preciso de folículos antrales mediante el enfoque ecográfico abdominal necesario en adolescentes vírgenes.
Por otra parte, incluso si se obtiene un recuento preciso de los folículos por resonancia magnética, los criterios de adultos para la MOP se solapan con los criterios para un ovario multifolicular, que se define por la presencia de ≥ 6 folículos de 4 a 10 mm de diámetro sin aumento del volumen de ovario, siendo una variante normal sin relación con el hiperandrogenismo.
Además, aunque los datos varían considerablemente, la información actual sugiere que el volumen del ovario es ligeramente más grande en las adolescentes que en las mujeres adultas. En consecuencia, de un tercio a un medio de las adolescentes normales reúnen criterios adultos de MOP. Hasta que nuevas investigaciones establezcan criterios definitivos, la evidencia actual sugiere que un volumen ovárico medio de >12 cc (o un solo ovario > 15 cc) es considerado elevado en adolescentes.
La MOP se relaciona de forma variable con el hiperandrogenismo en adultos. Por un lado, está ausente en el 5% al 20% del SOP del adulto. Por otro, la MOP es un hallazgo común entre las mujeres sanas. Muchas de estas mujeres tienen características leves de SOP, es decir, ciclos menstruales irregulares y/o hirsutismo
. Cuando se ha tenido cuidado de excluir aquellas con dichas síntomas, aproximadamente un cuarto de las mujeres adultas aparentemente normales con MOP tienen una disfunción ovárica androgénica subclínica leve que está en el rango del SOP; se ha postulado que éstas son portadoras del SOP o están en riesgo de padecerlo.
En resumen, la incertidumbre acerca de los criterios apropiados de MOP en adolescentes es demasiado grande como para utilizar la MOP como criterio diagnóstico en esta población.
EL ROL DE LA RESISTENCIA A LA INSULINA Y DEL SÍNDROME METABÓLICO EN EL DIAGNÓSTICO DE SOP
La resistencia a la insulina fuera de la proporción que confiere la obesidad es diversamente reportada en uno a dos tercios de las mujeres con SOP. La prevalencia de obesidad varía ampliamente entre las poblaciones, con un promedio aproximado del 50%.
La resistencia a la insulina del SOP parece estar asociada con un aumento de los depósitos de grasa abdominal independiente del índice de masa corporal (IMC), y el exceso de adiposidad superpuesto lleva a nuevos aumentos de todos los depósitos de grasa y resistencia a la insulina.
El síndrome metabólico, una agrupación de alteraciones de la glucosa, obesidad central (androide), hipertensión y dislipidemia, es el resultado de la variable resistencia a la insulina interactuando con la obesidad y la edad. Su prevalencia es más alta en sujetos obesos. Está presente en ~ 25% de las adolescentes con SOP.
La comorbilidad del síndrome metabólico convierte al SOP en un factor de riesgo para el desarrollo temprano de diabetes mellitus tipo 2, trastornos respiratorios del sueño, y en última instancia, de enfermedad cardiovascular.
La resistencia a la insulina del SOP involucra fundamentalmente los efectos de la insulina sobre el metabolismo de la glucosa. Otras acciones de la insulina no se ven afectadas en pacientes con SOP, con un hiperinsulinismo resistente a la insulina compensatorio.
La hiperinsulinemia compensatoria lleva a acantosis nigricans y sinergiza con las gonadotrofinas para agravar el exceso ovárico de andrógenos. La hiperinsulinemia resistente a la insulina grave causa pseudo-síndrome de Cushing y pseudo-acromegalia.
En resumen, aunque la resistencia a la insulina y la obesidad se asocian comúnmente con el SOP, no están necesariamente presentes y por lo tanto no son criterios diagnósticos. Sin embargo, la presencia de obesidad y/o de signos de hiperinsulinismo resistente a la insulina tales como acantosis nigricans debe alertar al médico sobre la posibilidad de SOP y sus comorbilidades relacionadas con el síndrome metabólico.
PROCEDIMIENTOS DIAGNÓSTICOS PARA EXCLUIR CAUSAS DE ANOVULACIÓN HIPERANDROGÉNICA DISTINTAS AL SOP
Todos los criterios de consenso para SOP consideran al trastorno como un diagnóstico de exclusión. Aunque el diagnóstico diferencial del SOP es bastante extenso, la mayoría de los trastornos distintos a la anovulación fisiológica del adolescente son poco comunes a raros.
Todas las guías recomiendan el cribado para hiperplasia suprarrenal congénita no clásica (HSCNC), que es el trastorno que más probablemente imita al SOP aunque representa sólo ~ 5% de los casos de anovulación hiperandrogénica.
Por el contrario, las directrices difieren en las recomendaciones específicas para enfocar el estudio diagnóstico. La mayoría recomienda el cribado para hipotiroidismo debido a que causa irregularidad menstrual y engrosamiento del pelo (en lugar de un verdadero hirsutismo).
Algunos recomiendan la evaluación de todas las mujeres hiperandrogénicas para hiperprolactinemia; la mayoría de los endocrinólogos lo consideran raro, pero se ha informado en hasta el 16% de las mujeres jóvenes que se presentan con síntomas de SOP. Otros trastornos son innegablemente raros, incluyendo el único trastorno que amenaza la vida en el diagnóstico diferencial, el tumor secretor de andrógenos, cuya prevalencia es del 0,2%.
La adiposidad central y el hirsutismo del SOP con frecuencia generan preocupación por el síndrome de Cushing, que rara vez se presenta como SOP. Algunos trastornos raros son clínicamente sutiles desde el principio pero fáciles de detectar (por ejemplo, factor de crecimiento similar a la insulina tipo 1 para la acromegalia).
El enfoque para el diagnóstico diferencial comienza con una minuciosa historia clínica y un examen físico. Debido a que el SOP es más que una de muchas causas de anovulación y que sólo aproximadamente la mitad de los pacientes hiperandrogénicos tienen signos cutáneos de hiperandrogenismo, la evaluación inicial incluye a menudo la determinación de las gonadotrofinas séricas hormona luteinizante (LH) y hormona folículo-estimulante (FSH).
La LH baja sugiere un trastorno hipogonadotrófico de origen neuroendocrino, mientras que una FSH alta sugiere insuficiencia ovárica primaria. Está indicada una prueba de embarazo en toda adolescente sexualmente madura con amenorrea.
El estudio endocrinológico inicial del hiperandrogenismo típicamente incluye la medición de testosterona total, testosterona libre, GFHS, y DHEAS en suero, y del nivel matutino de 17-hidroxiprogesterona. Más allá de eso, el diagnóstico diferencial es individualizado.
Para los pacientes en los que el costo es una consideración importante, es razonable un enfoque minimalista en el que los hallazgos clínicos guían las determinaciones hormonales adicionales tales como tirotrofina, prolactina, factor de crecimiento simil insulina tipo 1, y cortisol sérico o urinario.
Para otros, la economía de tiempo justifica iniciar estudios con el panel de screening endocrino completo. Los hallazgos clínicos o de laboratorio o las preferencias de los pacientes pueden dictar una evaluación endocrinológica más completa para trastornos poco frecuentes (tabla 5) en algunos casos.
El nivel de 17-hidroxiprogesterona (17-HOP) de las 8.00 AM requiere interpretación; valores normales aleatorios no excluyen completamente la HSCNC debido a la marcada variación diurna. Un valor de las 8.00 AM > 200 ng/dl (6,0 nmol/L) es sugestivo de HSCNC, aunque también es compatible con ovulación reciente o hiperandrogenismo tumoral.
Este punto de corte muestra una sensibilidad del 92% al 98% para detectar la HSCNC, y una especificidad del 12% al 25% para su discriminación del SOP. Por lo tanto, a menos que la 17-OHP alcance un nivel diagnóstico (> 1000 ng/dl = 30 nmol/l), se recomienda una prueba de hormona adrenocorticotrópica para confirmar el diagnóstico de HSCNC.
Tabla 5. Causas de exceso de andrógenos en adolescentes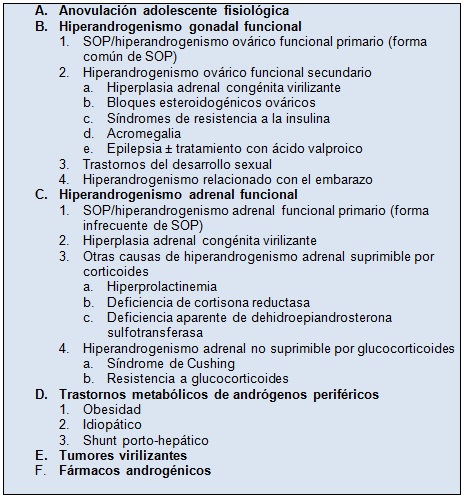
Modificado y reproducido con permiso de Rosenfield RL, Barnes RB, Ehrmann DA. Hyperandrogenism, hirsutism, and the polycystic ovary syndrome. In: Jameson JL, DeGroot LJ, eds. Endocrinology: Adult and Pediatric. 7 ed. Philadelphia: Elsevier; 2015:2275–2296.
La ecografía pélvica rara vez es necesaria para el diagnóstico, ya que los criterios para MOP en la adolescencia son inciertos, como se discutió anteriormente. Sin embargo, se indica si los resultados clínicos son indicativos de un tumor virilizante (por ejemplo, rápida progresión, clitoromegalia, masa pélvica, o un nivel de testosterona total > 200 ng/dl) o de un trastorno del desarrollo sexual. En ausencia de tumor, la ecografía puede ser una prueba tranquilizadora de que los "quistes" del SOP no se relacionan con patología tumoral.
Actualmente, la única manera segura de diferenciar la hiperandrogenemia del SOP de la anovulación fisiológica adolescente es por la persistencia del síndrome de ovario poliquístico en la edad adulta. Esto es particularmente problemático en los casos de adolescentes hiperandrogenémicas, por otro lado asintomáticas, con patrones de sangrado menstrual anormal: los datos revisados aquí indican que aproximadamente la mitad de éstos remitirán y la otra mitad persistirán como síndrome de ovario poliquístico.
La distinción es menos problemática en los casos de irregularidad menstrual con hiperandrogenismo sintomático, es decir, hirsutismo moderado-grave o acné inflamatorio: los datos anteriores revisados aquí indican que la gran mayoría (tal vez todos) persistirán como síndrome de ovario poliquístico.
Puede ser posible hacer la distinción temprana entre SOP y anovulación fisiológica adolescente mediante pruebas de función androgénica ovárica para diagnosticar la presencia de HOF. Será necesaria investigación adicional para evaluar esta posibilidad. Están disponibles dos tipos de pruebas.
La prueba de supresión androgénica por dexametasona es la más sensible, pero menos específica, de estas pruebas: la testosterona elevada post-dexamentasona indica una fuente no adrenal, que es generalmente ovárica.
La prueba más específica determina si la 17-HOP responde excesivamente a las gonadotrofinas (indicativo de HOF típico): esto implica la administración de una dosis de prueba de un agonista de la hormona liberadora de gonadotrofina o de gonadotrofina coriónica humana y la determinación del nivel de 17-HOP 24 horas más tarde.
La realización de un diagnóstico positivo de HOF por pruebas de función androgénica ovárica también posibilita otra distinción que rara vez se hace, pero que tiene implicaciones prácticas: la determinación de si el SOP se debe a obesidad simple, una categoría de SOP considerada como "pseudo-SOP".
El exceso de adiposidad en sí suprime la ovulación (a través de la supresión de LH) y causa hiperandrogenemia (a través de la formación en tejido adiposo de testosterona a partir de androstenediona). No se demostró una fuente ovárica ni suprarrenal de hiperandrogenismo mediante pruebas de función androgénica ovárica en ~ el 10% de los casos de SOP (criterios de los Institutos Nacionales de Salud), siendo la gran mayoría pacientes obesas. Estos casos se caracterizaron generalmente por elevación leve de la testosterona libre sérica, testosterona total normal, LH normal, y volumen ovárico normal.
Un panel de lípidos en ayunas y una prueba de tolerancia oral a la glucosa son aconsejables para la detección temprana de la diabetes mellitus y el síndrome metabólico en pacientes con SOP y obesidad o factores de riesgo familiares. Las pacientes obesas con SOP también deben ser evaluadas para trastornos respiratorios relacionados con el sueño. La evaluación del síndrome metabólico debería ser también considerada en parientes primarios en vista del componente familiar del SOP.
PRINCIPIOS DEL TRATAMIENTO DEL SOP EN ADOLESCENTES
El tratamiento del SOP es sintomático e individualizado de acuerdo con las necesidades y objetivos de las pacientes. Las principales consideraciones en el tratamiento del SOP en adolescentes son la irregularidad menstrual, las manifestaciones cutáneas de hiperandrogenismo, y las comorbilidades del síndrome metabólico.
La administración cíclica de estrógenos con progestina en forma de AOC combinados es el tratamiento médico de primera línea en la mayoría de las adolescentes. Los AOC normalizan el ciclismo del endometrio, protegiendo así contra el carcinoma endometrial, e inhiben la función ovárica, normalizando de ese modo los andrógenos séricos. Estas acciones los vuelven óptimos para el tratamiento del sangrado uterino anormal y como adyuvantes en el tratamiento cosmético y tópico del hirsutismo y el acné.
La monoterapia con progestina es la principal alternativa a los AOC para el control de la irregularidad menstrual en aquellas pacientes que se oponen a, o con contraindicaciones para (por ejemplo, riesgo tromboembólico) el uso de AOC. Sin embargo, el hiperandrogenismo antagoniza los efectos de las hormonas femeninas en el sistema neuroendocrino y endometrio, por lo el sangrado irregular puede persistir y los andrógenos no estar bien suprimidos.
Las comorbilidades relacionadas con la obesidad y la resistencia a la insulina requieren consideraciones de manejo separadas. La modificación del estilo de vida con restricción de calorías y aumento del ejercicio es de suma importancia, pero la pérdida de peso sostenida es difícil de lograr.
Los tratamientos de reducción de la insulina, ya sea mediante reducción del peso o tratamiento farmacológico, tienen una probabilidad de ~ 50% de mejorar la ciclicidad menstrual pero un efecto insignificante sobre el hirsutismo.
Estudios bien controlados indican que la monoterapia con metformina no ofrece ninguna ventaja sobre la modificación del estilo de vida con respecto a la reducción del peso o la frecuencia menstrual. Dado que puede tener efectos clínicos y bioquímicos aditivos, la metformina es más eficaz en combinación con un programa conductual de reducción de peso. La única indicación clara para el uso de metformina es la tolerancia anormal a la glucosa.
Otras aplicaciones requieren una mayor evaluación. Una discusión más detallada de los tratamientos y de las consideraciones de manejo de las pacientes a un nivel superior se puede encontrar en otros ámbitos.
DISCUSIÓN
Recientemente se ha alcanzado consenso entre las sociedades de subespecialidades pediátricas internacionales de que el uso de estándares apropiados según edad y etapa de desarrollo para la anovulación hiperandrogénica persistente inexplicable puede considerarse como un criterio diagnóstico apropiado para el SOP en adolescentes (Tabla 2).
El grupo de consenso instó a tener una gran precaución antes de etiquetar a las adolescentes hiperandrogénicas como portadoras de SOP si la alteración menstrual no se ha mantenido durante 2 años o más.
Antes de ese punto en el tiempo, recomendaron que tales niñas sean consideradas "en situación de riesgo para el síndrome de ovario poliquístico" (es decir, asignando un diagnóstico provisional) para evitar diagnosticar cambios fisiológicos puberales como SOP. Acoplaron esta recomendación con una para reevaluaciones longitudinales frecuentes. Estas recomendaciones ponen un alto valor en la precisión del diagnóstico.
En particular, las recomendaciones especifican que el inicio del estudio diagnóstico no debe ser demorado innecesariamente. Puede ser necesario el diagnóstico diferencial dentro de los 2 años para que el tratamiento médico que enmascararía la hiperandrogenemia y los síntomas anovulatorios, en particular los AOC, no sea retrasado innecesariamente.
Así, se aconseja el inicio de las pruebas diagnósticas dentro del plazo de 1 año, si se requiere tratamiento para controlar el sangrado menstrual anormal o las comorbilidades o si coexisten síntomas sugestivos de SOP (por ejemplo, desarrollo de hirsutismo, acné inflamatorio moderado resistente a la terapia tópica, acantosis nigricans).
El sangrado uterino excesivo puede exigir la evaluación de emergencia al inicio del curso evolutivo. La amenorrea primaria debe ser evaluada cuando se reconoce.
El profesional también debe reconocer que las alteraciones menstruales pueden no ser la queja principal. De hecho, los síntomas de anovulación pueden no ser el síntoma inicial, pero pueden surgir un año o más después de la presentación de obesidad, hirsutismo, o acantosis nigricans.
Por lo tanto, estas molestias deben dar lugar a la consideración de un estudio diagnóstico inicial adecuado. Si se sospecha de SOP en dichas pacientes, las pruebas de función androgénica ovárica específicas para documentar HOF pueden ser particularmente útiles.
En las adolescentes en las cuales se ha hecho un diagnóstico provisional de SOP, la recomendación para la reevaluación longitudinal requiere discontinuar el AOC por ~ 3 meses cuando la paciente es ginecológicamente madura (por ejemplo, cuando se gradúa de la escuela secundaria) para determinar la persistencia de la anovulación hiperandrogénica; esta maniobra debe ir acompañada de un asesoramiento anticonceptivo debido a que la infertilidad del SOP es relativa, no absoluta.
Comentario
El Síndrome de ovario poliquístico es la causa más común de anovulación hiperandrogénica crónica y de infertilidad en mujeres jóvenes, además de un factor de riesgo para comorbilidades relacionadas. El SOP es un cuadro complejo con contribuciones tanto de factores heredables como ambientales que afectan a la esteroidogénesis ovárica.
Si bien existen criterios diagnósticos de SOP para la población adulta, los mismos no pueden ser claramente aplicados en las adolescentes debido a las características particulares de este grupo etario, y a la superposición de síntomas con la anovulación fisiológica que puede observarse a esta edad.
El profesional deberá estar atento a la evolución de los síntomas que sugieran un SOP, a fin de solicitar pruebas específicas para arribar al diagnóstico y así mejorar la calidad de vida y la fertilidad de las mujeres involucradas instaurando un tratamiento oportuno y adecuado.
Resumen y comentario objetivo: Dra. María Eugenia Noguerol