La menopausia es el cese permanente de los ciclos menstruales después de la pérdida de la actividad folicular ovárica. Puede ser espontánea (menopausia natural) o iatrogénica (menopausia secundaria). Esta última incluye la extirpación de ambos ovarios (menopausia quirúrgica), la quimioterapia o la radioterapia. Para facilitar la investigación sobre la menopausia, en 2001 se convocaron investigadores que reportaron sus recomendaciones en el Staging of Reproductive Aging Workshop (STRAW) (Taller de Estadificación del Envejecimiento Reproductivo). Esta estadificación no solo es útil para la investigación sino también puede facilitar el diálogo entre una mujer y su médico, y entre los médicos. En 2012 se publicó una nueva definición de la clasificación STRAW que incluye varios ajustes basados en los datos de las publicaciones originales.
La clasificación STRAW divide la vida de la mujer en 7 períodos, comenzando en los segmentos -2, -1 y 0, e incluye la transición menopáusica precoz, la transición menopáusica tardía y el período menstrual final, respectivamente. Para indicar el momento de la menopausia se utiliza la edad de la menopausia natural, y se confirma después de 1 año de amenorrea.
La transición precoz se define como una desviación de la duración de los ciclos menstruales que previamente eran regulares, ≥7 días o ausencia de un periodo menstrual. Durante esta etapa, los niveles de estrógeno son fluctuantes pero suficientes en general, y los ciclos son en su mayoría ovulatorios. Si los niveles de estrógeno disminuyen, no su nivel se mantiene muy bajo durante mucho tiempo, pero fluctuante hasta después de la menopausia. Por lo tanto, en esta etapa de la transición, los síntomas suelen ser leves y la mayoría de las mujeres los experimenta pero no requiere tratamiento.
Claramente, la estadificación STRAW se aplica principalmente a las mujeres que experimentan la menopausia espontánea y no a las que tienen una menopausia secundaria. También es menos útil para las mujeres que no pueden observar un cambio en sus patrones menstruales debido, por ejemplo, a la histerectomía, la ablación endometrial, la anticoncepción, ya sea hormonal con supresión de los ciclos ováricos o por dispositivo intrauterino con progestina.
Para estas mujeres, la aparición de los síntomas de la menopausia debido a la disminución de la producción estrogénica del ovario puede proporcionar el primer indicio de menopausia. Aunque no todas las mujeres experimentan síntomas importantes, la disminución de los estrógenos en la menopausia provoca cambios en todo el cuerpo, incluyendo la pérdida de hueso, la tendencia al aumento de la grasa abdominal y un perfil de riesgo cardiovascular más adverso.
Epidemiología
Las primeras estimaciones epidemiológicas confiables para el momento de la menopausia dan una mediana de edad para la menopausia natural de los 48 a los 52 años en las mujeres de los países desarrollados. En un metaanálisis más reciente y más amplio de 36 estudios que abarcan 35 países, la edad media global fue de 48,8 años con una considerable variación entre las regiones geográficas.
Algunos de los síntomas fisiológicos más frecuentes son los síntomas vasomotores que aparecen durante y después de la menopausia, pero su prevalencia entre las mujeres de los países desarrollados oscila entre el 30% y el 75%.
Una revisión sistemática de la prevalencia de los síntomas de la menopausia en los países asiáticos halló que son otros los síntomas físicos que predominan sobre los síntomas vasomotores y psicológicos. Por otra parte, los síntomas vasomotores ocurrieron en mujeres premenopáusicas, perimenopáusicas y posmenopáusicas.
Sin embargo, cuando se aplicó una herramienta para evaluar el riesgo de sesgo, la mayoría de los estudios de la revisión mostró poca validez externa e interna. Por lo tanto, se necesitan más estudios de muestras representativas, con cuestionarios validados, para aclarar la prevalencia de los síntomas de la menopausia en las mujeres asiáticas.
Los estudios epidemiológicos han proporcionado una imagen detallada de la trayectoria de los síntomas experimentados en la transición a la menopausia y en la posmenopausia. Por ejemplo, los resultados de 2 estudios de mujeres que experimentaron fuertes picos de síntomas vasomotores, ya sea antes o después de la menopausia, mostraron una rápida declinación en la posmenopausia. Esta evolución de la gravedad de los síntomas no fue evidente cuando se analizó según la edad cronológica sino solamente cuando se examinó el momento con respecto a la edad de la menopausia. Estos resultados pueden ayudar a guiar el tratamiento óptimo y el manejo de los síntomas.
La edad de la menopausia también se reconoce cada vez más como un indicador de los resultados en la salud en una edad posterior, especialmente los relacionados con la exposición a los estrógenos, aunque los mecanismos biológicos subyacentes, muchas veces siguen siendo poco claros.
Por ejemplo, la insuficiencia ovárica primaria (menopausia antes de los 40 años) se asocia con menor riesgo de cáncer de mama y de ovario, pero con mayor riesgo de enfermedad cardiovascular y osteoporosis. Esto no implica necesariamente una relación causal sino que podría ser el resultado de factores de riesgo comunes. Este puede ser el caso de la enfermedad cardiovascular, para la cual los hallazgos recientes indican que los factores de riesgo preexistentes, como la hipercolesterolemia y la hipertensión arterial, también podrían estar asociados a la menopausia precoz. Sin embargo, generalmente cada año de retraso de la menopausia adicional se relaciona con una reducción del 2% de la mortalidad global.
Mecanismos / fisiopatología
Factores que influyen en la menopausia
La esperanza de vida funcional de los ovarios humanos está determinada por un conjunto complejo pero en gran parte no identificado de factores genéticos, hormonales y ambientales. Las mujeres experimentan la menopausia cuando ya se han agotado los folículos del ovario. Sin embargo, las manifestaciones clínicas de la menopausia son el resultado de las interacciones dinámicas entre los cambios neuroendocrinos y las alteraciones del eje endocrino reproductivo que comanda la función ovárica. No está clara la razón por la que los ovarios inician su función en la pubertad y la detienen en la menopausia. La comprensión de este fenómeno sería de gran valor para los problemas reproductivos y de salud.
Factores genéticos
El momento de la menopausia refleja una compleja interacción de factores genéticos, epigenéticos, socioeconómicos y del estilo de vida. Las estimaciones de la herencia de la edad de la menopausia oscilan del 30% al 85%. Casi el 50% de la variabilidad de la edad de la menopausia entre los individuos se relaciona con la genética. Las mujeres cuyas madres u otros familiares de primer grado tuvieron una menopausia precoz tienen 6-12 veces más probabilidad de tener una menopausia precoz. Por otra parte, los estudios de sección transversal y de cohorte han demostrado que la edad de la menopausia se asocia estrechamente con la edad a la que la madre experimentó la menopausia. Sin embargo, hasta el momento, los estudios genéticos no han logrado identificar claramente los rasgos genéticos subyacentes que intervendrían en la herencia.
Los análisis de ligaduras identificaron las áreas del cromosoma X (región Xp21.3) que se asocian con la menopausia precoz (<45 años) o la menopausia prematura (<40 años). Una región en el cromosoma 9 (9q21.3) también se asocia con la edad de la menopausia. Esta región contiene múltiples genes, incluyendo uno que codifica una proteína de la familia de los linfomas de células B 2 (BCL-2). Esta proteína interviene en la apoptosis, y por lo tanto puede influir en la menopausia a través de la depleción folicular. Otros estudios de análisis de ligaduras han identificado una región en el cromosoma 8 que se asocia con la edad de la menopausia. Curiosamente, dicen los autores, el gen que codifica a la hormona liberadora de gonadotrofina (GnRH) está cerca de esta región.
Los estudios que investigan las asociaciones entre los factores de codificación de los genes que están involucrados en la fisiopatología reproductiva y la menopausia han sido decepcionantes. La mayoría de los estudios no ha podido identificar asociaciones, o los resultados no pudieron ser replicados. Entre los genes investigados, los más promisorios han sido los que codifican al receptor estrogénico α (ESR1), la hidroxiesteroide deshidrogenasa 17β tipo 1 (HSD17B1), la hormona anti Mülleriana (AMH) y el receptor AMH tipo 2 (AMHR2).Las mujeres portadoras de mutaciones genéticas relacionadas con el cáncer de mama precoz tipo 1 (BRCA1) o BRCA2 son en promedio 3 años más jóvenes en la menopausia que los controles comparables (50 años vs. 53 años).
Existen trastornos genéticos conocidos que llevan a la menopausia precoz, incluyendo la mutación del gen que codifica la forkhead box protein L2 (FOXL2), que también causa blefarofimosis, ptosis y el síndrome del epicanto inverso. Las mutaciones de los genes que codifican la proteína morfogenética ósea 15 y el factor de crecimiento diferencial 9 resultan en menopausia precoz.
En un estudio, la galactosemia se ha asociado con la menopausia <40 años, lo que no fue confirmado en un estudio de seguimiento de una cohorte de tamaño similar. Se ha comprobado que las variantes de otros genes que están implicados en la función ovárica, como los que codifican la hormona folículo estimulante (FSH) y los receptores de la inhibina, se asocia con menopausia precoz y menopausia prematura. Las mujeres portadoras de la mutación del cromosoma X frágil tienen un número intermedio de repeticiones CGG en el gen del retardo mental del cromosoma frágil 1(FMR1) y experimentan menopausia precoz y menopausia prematura.
Recientemente, los estudios de asociación del genoma han hallado otros genes que pueden influir en el envejecimiento ovárico y la menopausia. Los más importantes son el gen de la serina BR/treoninacinasa 1 (BRSK1), que codifica una proteínacinasa AMP activada y el gen que codifica el complejo de mantenimiento del minicromosoma 8, que es esencial para la replicación del genoma.
Esperanza de vida ovárica y pérdida de folículos
Los ovarios y los folículos son fundamentales para determinar la edad de la menopausia. El número de células foliculares está determinado antes del nacimiento, cuando los ovocitos se multiplican hasta un máximo de 6-7 millones hacia la mitad de la gestación. Posteriormente, los ovocitos se pierden rápidamente debido a la apoptosis, dando lugar a una población de 700.000 al nacer y 300.000 en la pubertad.
Con la continuidad de la apoptosis, a medida que se van perdiendo los ovocitos a lo largo de 400-500 ciclos de reclutamiento folicular durante una vida reproductiva normal (a veces participan varios folículos por ciclo), al llegar a la mediana edad se produce el agotamiento final de estas células y entre los 45 y los 55 años sobreviene la menopausia. Estos números subrayan que la duración de la funcionalidad del ovario depende solo un poco de la ovulación y se determina principalmente por el alcance y la rapidez de la apoptosis de los ovocitos─se desconoce cómo se gobierna este proceso.
Aunque la pérdida de los ovocitos es fundamental para la menopausia, no son los que determinan los procesos coordinados que impulsan el ciclo menstrual sino las células especializadas secretoras de esteroides de la granulosa y la teca.
Las células foliculares están reguladas por la gonadotrofina hipofisaria, así como por las hormonas producidas localmente. Se cree que la pérdida de sensibilidad al factor de estimulación de las células foliculares tiene un papel clave en la disminución de la función ovárica. Consistente con este punto de vista, el cambio endocrino más reproducible y lineal en toda la transición a la menopausia es la disminución progresiva de la inhibina B y la AMH, que marcan la disminución de la masa y/o la funcionalidad folicular, y explica porqué la fertilidad de las mujeres se ve afectada mucho antes que cualquier interrupción de los ciclos menstruales.
Eventos neuroendocrinos
El eje hipotálamo-hipófisis-reproductor sufre cambios considerables. Estas modificaciones son en parte secundarias a la disminución de la función ovárica, pero hay varias líneas de evidencia que sugieren que el cerebro sufre modificaciones funcionales independientes que son importantes para el envejecimiento reproductivo. De acuerdo a esta hipótesis, la menopausia puede equipararse a la pubertad, una época en la que un conjunto de procesos hipotalámicos también influye en el eje reproductor.
Antes del descenso de los estrógenos o la aparición de las irregularidades del ciclo en las mujeres de mediana edad, se nota un aumento de la FSH. Del mismo modo, en esta etapa se producen cambios en los patrones de secreción de la hormona luteinizante (LH), con pulsos más amplios y menos frecuentes. El trabajo experimental en roedores muestra que la desincronización de las señales neuroquímicas relacionadas con la edad, involucradas en la activación de las neuronas secretoras de GnRH, ocurre antes que los cambios en el ciclo estrogénico.
Varios neuropéptidos hipotalámicos y agentes neuroquímicos (por ej., el glutamato, la noradrenalina y el péptido vasoactivo intestinal) que impulsan el aumento de los estrógenos por la GnRH y la LH parecen amortiguarse con la edad o carecen de precisión para la coordinación temporal que se requiere para un patrón específico de la secreción de GnRH. La interrupción de este reloj biológico hipotalámico llevaría al deterioro progresivo en el momento del pico de la LH preovulatoria, que se sumaría a la escasa capacidad de respuesta ovárica que se encuentra en esta etapa reproductiva.
Cambios endocrinos durante la transición
Los cambios endocrinos al final de los años reproductivos dependen de la disfunción combinada de los ovarios y el nipotálamo. Una característica de la menopausia precoz es el acortamiento de la fase folicular y el aumento asociado de los niveles de FSH en la transición a la menopausia precoz, lo que representa intervalos de ciclos más cortos que los experimentados por muchas mujeres en este período de la vida.
Estudios de cohorte han demostrado que el acortamiento de la fase folicular está asociado con la ovulación acelerada que se produce con folículos más pequeños. La explicación que prevalece para este fenómeno es la pérdida de la producción de la inhibina B, lo que conduce a un aumento de la liberación de FSH y, por lo tanto, a una producción excesiva de estrógenos. Esto podría facilitar (y acelerar) que la LH alcance su pico.
Con el tiempo, las modificaciones hipotalámicas relacionadas con la edad determinan una disminución en la sensibilidad estrogénica y el incremento de la LH se torna más irregular. Los folículos también se vuelven menos sensibles a la gonadotrofina, lo que conduce a defectos de la fase lútea y la producción de ciclos anovulatorios, y en consecuencia, a las primeras irregularidades menstruales. La falta de sensibilidad hipotalámica a los estrógenos también explica porqué los síntomas de la menopausia─como los sofocos y sudores nocturnos─comúnmente ocurren en esta etapa, cuando las mujeres tienen niveles de estrógenos bastante elevados, y explica porqué los estrógenos exógenos son eficaces para reducir los síntomas.
En resumen, la menopausia natural es la consecuencia de la pérdida de la función ovárica. Este es el último paso en una cascada larga e irregular de eventos que tienen lugar tanto en el cerebro como en los ovarios. Los factores genéticos influyen en la sincronización de este proceso, pero aún se desconocen cuáles son las vías moleculares clave involucradas. Sería muy valioso identificarlas para desarrollar nuevas estrategias destinadas al tratamiento de la disfunción reproductiva y las enfermedades asociadas a la menopausia.
Síntomas y consecuencias
Síntomas de la menopausia
La mayoría de las mujeres que entran en la menopausia experimentan síntomas vasomotores. Un sofoco es un episodio repentino de vasodilatación en la cara y el cuello, que dura 1-5 minutos y se acompaña de sudoración profusa. Las mujeres que sufren estos sofocos tienen una zona termoneutral más estrecha, de modo que los cambios sutiles de temperatura central suscitan mecanismos termorreguladores, como la vasodilatación, la sudoración o los escalofríos. La disminución de los niveles de estrógenos e inhibina B, así como el aumento de los niveles de FSH, explican solo una parte de la alteración de la termorregulación, que se asocia con cambios en los neurotransmisores cerebrales y la reactividad vascular periférica.
Los sofocos se producen al final de la perimenopausia y los primeros años de la posmenopausia. Algunas mujeres, sin embargo, pueden seguir experimentando síntomas vasomotores hasta muchos años después de la menopausia. De vez en cuando, los sofocos se producen al final de los años reproductivos, o varios años después de la menopausia. La aparición e intensidad de los síntomas de la menopausia varían mucho entre las mujeres y dependen de factores genéticos, ambientales, raciales, del estilo de vida y antropométricos. La raza negra, el tabaquismo y el sobrepeso─en particular, la obesidad central–aumentan la prevalencia y gravedad de los síntomas vasomotores.
Los trastornos del sueño también son muy comunes durante la transición a la menopausia y se atribuyen principalmente a despertares frecuentes debido a la sudoración nocturna, y ocurren secundariamente a factores psicológicos. Los trastornos del humor como la depresión y la ansiedad no son causados por la menopausia; sin embargo, durante la transición, las mujeres vulnerables pueden tener su primer episodio o una recaída. Las mialgias y las artralgias también son parte de la sintomatología de la menopausia y están altamente correlacionadas con los sofocos y el humor depresivo.
Atrofia urogenital
La anatomía y la función del tracto genital femenino son estrógeno dependientes. Con la disminución de los estrógenos en la menopausia, los tejidos que recubren la vagina, la vulva, la vejiga y la uretra se atrofian, causando un conjunto de síntomas que incluyen la sequedad vaginal, las relaciones sexuales dolorosas (dispareunia), el prurito vulvar, el ardor y el malestar, así como infecciones urogenitales recurrentes. En conjunto, la atrofia vulvovaginal y la atrofia del tracto urinario secundarias a la falta de estrógenos son denominadas síndrome genitourinario de la menopausia.
A diferencia de los sofocos y los sudores nocturnos, que mejoran con el tiempo, los síntomas de la atrofia urogenital persisten a lo largo de la vida después de la menopausia y pueden tener un grave impacto en la salud sexual y la calidad de vida. La dispareunia secundaria a la atrofia vulvovaginal conduce a una disminución del deseo sexual, excitación dificultosa, problemas de relación y disminución de la satisfacción sexual, física y emocional.
Aunque la mayoría de las mujeres tiene signos de atrofia urogenital en el examen físico, menos de la mitad de la población posmenopáusica se queja de esas molestias. La edad, la actividad sexual, la etnia y las actitudes frente la menopausia influyen en la aparición y la gravedad de los síntomas urogenitales.
Osteoporosis
El hueso es un tejido dinámico que sufre la remodelación continua durante toda la vida. Este proceso comienza con la resorción ósea, la cual es llevada a cabo por células gigantes multinucleadas denominadas osteoclastos. La laguna creada por los osteoclastos se llena de osteoide─hueso nuevo no mineralizado por los osteoblastos─el cual luego es mineralizado para formar tejido óseo maduro. Los estrógenos regulan el acoplamiento de los procesos de resorción y formación ósea.
La disminución posmenopáusica de los estrógenos conduce a la desincronización de la remodelación ósea, lo que provoca una resorción excesiva. Más específicamente, la deficiencia estrogénica lleva a la producción excesiva de citocina RANKL (ligando del receptor activador del factor nuclear κB; también conocida como TNFSF11) por los osteoblastos que, tras la unión a su receptor RANK (también conocido como TNFRSF11A) en la superficie de los preosteoclastos y osteoclastos maduros promueve la osteoclastogénesis y reabsorción del hueso. La osteoprotegerina (OPG, también conocida como TNFRSF11B) es una citocina secretada por los osteoblastos respondiendo a la estimulación estrogénica y es un inhibidor natural de la RANKL72.
La deficiencia de estrógenos se asocia con una producción de OPG más baja, aumentando aún más la actividad de la RANKL. La disminución de la absorción intestinal de calcio relacionada con la edad, la deficiencia de vitamina D y el deterioro de la síntesis de 1,25-dihidroxivitamina D3 activa por el riñón conducen al hiperparatiroidismo secundario, que contribuye aún más a la reabsorción ósea acelerada.
Por último, la pérdida de la estimulación mecánica del esqueleto debido a la reducción de la actividad diaria y la pérdida de masa muscular esquelética pueden interactuar con la menor formación de hueso debido a la falta de regulación hacia abajo de la producción de esclerostina por los osteocitos, mediada por los estrógenos. Ambos procesos─aumento de la resorción ósea y disminución de la formación de hueso─provocan menor resistencia ósea y fracturas ante una carga esquelética mínima. Cuanto más baja es la edad de la menopausia, mayor es el riesgo de osteoporosis en el futuro.
Consecuencias metabólicas
La prevalencia de la obesidad es mayor en las mujeres posmenopáusicas que en las premenopáusicas, debido a un proceso multifactorial que implica un menor gasto energético por la inactividad física, que a veces se complica por la depresión y la atrofia muscular y una tasa metabólica basal más baja. Mientras que la menopausia por sí misma no se asocia a la ganancia de peso, la cual conduce al aumento de la grasa corporal total y a una redistribución de la grasa periférica hacia el tronco, provocando adiposidad visceral.
La obesidad abdominal y la disminución estrogénica de la menopausia se asocian con cambios metabólicos adversos como la resistencia a la insulina, la propensión al desarrollo de diabetes mellitus tipo 2 y dislipidemia, caracterizada por niveles elevados de triglicéridos, de colesterol lipoproteínas de alta densidad (HDL) bajos y mayor frecuencia de partículas de lipoproteínas de baja densidad (LDL) pequeñas. Es posible que el mecanismo que vincula la obesidad abdominal con sus consecuencias metabólicas sea la secreción de adipocina, causante de inflamación crónica.
Enfermedad cardiovascular
Más allá de los efectos beneficiosos sobre los parámetros metabólicos e inmunológicos, los estrógenos son hormonas vasoactivas potentes que promueven la remodelación y elasticidad vascular, y regulan la dilatación vascular reactiva y la actividad inflamatoria local. La deficiencia posmenopáusica de estrógenos conduce a la activación del sistema renina-angiotensina, la regulación hacia arriba del potente vasoconstrictor endotelina y el deterioro de la vasodilatación mediada por óxido nítrico.
El estrés oxidativo, que aumenta por la endotelina y la angiotensina II, puede fomentar el proceso aterosclerótico. Por lo tanto, enseguida de la menopausia, las mujeres presentan aumentos en la presión arterial, así como enfermedad vascular subclínica, la que se manifiesta por el aumento del espesor de la intima y la media de las arteria carótida y femoral, la acumulación de calcio en las arterias coronarias, la rigidez arterial y la alteración de la dilatación mediada por el flujo. Por lo general, las consecuencias clínicas de la enfermedad cardiovascular ocurren más tarde en las mujeres que en los hombres mientras que la cardiopatía isquémica en las mujeres suele manifestarse 10 años más tarde que en los hombres.
El riesgo de accidente cerebrovascular se duplica durante la primera década después de la menopausia y en última instancia, después de los 90 años supera al de los hombres. Sin embargo, estos eventos vasculares tienden a tener un pronóstico más grave en las mujeres que en los hombres. La menopausia precoz y la insuficiencia ovárica primaria se asocian con mayor riesgo de cardiopatía coronaria, accidente cerebrovascular y mortalidad.
Cognición
Los estrógenos actúan en las áreas del sistema nervioso central que controlan el aprendizaje, el registro y recuperación la información, el juicio, los procesos de evaluación y las habilidades lingüísticas. Estas áreas se refieren esencialmente a la corteza prefrontal, el hipocampo y el cuerpo estriado. Los estrógenos actúan a través de mecanismos genómicos y no genómicos. Aumentan las proteínas celulares, promoviendo el crecimiento y la supervivencia de las neuronas, la transmisión y función neuronal y también la sinaptogénesis.
Por otra parte, los estrógenos limitan la respuesta inflamatoria en el sistema nervioso central, que ayuda a evitar la repetición de los insultos inflamatorios que podrían dar lugar a la distrofia y propensión a la demencia. La mayoría de los estudios indican que la menopausia afecta la función cognitiva y, más específicamente, a los aspectos relacionados con la memoria verbal y la fluidez verbal. El tamaño del efecto parece ser pequeño.
Sin embargo, los cambios cognitivos suelen ser molestos para las mujeres afectadas. Aunque la menopausia parece estar asociada con cambios en la cognición, no se puede asumir que el tratamiento con estrógenos pueda prevenir el deterioro cognitivo. Hay un consenso general que la terapia estrogénica por vía oral no está indicada para prevenir o tratar el deterioro cognitivo.
Diagnóstico, detección y prevención
Factores de riesgo de menopausia precoz
La menopausia podría estar influenciada por la nutrición postnatal. La cohorte de mujeres británicas nacidas en 1946 que recibieron lactancia materna experimentaron la menopausia años más tarde que las que no fueron amamantadas, y las mujeres que tuvieron un peso bajo a los 2 años de edad tuvieron una menopausia precoz. Del mismo modo, las niñas holandesas que experimentaron una restricción calórica grave por la hambruna de 1944-1945 tuvieron una menopausia más temprana que las que no sufrieron esa carencia alimentaria. La evidencia para la relación entre la edad de la menarca y la edad de la menopausia es variada.
El estrés emocional a una edad temprana puede favorecer el envejecimiento reproductivo y hay pruebas de que las mujeres que han vivido el divorcio de sus padres a temprana edad tienden a tener una menopausia precoz. Algunos estudios también han comprobado que las mujeres que en la edad adulta tienen una posición socioeconómica más baja, lo que puede indicar un mayor grado de exposición al estrés, tienden a tener la menopausia antes que las mujeres de mejor posición, incluso después del ajuste por variables como el tabaquismo y la paridad.
Un estudio latinoamericano halló que las mujeres que viven en altitudes >2.000 metros también son más propensas a tener una menopausia precoz. Entre los diferentes estilos de vida y factores ambientales en la edad adulta que se han investigado para predecir la edad de la menopausia, solamente se asociaron a la menopausia precoz el tabaquismo y la paridad. Todavía no hay acuerdo en cuanto a si la cesación de fumar antes de la menopausia elimina este efecto; algunos estudios implican solamente al tabaquismo actual como un factor de riesgo de menopausia precoz, mientras que otros implican tanto al tabaquismo pasado como al presente. El tabaquismo actual tiene un efecto tóxico general sobre los folículos, presumiblemente mediado por hidrocarburos aromáticos policíclicos del humo del cigarrillo.
Actualmente, pero no en el pasado, el tabaquismo ha sido asociado también a niveles reducidos de AMH, que es un marcador de la reserva ovárica. Los acontecimientos vitales adversos, la infección por el VIH y el uso de drogas ilegales también han sido relacionados con la menopausia precoz, y en general, el consumo de alcohol y el café no muestran ninguna asociación. En algunos estudios, y no en todos, se comprobó que el uso de la píldora para el control de la natalidad se asocia con una edad ligeramente más tardía de la menopausia.
Una revisión sistemática reciente en la que no se hicieron ajustes estadísticos se halló una escasa asociación entre la actividad física moderada a intensa y la menopausia precoz, lo que no fue observado en un metaanálisis ajustado. El sobrepeso tuvo poca asociación con la menopausia más tardía. En varios estudios, el sobrepeso y la obesidad se han relacionado con una menopausia más tardía. En la premenopausia, el aumento de peso y la pérdida de peso episódica >5 kg se asocian con un menopausia más tardía. El índice de masa corporal (IMC) más elevado se asoció con mayor probabilidad de transición de la premenopausia a la perimenopausia, pero no de la perimenopausia a la posmenopausia. Cuando las mujeres no obesas transitan la menopausia tienden a tener una declinación más rápida del estradiol.
Diagnóstico clínico
A medida que las mujeres llegan al final de la transición menopáusica (etapa STRAW -2,-1), la duración de su ciclo menstrual aumenta a más de 60 días, convirtiéndose la mayoría en ciclos anovulatorios, produciéndose períodos de tiempo con poca o ninguna secreción estrogénica. Los síntomas de la menopausia empeoran en forma aguda. En este momento, muchos síntomas tienen su pico de intensidad y las mujeres pueden requerir tratamiento.
Se considera que una mujer está en la posmenopausia cuando tiene >45 años y ha pasado al menos 12 meses sin tener un período menstrual espontáneo. Para su diagnóstico no se requieren pruebas específicas, a menos que la presentación clínica sea atípica. Las presentaciones atípicas incluyen cambios de humor, ansiedad importante o fatiga de reciente aparición y artralgias, sin sofocos o sudores.
En las edades previas a la aparición de la amenorrea prolongada es necesario considerar otros diagnósticos, como el síndrome del ovario poliquístico, el hipogonadismo hipogonadotrófico secundario, la hiperprolactinemia, los tumores hipofisarios o los problemas uterinos como el síndrome de Asherman. Una mujer menopáusica que ha estado al menos 12 meses en amenorrea es poco probable que vuelva a tener otro período menstrual, pero puede ocurrir en el 10% de las mujeres.
Evaluación bioquímica
Aunque para hacer el diagnóstico específico de menopausia no se recomienda hacer ninguna prueba, pueden surgir situaciones clínicas en las que las pruebas sirven para documentar el fallo gonadal primario. Por lo general, para confirmar el diagnóstico es suficiente un nivel aumentado de FSH. Los cambios en la FSH, el estradiol o la inhibina B han sido bien documentados en una muestra de base poblacional de mujeres que participaron en estudios de observación.
La medición del estradiol durante la perimenopausia no es clínicamente útil. La primera hormona que disminuye es la inhibina B, y su descenso precede al aumento de la FSH1. El aumento compensatorio de la FSH hace que los folículos continúen creciendo y conduce a un acortamiento de la fase folicular del ciclo menstrual. Con el tiempo, los folículos se agotan y ya no se produce la foliculogénesis. Este es el momento en el que comienza el final de la transición a la menopausia.
Al final de la transición, la falla folicular es intermitente y finalmente es reemplazada permanentemente por la amenorrea. Una vez instalada la menopausia, los niveles de estradiol son bajos (<20 pg ml-1) y ya no se produce progesterona. Se destaca que no hay cambios agudos en los niveles de testosterona relacionados con la transición a la menopausia.
La AMH es un miembro de la superfamilia de las proteínas del factor de crecimiento transformador β (TGF) y se encuentra en las células de la granulosa del ovario y los ovocitos. La AMH podría ser útil para predecir el momento de la menopausia.
En un estudio de cohorte de 50 mujeres, las mediciones seriadas de AMH permitieron comprobar que una gota de AMH <0,05 ng ml-1 predijo la menopausia dentro de los 5 años siguientes. En general, la sensibilidad de las mediciones de la AMH en estudios publicados hasta la fecha no permite predecir cuál será el último período menstrual de una mujer, más allá de los criterios históricos sencillos y clínicos, como la edad y la duración de la amenorrea. El análisis del cambio de la AMH en el tiempo podría servir para perfeccionar la capacidad de los médicos para determinar prospectivamente cuándo ocurrirá la menopausia. En última instancia, con el desarrollo de un ensayo de AMH suficientemente sensible, se debería poder pronosticar cuál será el último período menstrual.
Diagnóstico por imágenes
Para pronosticar el momento de la falla ovárica permanente también se han propuesto otras mediciones como el recuento de folículos antrales (evaluado mediante la ecografía transvaginal), el registro de todos los folículos que miden ≤7 mm de diámetro (que generalmente se realiza al iniciarse la fase folicular del ciclo) y la reserva ovárica funcional, que se ha establecido como la prueba dinámica del ovario con un agente estimulante (el citrato de clomifeno o la FSH). Sin embargo, estos métodos predicen mejor la pérdida de la fertilidad que la menopausia en sí misma. La ecografía transvaginal es un método muy útil para evaluar el estado de fertilidad y puede proporcionar información sobre el envejecimiento del ovario.
La medición del número de folículos antrales puede dar información útil sobre la probabilidad de embarazo en las mujeres que están en edad reproductiva avanzada y desean concebir. Sin embargo, el recuento de folículos antrales no ha sido tan útil para predecir la menopausia. Se han propuesto otras mediciones para el ovario, como el volumen total y el grosor del estroma, pero actualmente carecen de la sensibilidad y especificidad adecuadas para ser clínicamente útiles.
Detección de la osteoporosis
La osteoporosis se define como la reducción de la densidad mineral ósea medida por absorciometría de rayos X de energía dual (DXA). Aunque la prevalencia estimada de osteoporosis es baja, durante la transición a la menopausia, hay una pérdida de la masa ósea vertebral media del 6,4% y del cuello del fémur del 5%.
Los datos disponibles no apoyan el cribado con DXA en las mujeres posmenopáusicas ≤60 años que todavía no tienen una afección médica identificable, ni utilizan medicamentos que se asocian con un riesgo mayor de osteoporosis o, no tienen antecedentes de fractura por un trauma leve. Al respecto, el American College for Preventive Practice ha recomendado que el cribado con DXA debe quedar limitado a las mujeres de 50 a 65 años con 1 factor de riesgo importante (menopausia antes de los 45 años o fracturas por fragilidad) o 2 factores de riesgo de menor importancia (tabaquismo o peso <57 kg). Sin embargo, en la actualidad se debate sobre cuáles son las mujeres <65 años que deben ser examinadas; no hay recomendaciones específicas universalmente aceptadas.
Un estudio reciente de mujeres de 40–65 años en las que se hizo el cribado para la osteoporosis mediante la DXA halló que los 3 predictores de osteoporosis más fuertes fueron: a) la posmenopausia, b) no usar hormonoterapia y, c) tener un IMC bajo.
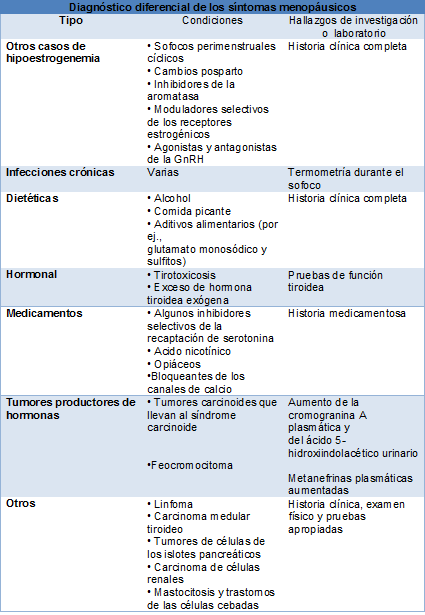
Diagnóstico diferencial de menopausia
Si una mujer es >50 años, ha dejado de menstruar y tiene los síntomas clásicos de deficiencia estrogénica, es muy poco probable que tenga otro diagnóstico diferente de la menopausia. En las mujeres más jóvenes y en las >50 años que tienen síntomas atípicos, se deben considerar otras causas de amenorrea: la enfermedad tiroidea, el prolactinoma, la depresión grave o el estrés y, la pérdida sustancial de peso. Cada una de estas condiciones puede estar asociada a síntomas vasomotores y cambios del humor. En el contexto de la amenorrea siempre se debe considerar el embarazo.
Si la presentación es atípica se deben excluir otras causas de síntomas vasomotores. Los sofocos hormonales provocan un aumento significativo de la temperatura central. Si una mujer registra un aumento de la temperatura bucal, sofocos o sudores nocturnos, se deberán investigar las causas infecciosas. La tirotoxicosis puede imitar a la menopausia, ya que las mujeres presentan agitación y ansiedad, trastornos del sueño, acaloramiento, sudoración y palpitaciones. Estos síntomas pueden preceder a los síntomas clásicos de tirotoxicosis, como la pérdida de peso y el temblor.
Una cuidadosa historia clínica y medicamentosa ayuda a identificar otras causas posibles. Los tumores carcinoides productores de serotonina pueden presentarse con diarrea nocturna y rubor episódico, sin sudoración. Los feocromocitomas liberan catecolaminas, adrenalina y noradrenalina, y se caracterizan por hipertensión persistente, enrojecimiento y sudoración profusa. Algunas mujeres pueden presentar oligomenorrea y cambios del humor o depresión. Se debe establecer el diagnóstico diferencial entre la depresión perimenopáusica, la depresión mayor y la disforia simple.
El diagnóstico de depresión mayor requiere experimentar al menos 2 semanas de depresión del ánimo o de pérdida de interés o placer en casi todas las actividades durante la mayor parte del día, casi todos los días, acompañado por lo menos de 4 de los siguientes síntomas: cambios en el apetito o el sueño, fatiga, agitación psicomotora o lentitud, sentimientos de inutilidad y/o culpa, concentración disminuida o indecisión, ideación suicida.
Por el contrario, la depresión perimenopáusica suele estar acompañada por irritabilidad, hostilidad o, agitación y ansiedad. Clínicamente, se asemeja a los cambios de humor del síndrome premenstrual, con estado de ánimo negativo, desvalorización y menor capacidad para afrontar los acontecimientos. Una característica distintiva es de la depresión de la perimenopausia es la labilidad, en contraste con la depresión del ánimo constante que se observa en la depresión mayor.
Factores que dificultan el diagnóstico
Aunque uno de los rasgos definitorios de la menopausia es la cesación de la menstruación, más ampliamente implica la detención definitiva de la función reproductiva del ovario. Por lo tanto, la definición tradicional no es útil en el entorno de las causas iatrogénicas de amenorrea, como la histerectomía, la ablación endometrial o los dispositivos intrauterinos con progestina.
Las investigaciones bioquímicas pueden estar indicadas en las mujeres con amenorrea iatrogénica (en particular, la medición de la FSH y el estradiol) y para las mujeres más jóvenes (medición de la AMH). Esta última es menos útil en las mujeres >50 años, ya que la mayoría de ellas tiene niveles de AMH bajos. Algunas mujeres pueden relatar síntomas vasomotores cuando utilizan anticonceptivos orales combinados. En este caso, solo se puede se puede hacer el diagnóstico correcto de menopausia si se detiene la anticoncepción oral durante varias semanas, después de lo cual se hará la evaluación clínica y bioquímica del estado de menopausia.
Cribado de la menopausia
Para el diagnóstico de menopausia no está indicado el cribado en la población. Sin embargo, las mujeres cada vez retrasan más la maternidad hasta sus últimos años reproductivos y muchas desean saber cuándo es probable que se produzca la menopausia. Junto con la edad, los niveles séricos de AMH proporcionan una buena indicación. Tehrani et al. han informado que para predecir la menopausia se puede usar una combinación de la edad y los niveles séricos de AMH para hacer una ecuación matemática.
En su análisis, la edad por sí sola tuvo una adecuación del 84% en la predicción de la edad de la menopausia, lo que se elevó a 92% cuando a su modelo se agregaron los niveles de AMH. El uso de la AMH para predecir la menopausia todavía tiene varias limitaciones. Por ejemplo, los ensayos de AMH aún no se han estandarizados y no son lo suficientemente sensibles para predecir la menopausia con gran precisión. La disminución de la AMH puede estar acelerada por factores como el tabaquismo y algunas situaciones clínicas─hipogonadotrofismo, obesidad─que se asocian con niveles de AMH normales o bajos y que no reflejan el déficit verdadero de la reserva ovárica funcional. Por lo tanto, todavía falta establecer cuál es la precisión de la AMH para estimar el momento del inicio de la menopausia en forma individual.
Un grupo de mujeres portadoras del gen X frágil puede beneficiarse de la detección de la disminución de la reserva ovárica─es decir, la detección de la menopausia inminente─midiendo de la AMH. La mutación FMR1 afecta aproximadamente a 1/200 mujeres; aproximadamente el 20% de las afectadas experimentará una falla ovárica precoz. En todas las edades, las portadoras de la mutación FMR1 tienen niveles más bajos de AMH que las otras mujeres. Aunque se ha sugerido que el monitoreo de la función ovárica es apropiado para las mujeres portadoras de la mutación FMR1, es muy difícil delimitar exactamente cuándo se producirá el fallo ovárico. Si bien se han publicado los valores de la AMH en las portadoras de la mutación FMR1, su aplicación clínica aún no ha quedado establecida.
Prevención de la menopausia
El concepto de que la menopausia es inevitable se basa en que las hembras humanas tienen una reserva ovárica de ovocitos fija al nacer y que el número de ovocitos disminuye con la edad. En los años reproductivos posteriores, la calidad de ovocitos disminuye, de manera que la fertilización y las tasas de nacidos vivos caen, y el riesgo de defectos de nacimiento y abortos involuntarios aumenta.
Un grupo de investigadores ha identificado células madre ovogoniales en el tejido cortical ovárico de las mujeres jóvenes. Esto da lugar a la hipótesis que las células germinales del ovario humano se renuevan durante los años reproductivos, e incluso que puede haber células que podrían ser utilizadas para extender la vida reproductiva, y retrasar o prevenir la menopausia eficazmente. El hallazgo de las células madre ovogoniales en los ovarios humanos es controvertido y aún no ha sido replicado por otros grupos.
Traducción y resumen objetivo: Dra. Marta Papponetti
Segunda parte: Prevención y abordaje terapéutico