Seguridad de vacuna COVID-19 Pfizer/BioNTech BNT162B2
El Instituto de Investigación Clalit, en colaboración con investigadores de la Universidad de Harvard, analizó una de las bases de datos integradas de registros de salud más grandes del mundo para examinar la seguridad de la vacuna Pfizer / BioNTech BNT162B2 contra COVID-19.
El estudio proporciona la mayor evaluación revisada por pares de la seguridad de una vacuna COVID-19 en un entorno de vacunación masiva a nivel nacional. El estudio se realizó en Israel, uno de los primeros líderes mundiales en tasas de vacunación COVID-19.
Los esfuerzos anteriores para caracterizar la seguridad de las vacunas se han basado en informes activos voluntarios por parte de los individuos vacunados, que se sabe que son incompletos. El presente estudio se basa en el análisis de millones de registros médicos electrónicos anonimizados, que son mucho más completos.
Además, con el fin de proporcionar el contexto necesario para interpretar los hallazgos de seguridad de las vacunas, este estudio es el primero en examinar una amplia gama de eventos adversos tanto entre individuos vacunados como entre individuos no vacunados que fueron infectados con el coronavirus. Por lo tanto, se realizaron dos análisis separados:
Análisis de resultados de vacunación: 884.828 individuos vacunados de 16 años o más fueron cuidadosamente emparejados con 884,828 individuos no vacunados en base a un extenso conjunto de atributos sociodemográficos, geográficos y relacionados con la salud. Las personas se asignaron a cada grupo de forma dinámica en función de su estado de vacunación cambiante (235.541 personas pasaron de la cohorte no vacunada a la cohorte vacunada durante el estudio). Se compararon las tasas de los 25 eventos adversos potenciales dentro de las tres semanas posteriores a cualquiera de las dosis de vacuna entre los dos grupos. Este análisis tuvo lugar desde el 20 de diciembre de 2020, el lanzamiento de la campaña nacional de vacunación de Israel, hasta el 24 de mayo de 2021.
Análisis de resultados de infección: para proporcionar contexto para los hallazgos de seguridad de la vacuna anteriores, se realizó un análisis separado que estimó las tasas de los mismos 25 eventos adversos potenciales entre 173.106 personas no vacunadas que estaban infectadas con el coronavirus, en comparación con 173.106 controles cuidadosamente emparejados que no lo estaban. infectado con el coronavirus. Este análisis tuvo lugar desde el 1 de marzo de 2020 (el comienzo de la pandemia de COVID-19 en Israel) hasta el 24 de mayo de 2021.
Se encontró que la vacuna era segura: de los 25 posibles efectos secundarios examinados, se encontró que 4 tenían una fuerte asociación con la vacuna.
Se encontró que la miocarditis estaba asociada con la vacuna, pero rara vez: 2,7 casos en exceso por cada 100.000 personas vacunadas. (Los eventos de miocarditis observados después de la vacunación se concentraron en hombres de entre 20 y 34 años). Por el contrario, la infección por coronavirus en individuos no vacunados se asoció con un exceso de 11 casos de miocarditis por cada 100.000 individuos infectados.
Otros eventos adversos moderadamente asociados con la vacunación fueron inflamación de los ganglios linfáticos, un efecto secundario leve que es parte de una respuesta inmune estándar a la vacunación, con 78 casos en exceso por 100.000, apendicitis con 5 casos en exceso por 100.000 (potencialmente como resultado de la inflamación de los ganglios linfáticos alrededor del apéndice) y herpes zoster con un exceso de 16 casos por 100.000.
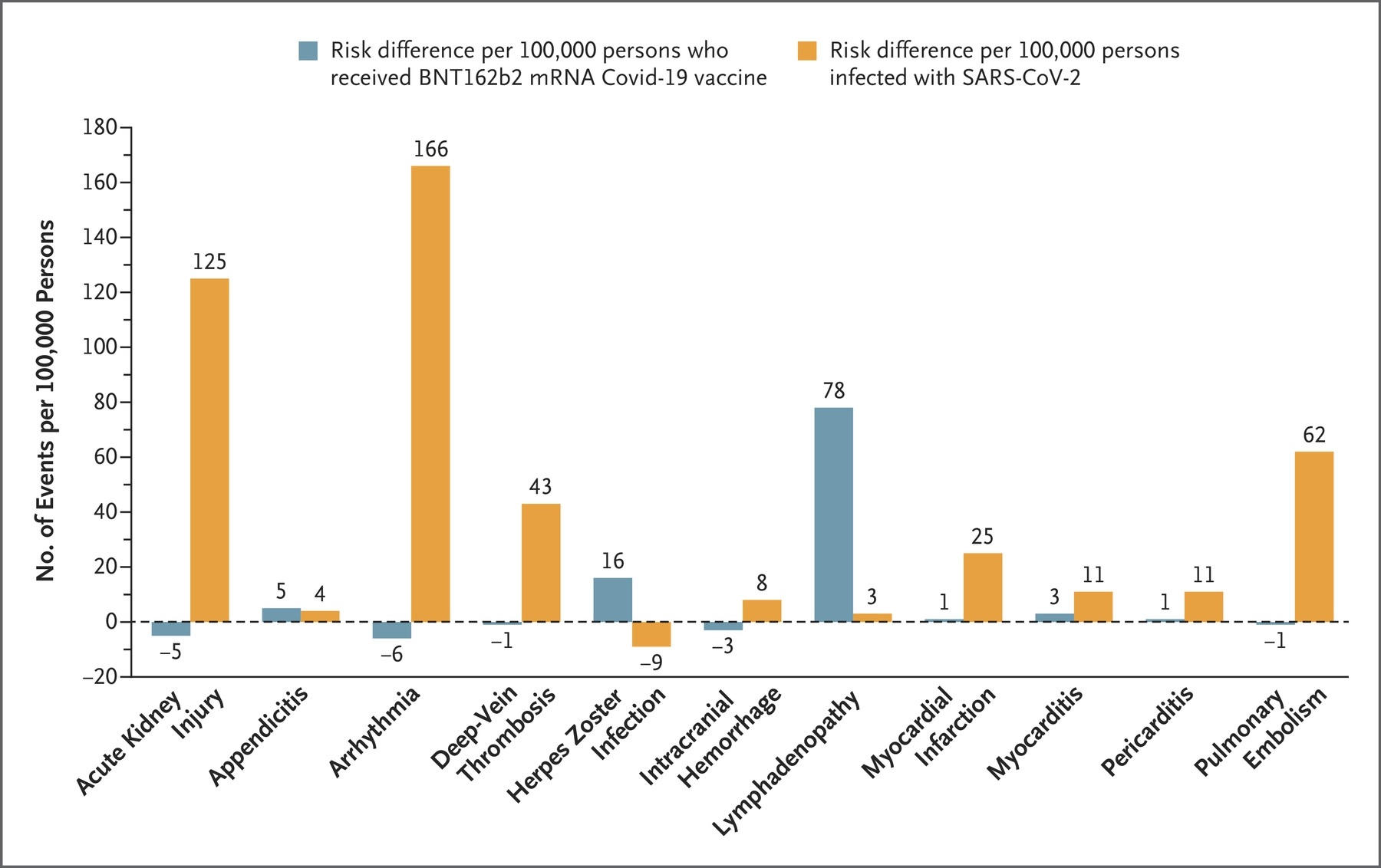
Exceso absoluto de riesgo de diversos eventos adversos después de la vacunación o la infección por SARS-CoV-2. Se muestran estimaciones puntuales de las diferencias de riesgo para eventos adversos seleccionados. Las estimaciones se obtuvieron 42 días después de la vacunación o la infección por SARS-CoV-2 con el uso del estimador de Kaplan-Meier. Las diferencias de riesgo se muestran por cada 100.000 personas y se redondean al número entero más cercano. Las diferencias negativas (riesgo reducido) se representan como valores negativos en el eje y, y las diferencias positivas (riesgo aumentado) se representan como valores positivos en el eje y. La abreviatura mRNA denota RNA mensajero.
En contraste con el número relativamente pequeño de efectos adversos asociados con la vacuna, las altas tasas de múltiples eventos adversos graves se asociaron con la infección por coronavirus entre los pacientes no vacunados, que incluyen: Arritmias cardíacas (un aumento de 3.8 veces a un aumento de 166 casos por 100,000 infectados pacientes), daño renal (aumento de 14,8 veces; 125 casos en exceso por 100.000), pericarditis (aumento de 5,4 veces; 11 casos en exceso por 100.000), embolia pulmonar (aumento de 12,1 veces; 62 casos en exceso por 100.000), trombosis venosa profunda (aumento de 3,8 veces; 43 casos en exceso por 100.000), infarto de miocardio (aumento de 4,5 veces; 25 casos en exceso por 100.000) y accidente cerebrovascular (aumento de 2,1 veces; 14 casos en exceso por 100.000).
Este estudio se centró en los eventos adversos que pueden desarrollarse a corto o medio plazo después de la vacunación y aquellos con importancia clínica. El estudio no se centró en los síntomas inmediatos comunes, como enrojecimiento y malestar en el lugar de la inyección o fiebre. Los síntomas que ocurrieron dentro de las 6 semanas de la vacuna (tres semanas después de cada dosis de vacuna) se definieron como un evento adverso de la vacuna si ocurrieron con mayor frecuencia entre el grupo vacunado en comparación con el grupo de control.
Los resultados de este estudio validan y complementan los hallazgos previamente informados del ensayo clínico aleatorizado de fase III de Pfizer / BioNTech, que, con 21.720 personas vacunadas, no pudo evaluar de manera precisa y completa la seguridad de la vacuna. El gran tamaño del presente estudio permite una evaluación más detallada de la seguridad de la vacuna en una gama más amplia de eventos adversos.
|
Conclusiones En este estudio en un entorno de vacunación masiva a nivel nacional, la vacuna BNT162b2 no se asoció con un riesgo elevado de la mayoría de los eventos adversos examinados. La vacuna se asoció con un riesgo excesivo de miocarditis (de 1 a 5 eventos por cada 100.000 personas). |
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.






