La testosterona en las mujeres

Introducción
La testosterona es una hormona femenina importante pero enigmática. Actúa directamente como un andrógeno, además de ser un precursor obligado de la biosíntesis del estradiol. El control de la producción de testosterona en la mujer no es bien conocido debido a que no se ha descrito un mecanismo de retroalimentación que regule su producción. La testosterona ejerce efectos fisiológicos en los tejidos reproductivos y no reproductivos femeninos. Las concentraciones de la hormona se asocian positivamente con la función sexual, y muchos estudios aleatorizados y controlados con placebo han mostrado que puede ser un tratamiento eficaz para la disfunción sexual femenina.
Fisiología de los andrógenos
Durante los años reproductivos, en las mujeres la testosterona es producida por los ovarios y por la conversión periférica de la androstenediona y el sulfato de dehidroepiandrosterona (SSDHEA), que son preandrógenos sintetizados por los ovarios y las glándulas suprarrenales. En las mujeres premenopáusicas, los preandrógenos contribuyen aproximadamente al 50% de la testosterona circulante.
Primero, las concentraciones de testosterona comienzan a aumentar en las niñas entre los 6 y 8 años, cuando la maduración de la zona reticularis adrenal da lugar a la mayor producción de SDHEA, anunciando el inicio de la adrenarquia. La producción cíclica de testosterona por los ovarios comienza con la aparición de la ovulación; las concentraciones llegan a un pico máximo en la mitad del ciclo y se mantienen elevadas durante la fase lútea.
También se ha documentado una variación diurna, caracterizada por concentraciones más elevadas a la mañana. Las concentraciones máximas de testosterona ocurren en la tercera y cuarta décadas de la vida, seguidas por una disminución constante tanto de la testosterona como de sus precursores, a medida que la edad avanza.
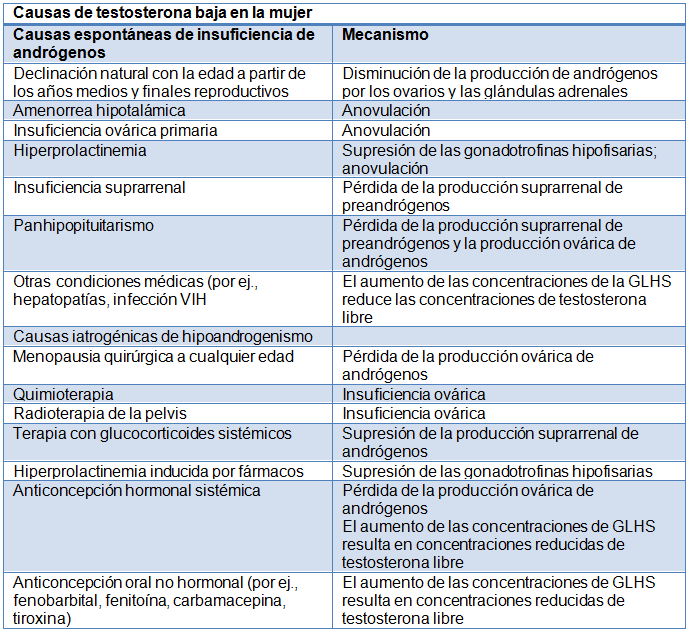
La disminución fisiológica de la testosterona con la edad no está relacionada con la menopausia natural. Se desconoce cuál es la razón de esta declinación pero lo más probable es que se deba a la menor producción derivada de la hipofunción de los ovarios y las glándulas suprarrenales.
Las principales características de la fisiología de la testosterona dan cuenta de su papel en las mujeres. La enzima 5α-reductasa metaboliza la testosterona periféricamente en los tejidos blanco dando lugar a la dihidrotestosterona (DHT), que es el andrógeno más potente y también es el que más afinidad tiene para unirse al receptor de andrógenos.
Dentro de las células, la DHT se vuelve a metabolizar de modo que las concentraciones de sus metabolitos proporcionan un índice de la exposición del tejido a los andrógenos. La aromatización de la testosterona a estradiol se produce en los ovarios y los tejidos extragonadales, siendo estos últimos la fuente principal de producción de estrógenos después de la menopausia.
La testosterona circulante se une fuertemente a las proteínas plasmáticas ─casi el 66% se une a las globulinas ligadas a las hormonas sexuales (GLHS) y el 33% a albúmina. La fracción libre de la testosterona se determina por la tasa de producción de testosterona, la tasa de depuración metabólica y el nivel de GLHS. Las bajas concentraciones de GLHS llevan al aumento del clearence de la testosterona circulante; mientras que las concentraciones elevadas resultan en un clearence disminuido.
La testosterona circula en concentraciones nanomolares en las mujeres de todas las edades y aunque este nivel es mayor que el de las concentraciones picomolares del estradiol, la medición de las concentraciones de testosterona sérica en las mujeres ha estado limitada por la imprecisión de los ensayos, la gran variabilidad que hay entre ellos y las bajas concentraciones observadas en ellas.
El método más sensible para medir las concentraciones de esteroides sexuales es la cromatografıa líquida por espectrometría de masa en tándem (CL-EMT), que alimentó la esperanza de conseguir mayor precisión y confiabilidad, pero en el rango relevante de la fisiología femenina la variabilidad entre ensayos de la CL-EMT es muy importante.
Por otra parte, gran parte de la acción de la testosterona es el resultado del metabolismo intracelular, por lo que las concentraciones séricas solas no son un buen índice de la exposición tisular. La sensibilidad a nivel del receptor de andrógenos determina por sí sola la respuesta del individuo a un determinado nivel de testosterona. Por tanto, en la práctica clínica, las concentraciones de testosterona sérica son un tanto arbitrarias y siempre deben interpretarse según la presentación y la evaluación clínica.
.jpg)
Relación entre la testosterona y la función sexual femenina
La naturaleza multifactorial de la función sexual de la mujer, la gama de enfoques utilizados para medir la disfunción sexual femenina y los inconvenientes para medir la testosterona, sus precursores y sus metabolitos, han complicado esta especialidad. A pesar de estas limitaciones, grandes estudios transversales y longitudinales han hallado asociaciones consistentes entre los andrógenos y la función sexual femenina.
Es importante destacar que la función sexual no está relacionada con los cambios en las concentraciones circulantes de andrógenos en la menopausia o la posmenopausia temprana, ya que las concentraciones sanguíneas de andrógenos no cambian durante la transición menopáusica; en cambio, existen asociaciones entre los andrógenos específicos y las medidas auto reportadas de la función sexual, tanto en las mujeres premenopáusicas como en las posmenopáusicas.
Los resultados de un estudio de 1.021 mujeres sanas de la comunidad, reclutadas al azar, mostraron una asociación directa entre un nivel androgénico de SDHEA por debajo del percentilo 10 y la hipofunción sexual en mujeres ≥45 años.
En las mujeres de 18 a 44 años, las concentraciones de SDHEA por debajo del percentil 10 se asociaron directamente con menor deseo sexual, excitación y sensibilidad. No se hallaron asociaciones con la androstenediona o la testosterona total y libre.
Un estudio pequeño de mujeres que consultaron por disfunción sexual en una clínica especializada no halló ninguna asociación entre la testosterona endógena y la disfunción sexual femenina. Sin embargo, el estudio careció de elementos importantes para este resultado.
Posteriormente, un estudio longitudinal prospectivo de 3.266 mujeres de 42 a 52 años halló concentraciones concurrentes de las hormonas sexuales con la función sexual. La medición principal fue la frecuencia de la masturbación ─una función sexual que no depende de la pareja. La testosterona endógena se asoció con la frecuencia la masturbación, el deseo sexual y la excitación mientras que el SDHEA se asoció positivamente con la frecuencia de la masturbación y el deseo.
Un estudio danés de 560 mujeres sanas de la comunidad, de 19 a 65 años, en quienes los esteroides sexuales se midieron por CL-EMT y el deseo sexual mediante el Female Sexual Function Index (Índice de Función Sexual Femenina); después de hacer el ajuste por la edad las concentraciones de testosterona endógena total y libre, de androstenediona y del SDHEA se asociaron con el deseo sexual. Estudios de observación han hallado una asociación más estrecha entre la frecuencia de la masturbación y el deseo sexual y las concentraciones endógenas de testosterona total y libre y sus precursores.
Como modelo para estudiar el efecto de una reducción abrupta de las concentraciones de testosterona sobre la función sexual se ha utilizado la menopausia quirúrgica. Esencialmente, los resultados de estudios de observación de mujeres con menopausia quirúrgica por etiologías benignas han sido variados. El bienestar sexual preoperatorio predice la función sexual postoperatoria; no hubo correlación entre el deseo sexual postoperatorio y las concentraciones de andrógenos.
Las limitaciones de este modelo son que las concentraciones de todos los esteroides sexuales se reducen con la menopausia quirúrgica y el cuadro se complica debido a la cirugía, incluyendo la consiguiente infertilidad en las mujeres jóvenes. Las asociaciones positivas entre las concentraciones de andrógenos y el deseo sexual y la excitación en las mujeres indican la posibilidad de que las mujeres con pérdida del deseo sexual y la excitación se beneficien con el tratamiento con testosterona.
De acuerdo con el Diagnostic and Statistical Manual of Mental Disorders IV (DSM), el trastorno de deseo sexual hipoactivo es la ausencia de fantasías sexuales y el deseo de actividad sexual que provoca angustia en la mujer. Este diagnóstico motivó la investigación de los últimos 20 años sobre la eficacia de la testosterona exógena como tratamiento de la disfunción sexual femenina, específicamente el deseo sexual hipoactivo. En el DSM-V, el trastorno de deseo sexual hipoactivo ha sido fusionado con el trastorno de la excitación sexual femenina y ha sido rebautizado como trastorno de la excitación y el deseo sexual femenino, el cual sigue basado principalmente en el deseo sexual.
Debido a que el deseo sexual hipoactivo puede ser evaluado mediante cuestionarios validados y hasta la fecha ha sido el resultado primario de todos los ensayos clínicos de la terapia con testosterona, los médicos siguen utilizándolo como diagnóstico clínico.
Muchos trabajos aleatorizados y controlados han demostrado que la administración de testosterona mediante el implante subcutáneo, la inyección intramuscular, el parche transdérmico, el gel o la vía oral (para la metiltestosterona), con y sin estrógeno simultáneo, es efectiva para el tratamiento del trastorno de deseo sexual hipoactivo en las mujeres con menopausia natural o quirúrgica.
Con estos resultados, la guía de la Endocrine Society expresa que "la evidencia apoya la eficacia y la seguridad a corto plazo de altas dosis fisiológicas de testosterona para las mujeres posmenopáusicas con disfunción sexual por trastorno del deseo sexual hipoactivo".
La guía también recomienda considerar un ensayo terapéutico de 6 meses con testosterona transdérmica para las mujeres con diagnóstico de trastorno del deseo sexual hipoactivo según el DSM-IV. Como los autores describen a continuación, muchos de estos estudios han contribuido a conocer los efectos de la testosterona sobre otros resultados en la salud.
Testosterona y salud vaginal
Tradicionalmente, la atrofia vulvovaginal es tratada con dosis bajas de estrógenos por vía vaginal, un tratamiento altamente eficaz y seguro. Como para algunas mujeres la terapia con estrógenos vaginales está contraindicada (por ej., mujeres con cáncer de mama tratadas con inhibidores de la aromatasa), se ha propuesto el uso de la testosterona intravaginal.
Se han identificado receptores de andrógenos en la mucosa vaginal, la submucosa, el estroma, el músculo liso y el endotelio vascular. La densidad de los receptores androgénicos en estos tejidos disminuye con la edad, aunque la expresión vaginal de los genes de receptores de andrógenos aumenta con la administración de testosterona. La aromatasa, la enzima que convierte la testosterona en estradiol, y los isótopos 1 y 2 de la 5α-reductasa, que convierten a la testosterona en DHT, también están presentes en el tejido vaginal.
Varios estudios han investigado el uso de la testosterona intravaginal en las mujeres posmenopáusicas sin cáncer de mama. Se ha demostrado que en las mujeres posmenopáusicas el propionato de testosterona intramuscular induce la proliferación del epitelio vaginal.
Un estudio aleatorizado y controlado de 75 mujeres posmenopáusicas con síntomas de atrofia vaginal y disfunción sexual comparó la acción de 1 mg de testosterona más 0,625 mg de estrógeno equino conjugado por vía vaginal con 0,625 mg de estrógeno equino conjugado por vía vaginal solo, o placebo. Los mejores resultados en la mejoría de la atrofia vaginal y la función sexual se observaron con el estrógeno equino conjugado combinado con testosterona.
En otro estudio, 80 mujeres posmenopáusicas sanas fueron elegidas al azar para recibir 0,625 mg de estrógeno equino conjugado en crema, 300 µg de propionato de testosterona, ácido poliacrílico o placebo, 3 veces/intravaginal, durante 12 semanas.
En comparación con el placebo, la testosterona intravaginal se asoció con una mejoría significativa del deseo sexual, la lubricación, la satisfacción y la dispareunia, mientras que los estrógenos equinos conjugados lograron una mejoría significativa en el deseo sexual.
Los efectos favorables de la testosterona en estos estudios podrían ser el resultado de la aromatización local de la testosterona a estradiol. Un pequeño estudio piloto de Witherby y col. de etiqueta abierta mostró efectos favorables de la testosterona intravaginal en mujeres posmenopáusicas con cáncer de mama que estaban recibiendo inhibidores de la aromatasa.
Las medidas objetivas y subjetivas de la vaginitis atrófica mejoraron y las concentraciones de estradiol sérico, medidas por radioinmunoensayo altamente sensible, se mantuvieron indetectables en la mayoría de las mujeres.
Estos estudios son esperanzadores pero están limitados por su pequeñez. El estudio abierto de Witherby y col. sugiere que para que la testosterona mejore la atrofia vaginal no es necesaria la aromatización a estradiol. Sin embargo, se necesitan más estudios antes de que en el entorno clínico la testosterona vaginal pueda ser considerada para el tratamiento de la atrofia vulvovaginal de las mujeres con o sin cáncer de mama.
Testosterona y enfermedad cardiometabólica
Se ha postulado que las hormonas sexuales representan un papel importante en el desarrollo y la evolución de las enfermedades cardiovasculares, principalmente los estrógenos en las mujeres. La creencia general es que la testosterona aumenta el riesgo de enfermedad cardiovascular, pero en una revisión sistemática, Spoletini y col. concluyeron que la presencia de un estado hipoandrogénico en las mujeres es perjudicial para la salud cardiovascular.
En concentraciones fisiológicas, la testosterona tiene efectos favorables en el tono vasomotor, la función endotelial y la resistencia vascular periférica, a través de efectos directos sobre la pared de los vasos sanguíneos. La testosterona mejora la función arterial en las mujeres al mejorar la vasodilatación de la arteria braquial, tanto la dependiente del endotelio (mediada por el flujo) como la independiente del endotelio. En investigaciones in vitro, el efecto independiente sobre el endotelio parece ser independiente de la aromatasa.
En apoyo de este concepto, Worboys y col. informaron que la testosterona exógena mejoró la dilatación arterial después de trinitrato de glicerilo (dilatación independiente del endotelio)─un efecto no observado con la terapia con estradiol exógeno. En su mayoría, los datos de estudios de observación muestran una relación inversa entre la testosterona endógena y el riesgo de enfermedad cardiovascular.
Se desconoce si la testosterona endógena protege contra la enfermedad cardiovascular (es decir, la cardiopatía isquémica y el ictus isquémico), la muerte por enfermedad cardiovascular y la mortalidad general.
Los estudios informados tienen las siguientes limitaciones: son limitados en este campo, sobre todo en el grupo de mujeres mayores: muestras pequeñas, reclutamiento de conveniencia, muestras basadas en la clínica, diseños de casos y controles e intervalos prolongados entre el momento de la extracción de la sangre y los eventos cardiovasculares. De hecho, en un estudio longitudinal de Laughlin y col., las concentraciones bajas de testosterona endógena tuvieron un efecto adverso sobre el riesgo de enfermedad cardiovascular, mientras que los hallazgos reportados por Benn y col. revelaron efectos adversos sobre el riesgo de enfermedad cardiovascular con las concentraciones elevadas de testosterona endógena (por encima del percentilo 95); cada uno informó la aparición de eventos, décadas después de la extracción de sangre realizada para medir las concentraciones de esteroides sexuales.
En el estudio publicado por Laughlin y col., las concentraciones bajas de testosterona biodisponible y total se asociaron con una mayor incidencia de eventos cardiovasculares. Los datos reportados por Benn y col. son difíciles de conciliar, porque la concentración media de la testosterona total en las mujeres mayores fue la misma que la de las mujeres más jóvenes (1,9 nmol/l), siendo el rango inusualmente elevado para todas las mujeres.
Tampoco hallaron diferencias en las concentraciones de testosterona con la edad, lo que no coincide con los hallazgos de los estudios previos, lo que plantea dudas acerca de las concentraciones registradas. Las mujeres en el percentilo quinto superior de la testosterona al inicio del estudio (en este caso mujeres de 49 a 65 años) estaban en mayor riesgo de enfermedad cardiovascular posterior. Para que estas mujeres se encuentren en el extremo superior del percentilo quinto debieron haber tenido concentraciones extremadamente elevadas de testosterona, de manera que se podría sospechar la presencia del síndrome del ovario poliquístico u otra causa de exceso de andrógenos.
Independientemente de los factores de riesgo, la asociación entre las concentraciones de testosterona bajas, la mayor mortalidad general y los eventos cardiovasculares hallada en las mujeres del estudio de Sievers y col. (edad media 58 años) también se acepta para las mujeres de mediana edad.
Un estudio pequeño utilizó un método sensible de CL-MST para medir las concentraciones de testosterona. Ningún estudio informó sobre la asociación entre la DHT o cualquier testosterona o metabolito de la DHT y el riesgo de enfermedad cardiovascular. El único estudio que reportó como resultado al accidente cerebrovascular isquémico incluyó a 39 pacientes y no mostró ninguna asociación significativa con la testosterona.
La asociación entre la testosterona endógena y el riesgo de enfermedad cardiovascular no puede ser interpretada sin tener en cuenta los efectos del SGLH y los estrógenos, pero algunos estudios, para considerar el estradiol han utilizado las concentraciones de la GLHS.
Panel: teniendo en cuenta la GLHS
En las mujeres, la testosterona suele ser considerada cuando sus concentraciones se hallan en exceso y en presencia del síndrome del ovario poliquístico. La hiperinsulinemia, el exceso de andrógenos y el síndrome metabólico caracterizan al síndrome del ovario poliquístico. Una característica distintiva del síndrome del ovario poliquístico es la baja concentración de GLHS que, a su vez, se asocia a un riesgo más elevado de enfermedad cardiovascular observado en este trastorno.
Hay mucha evidencia que muestra que la GLHS es metabólicamente importante y no simplemente una proteína de transporte de los esteroides sexuales. Se ha convertido en un marcador independiente de resistencia a la insulina y riesgo de diabetes tipo 2, y ha sido implicada en la patogénesis de la diabetes tipo 2 y la enfermedad cardiovascular en las mujeres. Hay una estrecha asociación independiente e inversa estadísticamente de alta significancia entre la resistencia a la insulina y la GLHS, y entre el índice de masa corporal (IMC) y la GLHS. Estas asociaciones son independientes del estrógeno endógeno y las concentraciones de andrógenos.
En las mujeres posmenopáusicas, las concentraciones bajas de GLHS (no así las concentraciones elevadas de testosterona total) se asocian significativamente con un perfil lipídico más adverso (concentraciones de triglicéridos elevadas y concentraciones de HDL colesterol bajas), la acumulación de grasa visceral y mayor riesgo de diabetes.
"Las concentraciones bajas de GLHS son un factor de riesgo independiente de resistencia a la insulina, diabetes tipo 2 y perfil lipídico adverso en las mujeres jóvenes y de mediana edad"
Se comprobaron estrechas asociaciones inversas entre la GLHS y la proteína C reactiva, y entre la GLHS y la presión diastólica, en las mujeres posmenopáusicas después del ajuste por otras variables. Los polimorfismos de nucleótidos solos (PNS) en el gen de la GLHS se asocian con variaciones en las concentraciones de la GLHS. Sin embargo, las variantes del PNS explican solo el 2% de la varianza de la GLHS. Casi el 34% de la varianza en las mujeres posmenopáusicas puede explicarse por la resistencia a la insulina, el IMC y la presión arterial diastólica. La acumulación de grasa en el hígado podría modular la producción hepática de la GLHS por un mecanismo independiente de la insulina.
Por otra parte, las concentraciones fisiológicas de fructosa y glucosa suprimen la producción de la GLHS en los modelos animales; la fructosa en la dieta tiene un efecto muy marcado. La asociación entre la resistencia a la insulina y la GLHS desaparece después de hacer el ajuste teniendo en cuenta el hígado graso, lo que no ocurre con la asociación inversa entre la GLHS y la glucemia en ayunas. Coincidiendo con esto, la intervención en la dieta para reducir la grasa hepática se asocia con un aumento de la GLHS, un efecto que parece ser independiente de la resistencia a la insulina.
En las mujeres posmenopáusicas, el índice de andrógeno libre (IAL, calculado como testosterona total ÷ GLHS × 100), pero no la testosterona total, se asocia con el síndrome metabólico y un mayor riesgo de enfermedad cardiovascular. Por lo tanto, las concentraciones de GLHS y no las de testosterona explican la asociación entre el IAL y la fracción plasmática de testosterona libre ─y otros esteroides sexuales─ pero las concentraciones bajas de GLHS son un factor de riesgo independiente de resistencia a la insulina, diabetes tipo 2 y perfil lipídico adverso en las mujeres jóvenes y de mediana edad.
En general, los datos de observación disponibles indican que las concentraciones bajas de testosterona total, testosterona libre y testosterona biodisponible (libre y unida a la albúmina) y la GLHS sérica se asocian con una mayor probabilidad de enfermedad carotídea aterosclerótica, eventos cardiovasculares y mortalidad total. Por otra parte, las concentraciones extremadamente elevadas de testosterona endógena biodisponible también parecen aumentar el riesgo futuro de enfermedad cardiovascular en las mujeres.
Ensayos aleatorizados y controlados han demostrado que la testosterona transdérmica no tiene efectos negativos conocidos sobre el riesgo cardiovascular femenino, como los lípidos, la proteína C reactiva, el hematocrito, las proteínas de la coagulación y la resistencia a la insulina. En general, los ensayos aleatorizados y controlados del tratamiento con testosterona no han mostrado ningún incremento en la enfermedad arterial coronaria, accidente cerebrovascular o trombosis, aunque ninguno de los estudios se dedicó adecuadamente a investigar los efectos de la testosterona sobre los eventos cardiovasculares mayores.
Iellamo y col. informaron sobre los efectos la terapia con testosterona en un ensayo aleatorizado y controlado en el que 36 mujeres con enfermedad cardiovascular preexistente (insuficiencia cardíaca congestiva grave) fueron asignadas al azar para recibir tratamiento con testosterona transdérmica o placebo durante 6 meses.
Las mujeres tratadas con testosterona tuvieron una mejoría significativa de la prueba de la caminata de 6 min, el consumo de oxígeno y la resistencia a la insulina, comparadas con el grupo que recibió placebo; también mostraron un mejor rendimiento en cada una de estas pruebas, con mejor pronóstico para la insuficiencia cardiaca congestiva. Este estudio no significa que las mujeres con insuficiencia cardíaca congestiva deben ser tratadas con testosterona sino más bien apoya la necesidad de una mejor comprensión del papel de la testosterona en la patogénesis de la enfermedad cardiovascular femenina.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.











