Introducción
El agente causal más común en los seres humanos, Mycobacterium tuberculosis, ya que existen otras 6 especies estrechamente relacionadas: M. bovis, M. africanum, M. microti, M. pinnipedii, M. caprae y M. canettii & quot. Todos estos miembros de una misma familia son patógenos obligados y causantes de TBC pero poseen propiedades fenotípicas y rango de hospedantes diferentes. Genéticamente están muy relacionados; el genoma de M. tuberculosis muestra más del 99,9% de similitud con M. bovis, la especie que infecta principalmente a los bovinos pero que también puede causar TBC en otros mamíferos, incluyendo el hombre. La epidemia actual de TBC se está sosteniendo por dos factores importantes: el virus de la inmunodeficiencia humana (VIH) y su asociación con la TBC activa y la creciente resistencia de las sepas de M. tuberculosis a los medicamentos antituberculosos más eficaces (de primera línea). Otros factores incluyen la expansión de la población, la detección de casos paucibacilares y las tasas de curación en países empobrecidos, las guerras, el hambre, la diabetes mellitus, la descomposición social y, la falta de vivienda.
De acuerdo con estimaciones recientes, en 2008 se produjeron en todo el mundo 9,4 millones de casos de TBC nuevos activos correspondientes a una incidencia estimada de 139/100.000 habitantes. En diversos países, solo 5,7 de los 9,4 millones (casos nuevos y recaídas) fueron notificados a los programas nacionales contra la TBC mientras que el resto se basó en las evaluaciones de la efectividad de los sistemas de vigilancia. El número más elevado de casos de TBC se produjo en Asia (55%) seguido de África (30%). La mayor tasa de incidencia (351/100.000 habitantes) se registró en África, principalmente debido a la elevada prevalencia de la infección por el VIH. Se estima que en 2008, 1,4 millones (15%) de los pacientes con TBC incidente estaban coinfectados con el VIH. En todo el mundo, el total de casos prevalentes de TBC en 2008 fue 11,1 millones correspondientes a 164 casos/100.000 habitantes, que resultaron en 1,8 millones de muertes, (incluyendo 0.500 mil pacientes coinfectados con el VIH).
Cerca de 440.000 casos de TBC resistente a múltiples drogas (TBC-RMD), definida como la infección con cepas de M. tuberculosis resistentes al menos a 2 de los medicamentos de primera línea más importantes, la rifampicina (RMP) y la isoniacida (INH), se produjeron en 2008. Para el 2009, en 58 países se había detectado la TBC extensivamente resistente (TBC-ER), definida como la infección por cepas de TBC_RMD, es además resistente a las fluoroquinolonas y los antituberculosos de segunda línea como los agentes inyectables kanamicina, amikacina o capreomicina. Mientras que la TBC-RMD tiene un tratamiento difícil y costoso, la TBC-ER es prácticamente una enfermedad incurable en la mayoría de los países en desarrollo.
Establecimiento y persistencia de la infección latente por M. tuberculosis
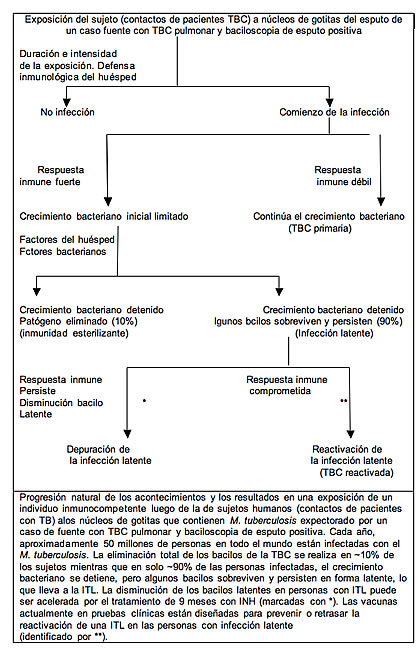
La TBC es una enfermedad contagiosa; la infección se produce por la inhalación del núcleo de gotitas (partículas de 1-5 micras de diámetro) que contienen M. tuberculosis expectorado por los pacientes con TBC pulmonar o laríngea activa, por lo general cuando el paciente tose. La transmisión activa es más frecuente en los hogares y lugares pequeños llenos de gente, en los países con una incidencia elevada TBC; el riesgo de infección depende de varios factores tales como la capacidad de infección del caso fuente, la cercanía del contacto, la carga bacilar inhalada y el estado inmunitario del huésped. Los estudios de epidemiología molecular han demostrado que existen claras diferencias en la presentación de la enfermedad y la demografía en los países con incidencia elevada y baja.
En varios países africanos y asiáticos, la gran mayoría de las infecciones son causadas por M. tuberculosis y las tasas de incidencia son más elevadas en los adultos jóvenes, con más casos resultantes de episodios recientes de infección o reinfección. Al contrario, en los países de Europa occidental y América del Norte con baja incidencia de TBC se observa una mayor proporción de casos activos de TBC en pacientes mayores o inmigrantes de países con una incidencia elevada de TBC. La TBC pulmonar da cuenta de más del 85% de los casos de TBC activa en los países con incidencia elevada de TBC mientras que la incidencia de TBC extrapulmonar es más común en los países con baja incidencia de TBC, en particular entre los individuos infectados por el VIH y los inmigrantes originarios de los países con TBC endémica. Los núcleos de las gotitas inhaladas impiden la defensa de los bronquios debido a su pequeño tamaño y penetran en los alvéolos terminales de los pulmones donde son fagocitados por las células presentadoras de antígenos fagocíticas, incluyendo los macrófagos alveolares y pulmonares y las células dendríticas.
En en el espacio alveolar pulmonar, M. tuberculosis puede infectar a las células no fagocíticas, como las células endoteliales, las células M tipo 1 y 2 y las células epiteliales. En la fase inicial de la infección por M. tuberculosis, internalizada por los macrófagos y las células dendríticas, se replica dentro de las células, y las células inmunes cargadas de bacterias pueden atravesar la barrera alveolar y provocar la difusión sistémica. La replicación intracelular del patógeno y la difusión simultánea a los ganglios linfáticos pulmonares y otros sitios extrapulmonares se produce antes de que se desarrolle la respuesta inmune de adaptación.
La entrada de M. tuberculosis en las células inmunológicas fagocíticas en el espacio alveolar comienza con el reconocimiento de los patrones moleculares asociados a patógenos específicos por los receptores de reconocimiento de patógenos que inician una respuesta inmune innata coordinada por el huésped. Los componentes de M. tuberculosis son reconocidos por los receptores del huésped (receptores símil toll, receptores símil dominio de oligomerización ligado a nucléotidos, y lectinas tipo C [Mincle]). Las lectinas C incluyen a los receptores de manosa, las no integrinas atrapantes de moléculas de adhesión intercelular específicas de las células dendríticas, lectina C macrófago inducible y lectina 1 C asociada a células dendríticas tipo1.
La señalización de los receptores símil toll es la rama principal de la respuesta inmune innata y M. tuberculosis se internaliza a través de diferentes receptores que pueden tener diferentes destinos. La envoltura celular de M. tuberculosis se compone de una pared celular cubierta con una gruesa capa de cera de lípidos, polisacáridos y ácido micólico. Los ligandos más importantes de la superficie celular de M. tuberculosis que interactúan con los receptores tipo toll y otros receptores incluyen las lipoproteínas de 19 y 27 kDa, las glucolipoproteínas de 38 kDa, los glucolípidos (fosfatidilinositol manósido; lipomannan, lipoarabinomanan, lipoarabinomanan recubierto de manosa, dimicolato de trehalosa).
Otros ligandos pueden incluir las proteínas de la superficie expuesta como la LprA y la LprG y las proteínas de entrada a células de mamíferos codificadas por los operones mce1 y mce3. Normalmente, las señales generadas a través de los receptores símil toll y la lectina C promueven la respuesta inmune proinflamatoria mientras que el reclutamiento preferencial de las no integrinas atrapantes de moléculas de adhesión intercelular específicas inducen la supresión y/o el agotamiento de la respuesta inmune. Los glucolípidos y las lipoproteínas ya mencionados expuestos en la superficie celular de M. tuberculosis son reconocidos principalmente por los receptores símil toll tipo 2.
La interacción de los ligandos de M. tuberculosis con los receptores tipo toll inicia una cascada de señalización intracelular que culmina en una respuesta proinflamatoria (beneficiosa para el huésped), pero las estrategias de la bacteria también han evolucionado y pueden desencadenar señales que empañan la respuesta inmune innata (beneficiosa para el patógeno). El proceso proinflamatorio provoca la activación del factor de transcripción nuclear (NF)-κ B y la producción de citocinas proinflamatorias, quimiocinas y óxido nítrico, ya sea a través de la diferenciación mieloide de las vías independiente o dependiente de las proteínas 88 de respuesta primaria (MyD88).
Además de los macrófagos y las células dendríticas, en la respuesta inmune efectiva también participa una amplia gama de otros componentes inmunológicos contra M. tuberculosis e incluyen las células T α ß (ambas CD4+ y CD8+), las células T restringidas CD1 y las células T citotóxicas, como así las citocinas producidas por las células inmunes. Las más importantes son las células T CD4+ T y el interferón citocina (IFN)-γ
Los dos mecanismos principales de defensa de los macrófagos son la fusión de los fagosomas que contienen M. tuberculosis con los lisosomas (fagolisosoma), que es bactericida, y la generación de óxido nítrico y otros intermedios de nitrógeno reactivos, de efectos sobre los bacilos. Los fagosomas que contienen M. tuberculosis maduran a través de una serie de eventos de fusión y fisión con varias vesículas endocíticas que culminan en un fagolisosoma. Los eventos de fusión-fisión remodelan la membrana fagosómica. La cascada de señalización Ca+2 y el reclutamiento de ATPasa vacuolar transportadora de protones (vH+-ATPasa) provocan la disminución del pH interno que permite que las hidrolasas ácidas derivadas del lisosoma funcionen de manera eficiente por su efecto microbicida. Otro mecanismo micobactericida de los macrófagos es la destrucción del lisosoma de M. tuberculosis mediada por los péptidos derivados de la ubicuitina. La ubicuitinación destruye el bacilo de la TBC por autofagia como los péptidos derivados de la ubicuitina alteran la integridad de la membrana de M. tuberculosis permitiendo que el óxido nítrico destruya de manera más eficiente. La apoptosis de los macrófagos infectados participa en la defensa del huésped contra la infección y las vesículas apoptóticas conteniendo antígenos micobacterianos son fagocitadas por las células dendríticas para activar a las células T CD8+ por los antígenos encerrados en los fagosomas.
Los antígenos de las micobacterias que se hallan en los macrófagos o en las células dendríticas son recogidos por las moléculas MHC de clase II y presentados a las células T CD4+. La membrana fagosómica también está equipada con un mecanismo de procesamiento clase MHC. También las proteínas CD1 presentan a las células T glucolípidos, lípidos y lipopéptidos de lípidos ricos en M. tuberculosis. Por otra parte, las vesículas formadas debido a la apoptosis de los macrófagos infectados con M. tuberculosis son absorbidas por las células dendríticas y presentadas a las células T a través de MHC clase I y moléculas CD1.
Inmediatamente después de la entrada de M. tuberculosis, los macrófagos alveolares producen citocinas inflamatorias y quimiocinas que sirven como una señal de infección. Los monocitos, los neutrófilos y los linfocitos migran al sitio de la infección pero no pueden matar a las bacterias de manera eficiente. Durante este tiempo, los bacilos resisten a los mecanismos bactericidas de los macrófagos (fagolisosoma) evitando la fusión fagosoma-lisosoma, se multiplican en el fagosoma y finalmente salen del fagosoma/lisosoma causando la necrosis de los macrófagos. La salida de M. tuberculosis del fagosoma/lisosoma está favorecida por la proteína blanco antigénica de secreción precoz 6-kDa (ESAT-6) y el sistema de secreción proteica ESX-1 codificado por la región de diferencia 1, un segmento gnómico presente en todas las cepas virulentas de M. tuberculosis y M. Boris pero está ausente en la vacuna BCG con cepas de M. bovis. La proteína ESAT-6 se asocia con liposomas que contienen dimiristoilfosfatidilcolina y colesterol y causan la desestabilización y la lisis de los liposomas. También se ha mostrado que la proteína ESAT-6, liberada durante la acidificación de los fagosomas del complejo ESAT-6:proteína filtrada 10 kDa del filtrdo de cultivo (CFP-10) (secretado por M. tuberculosis vivo a través del sistema de secreción ESX-1) se inserta por sí mismo en la bicapa lipídica y causa la lisis del fagosoma y la salida de los bacilos tuberculosos. ESAT-6 también induce la apoptosis de los macrófagos a través de la vía dependiente de la caspasa, y la citólisis de las células epiteliales alveolares tipos 1 y 2 y ayuda a la diseminación de M. tuberculosis.
Los bacilos liberados se multiplican fuera de la célula y son fagocitados por otros macrófagos que también fracasan en controlar el crecimiento de M. tuberculosis y son destruidos. Esta progresión de eventos continúa sin oposición (en las personas con una respuesta inmune débil) llevando a la TBC activa en aproximadamente el 10% de los individuos (TBC primaria). Sin embargo, 2-8 semanas después de la infección, en la gran mayoría de individuos infectados se desarrolla una respuesta inmune efectiva mediada por células, ya que las células dendríticas con bacilos maduros fagocitados migran hacia los ganglios linfáticos regionales y estimulan a las células T CD4+ y CD8+) contra los antígenos de M. tuberculosis. La respuesta inmune específica produce células T preparadas que migran retornando al foco de la infección guiadas por las quimiocinas producidas por las células infectadas. La acumulación de macrófagos, células T y otras células del huésped (dendríticas, fibroblastos, endoteliales y del estroma) inducen la formación de granulomas en el sitio de la infección. Las células T CD4+ productoras de IFN-γ reconocen a los macrófagos infectados presentando antígenos de M. tuberculosis y los matan.
Los primeros estadios de la formación del granuloma parecen beneficiar a M. tuberculosis ya que en el sitio de la infección ESAT-6 promueve la acumulación de macrófagos en diferentes etapas de activación y maduración, donde el bacilo tuberculoso se multiplica sin oposición e y los macrófagos infectados pueden también transportar a los patógenos a otros sitios del cuerpo. La eventual formación de granulomas sólidos debido a una respuesta inmunitaria eficaz aísla a los bacilos de la TBC del resto del tejido pulmonar, limita la propagación de las bacterias y proporciona un microambiente para las interacciones de los macrófagos y otras células inmunes y citocinas. También es evidente ahora que los individuos infectados con M. tuberculosis tienen respuestas de inmunidad innata diferentes, lo que conduce a la formación de distintas lesiones granulomatosas, algunas de las cuales eliminan a todos los bacilos (inmunidad esterilizante), mientras que otras permiten la persistencia y viabilidad del M. tuberculosis en el microambiente.
En los modelos de primates de TBC humana latente, la infección en dosis baja muestra por lo menos 2 tipos de granuloma tuberculoso. El clásico granuloma caseoso compuesto por macrófagos epiteliales, neutrófilos y otras células inmunes rodeadas de fibroblastos. M. tuberculosis reside dentro de los macrófagos en la región central de necrosis caseosa que es hipóxica. El segundo tipo de granuloma (lesiones fibróticas) se compone principalmente de fibroblastos y contiene muy pocos macrófagos, sin embargo, la ubicación exacta de M. tuberculosis viable en estas lesiones no se conoce.
Con la formación de granulomas y una respuesta inmunológico eficaz, la mayoría de los bacilos muere y la progresión de la enfermedad se detiene. Aunque la respuesta inmune proinflamatoria es en general beneficiosa para el huésped, es esencial restringir esta respuesta para evitar el riesgo de que se produzca una inflamación excesiva que podría dañar los tejidos del huésped. Esto se logra a través de una familia de receptores tirosina-cinasa que proporciona un mecanismo de retroalimentación negativo para ambos, mediado por receptores tipo toll y la respuesta inmune inflamatoria derivada de las citocinas. Este mecanismo de defensa del huésped ha sido explotado por M. tuberculosis para su supervivencia. Varios factores de M. tuberculosis, tales como la lipoproteína de 19 kDa, los gluolípidos (sobre todo el lipoarabinomanan cubierto de manosa), el dimicolato trehalosa y otros) pueden modular las vías de procesamiento antigénico por las moléculas MHC clase I y II y las moléculas CD1, la biogénesis faogolisosómica y otras vías de señalización de los macrófagos. La supresión de estas respuestas atenúa las funciones microbicidas de los macrófagos y otras células inmunológicas (como los reactivos intermedios del nitrógeno) o impiden su correcta maduración (fagolisosoma).
La inhibición de las respuestas de los macrófagos al M. tuberculosis da como resultado un subgrupo de macrófagos infectados incapaces de presentar los antígenos de M. tuberculosis a las células T CD4+. Esto se traduce en la activación insuficiente de las células T efectoras causante de la evasión de la vigilancia inmunológica y la creación de nichos en los cuales M. tuberculosis sobrevive. La hipoxia, la deficiencia de nutrientes, el pH bajo y la inhibición de la respiración por el óxido nítrico en el microambiente del granuloma inducen un programa de latencia del M. tuberculosis. En los bacilos sobrevivientes estas condiciones inician una fase inactiva con muy poca o ninguna actividad metabólica y de replicación; sin embargo, la expresión de los antígenos de latencia regulados por el grupo de genes DosR continúa. También es probable que en estas condiciones, para su supervivencia, M. tuberculosis forma estructuras tipo esporas, normalmente observadas con otras micobacterias en respuesta a fases estacionarias prolongadas o de carencia de nutrientes. La disminución de la permeabilidad de la membrana externa también protege a M. tuberculosis de ser eliminado por los péptidos derivados de la ubicuitina. Por lo tanto, algunos bacilos no replicantes (resistentes) evitan ser eliminados por el sistema inmune y logran persistir. Esta infección tuberculosa latente (ITL) en una persona sin signos evidentes de la enfermedad se identifica por la respuesta de hipersensibilidad retardada al derivado proteico purificado (PPD), preparado a partir del filtrado del cultivo de M. tuberculosis (prueba cutánea de la tuberculina PT). Los bacilos latentes pueden habitar en el granuloma durante toda la vida del huésped, pero son capaces de reanudar su crecimiento cuando la respuesta inmune se ve comprometida (TBC reactivada). La OMS ha estimado que una tercera parte de la población mundial total tiene infección latente por M. tuberculosis y el 5% -10% de los individuos infectados desarrollará la enfermedad activa en algún momento de su vida. Sin embargo, el riesgo de desarrollar la enfermedad activa es de 5%-15% por año mientras que en los individuos coinfectados por el VIH el riesgo de por vida es de aproximadamente 50%.
Para salir del letargo, la reactivación de la infección latente requiere de M. tuberculosis. Las transglucosilasas líticas, conocidas como factores de promoción de la reanimación y una endopeptidasa de M. tuberculosis han sido reconocidas como componentes vitales para la reactivación de la latencia. Aunque la reactivación de la infección latente puede ocurrir décadas después de la infección inicial, la persona está en mayor riesgo de desarrollar la enfermedad activa durante los 2 primeros años después de la infección. Hay varios factores que pueden desencadenar el desarrollo de la enfermedad activa a partir de la reactivación de la infección latente, y por lo general implican el debilitamiento del sistema inmunológico. La infección por el VIH es el factor de riesgo más importante para la progresión a enfermedad activa en los adultos, ya que causa agotamiento y alteraciones funcionales de las células T CD4+ y/o las células T CD8+, fundamentales para la protección contra la TBC activa. Del mismo modo, la infección por M. tuberculosis acelera la progresión de la infección por VIH al SIDA y, finalmente, a la muerte. En los casos de SIDA actuales, para la definición diagnóstica de SIDA alcanza con denominarla como TBC pulmonar o extrapulmonar en pacientes infectados por el VIH. Sin embargo, la reactivación de la TBC puede ocurrir en cualquier órgano o sistema de individuos inmunocompetentes; por lo general ocurre en los lóbulos pulmonares superiores, donde la mayor presión de oxígeno favorece un buen crecimiento bacilar.
Nuevo modelo dinámico de infección tuberculosa latente
El modelo tradicional de ITL se inicia con la entrada de M. tuberculosis en las células presentadoras de antígeno en los alvéolos pulmonares; el patógeno logra la supervivencia intracelular mediante varias estrategias de evasión como la neutralización del pH fagosómico, la presentación de antígenos por los macrófagos y las células dendríticas que estimulan a las células T CD4+, la apoptosis de los macrófagos infectados y la interferencia con la autofagia. Las primeras etapas del desarrollo del granuloma benefician al patógeno, ya que invade a los macrófagos en diferentes estadios de activación y maduración y por lo tanto sobrevive cuando el conjunto libre de fagocitos y granulocitos polimorfonucleares se transforma en un granuloma sólido. Aunque por el momento se evita la enfermedad activa, igual se produce la infección latente porque el patógeno no se elimina. El bacilo de la TBC es resistente al ataque inmunológico a medida que pasa a una fase inactiva con metabólico y actividad de replicación muy bajos o nulos. Sin embargo, durante la infección latente, la expresión de un grupo de genes DosR continúa.
La naturaleza metabólica y física exacta y la ubicación del bacilo tuberculoso persistente en estado latente siguen siendo desconocidas. El bacilo puede permanecer latente durante toda la vida del huésped sin causar la enfermedad activa o pudiendo causar la enfermedad varios años o incluso décadas más tarde. El deterioro debido al agotamiento o la supresión de la inmunidad de las células T provoca la reanimación de M. tuberculosis a partir de una fase metabólicamente latente a otra activa que lleva a la enfermedad TBC (TBC reactivada). Sin embargo, el riesgo de que la enfermedad se reactive es más elevado durante los dos primeros años que siguen a la infección por M. tuberculosis. Del mismo modo, la reactivación de la TBC en personas inmunocompetentes que migran desde países con TBC endémica a los países con baja incidencia de TBC también se produce generalmente en el plazo de los 2 primeros años de su migración. Sobre la base de estas observaciones y algunos datos experimentales recientes, se ha propuesto un modelo dinámico de ITL en el que, en los individuos inmunocompetentes, la reactivación endógena como así la respuesta al daño se producenconstantemente.
El modelo sugiere que durante las etapas iniciales de la infección (desarrollo del granuloma), M. tuberculosis crece bien en el interior del fagosoma y luego escapa del fagosoma/fagolisosoma liberándose en el medio extracelular debido a la necrosis de los macrófagos. Algunos de los bacilos extracelulares detienen la replicación debido a la hipoxia y acidez del medio ambiente, a la escasez de nutrientes (similar a la de los cultivos bacterianos estacionarios) y a la presencia de enzimas bactericidas liberadas por la destrucción de las células inmunes, incluso antes de que se haya desarrollado una respuesta inmune completa efectiva. Con el desarrollo de una respuesta inmune efectiva, los bacilos en crecimiento activo son fácilmente destruidos, pero la los bacilos metabólicamente inactivos no replican (inactivos), resisten a su eliminación y pueden sobrevivir. El modelo también asigna un papel importante a los macrófagos espumosos que surgen durante un proceso inflamatorio crónico (como la TBC), debido a la fagocitosis de los desechos celulares ricos en ácidos grasos y colesterol.
En la difusión y/o disminución de la infección, el modelo sugiere que como los macrófagos espumosos fagocitan M. tuberculosis extracelulares no replicantes ricos en lípidos junto con restos celulares, los bacilos no mueren debido a que no replican y son metabólicamente inertes (latente). Al mismo tiempo, los bacilos tuberculosos tampoco crecen en el medio intracelular ya que los macrófagos ahora están activos. Como los macrófagos espumosos que contienen bacilos no replicantes salen de los granulomas pulmonares hacia el árbol bronquial, M. tuberculosis se aloja en una región diferente del parénquima pulmonar debido a que los aerosoles generados por el aire inspirado llevan a los bacilos a esta nueva ubicación y tienen otra oportunidad para iniciar el proceso infeccioso. En este proceso de control de la infección durante el proceso de reinfección, los bacilos se alojan en los lóbulos superiores y pueden tener la oportunidad de causar una lesión cavitaria. Esto se debe a que la presión de oxígeno es más elevada en los lóbulos superiores, lo que puede favorecer el un aumento rápido de la concentración bacilar extracelular, que no puede ser controlada por la respuesta inmune óptima del huésped. La respuesta inflamatoria posterior, mucho más fuerte, conduce a la destrucción del tejido, la licuefacción y el crecimiento bacilar extracelular, lo que amplifica más la respuesta y hace que se desarrolle la caverna.
En un subgrupo de individuos infectados que no está en riesgo de reinfección, el modelo de infección dinámico, con la participación del drenaje y la destrucción de los bacilos no replicantes en el estómago durante un período de tiempo, propone la depuración lenta de la infección latente. Un estudio reciente llevado a cabo en Noruega, un país con un riesgo bajo de transmisión activa de infección o reinfección, ha demostrado que las tasas de reactivación de la TBC entre los pacientes previamente expuestos a M. tuberculosis han disminuido progresivamente durante varios años. Por otra parte, la prevención de la reinfección por los bacilos latentes reanimados mediante la isoniacida, durante el control de la infección en los ciclos de crecimiento de la reinfección también explica cómo el tratamiento de solo 9 meses con un solo fármaco es eficaz frente a la división activa de los bacilos, es altamente efectivo para una infección latente sostenida por bacilos no replicantes , los que presumiblemente pueden sobrevivir durante la vida útil del huésped.
Diagnóstico de infección latente por M. tuberculosis
A pesar de que en muchos países con baja incidencia de TBC el control y el manejo de la misma se centran en identificación y el posterior tratamiento de las personas con ITL, la identificación real de los sujetos con ITL no es viable actualmente en los seres humanos. Las pruebas diagnósticas actuales (de PT cutánea o las pruebas más recientemente desarrolladas basadas en células) solo están diseñadas para medir la respuesta de adaptación inmune del huésped expuesto a M. tuberculosis, por lo general 6-8 semanas después de la exposición al bacilo. La PT mide la inmunidad celular en la forma de la respuesta de hipersensibilidad retardada a un cóctel complejo de más de 200 antígenos de M. tuberculosis, conocida como derivado de proteína purificada (PPD); el resultado de la prueba por lo general se lee como una induración (en mm) registrada 48 a 72 horas después de la inyección intradérmica de PPD.
Los criterios para una prueba de PT positiva varían considerablemente y dependen del inóculo y el tipo de preparación utilizado en la prueba. En Estados Unidos, generalmente se utilizan 5 unidades de PT (UT) y se considera positiva a la induración ≥5 mm en seropositivos para el VIH o en receptores de órganos trasplantados o en una persona en contacto con un caso conocido de TBC activa. Sin embargo, en personas nacidas en el extranjero, en países con incidencia elevada de TBC o personas con mayor riesgo de exposición a M. tuberculosis (por ej., profesionales de la salud) se considera positiva a una induración de ≥10 mm. En la mayoría de los países europeos se utilizan 2 UT y en los adultos inmunocompetentes se considera positiva una induración ≥10 mm. En el Reino Unido se utilizan 10 UT y la induración es positiva cuando mide 5-15 mm en los no vacunados con BCG y ≥15 mm en los adultos inmunocompetentes vacunados con BCG. La PT >20 mm por lo general corresponde a la enfermedad activa, sin embargo, también puede haber una prueba negativa en un paciente con TBC activa debido a la anergia o la administración incorrecta de la prueba o el almacenamiento inadecuado de los reactivos, comprometiendo así su sensibilidad.
Las pruebas cutáneas son más adecuadas para detectar la infección por M. tuberculosis en los países en desarrollo, donde se produce más del 80% de los casos mundiales de TBC, ya que no requiere amplias instalaciones de laboratorio y los trabajadores de la salud ya están familiarizados con la administración y la lectura de esas pruebas cutáneas. Sin embargo, la PT tiene varios problemas inherentes, ya que los antígenos presentes en la PPD también los están en la vacuna BCG con cepas de M. bovis y otras micobacterias ambientales. Por lo tanto, la PT tiene menor especificidad ya que no puede diferenciar entre la infección por M. tuberculosis previa a la vacunación con la BCG M. bovis CG o la sensibilización con las micobacterias del medio ambiente. Por otra parte, la sensibilidad del test es limitada en los individuos inmunocomprometidos debido a la anergia. Estos factores han puesto en peligro la sensibilidad y la especificidad de la PT cutánea para el diagnóstico de la infección latente.
Recientemente se han desarrollado pruebas muy sensibles y específicas para el diagnóstico de la ITL, como resultado de los avances en la genómica y la inmunología. El conocimiento de la secuencia completa del genoma de M. tuberculosis y otras especies Mycobacterium, y la identificación de la diferencia 1 (RD1) mediante la hibridación sustractiva, una región genómica que está presente en todos los M. tuberculosis y en las cepas patógenas de M. bovis pero no en las cepas de M. bovis de la vacuna BCG y la mayoría de las micobacterias ambientales de importancia clínica. Dos de las proteínas codificadas por la RD1, ESAT-6 y CFP-10, son fuertes antígenos celulares T.
Los primeros estudios en animales demostraron las respuestas cutáneas de hipersensibilidad retardada a ESAT-6 y CFP-10 discriminadas entre los animales infectados con M. tuberculosis de los sensibilizados con BCG M. bovis o con micobacterias del medio ambiente. La ESAT-6 obtenida a partir de E. coli también es biológicamente activa y fue utilizada con éxito como reactivo para la prueba cutánea para el diagnóstico de infección tuberculosa en los seres humanos, en ensayos clínicos de fase I. La sensibilidad de ESAT-6 ha mejorado aún más por su combinación con la PPC-10 y la proteína de fusión ESAT-6/CFP-10, la cual mostró ser tan sensible como la PPD en la predicción de la enfermedad en cerdos de guinea infectados con M. tuberculosis. Se espera que la fusión de la proteína rESAT-6/CFP-10 pueda reemplazar a la PPD como reactivo de la prueba cutánea para identificar a los individuos con infección latente.
También han ha desarrollado otras pruebas mediadas por células basadas en la inmunidad. Se desarrollaron ensayos de liberación de IFN-γ de células T in vitro basados en el principio de que las células T de individuos sensibilizados con antígenos de M. tuberculosis producen niveles elevados de IFN-γ, en respuesta a un reencuentro con estos antígenos. Inicialmente, los ensayos de liberación de IFN-γ (ELIG) utilizaban como estímulo antígénico a la PPD, pero luego fue reemplazada por dos antígenos de células T específicos de M. tuberculosis; se comprobó que ESAT-6 y PPC-10 eran sensibles y específicos tanto para la detección de la TBC pulmonar y extrapulmonar activa como para la infección latente.
Dos ELIG comerciales en sangre QuantiFERON-TB Gold (Australia) y T-SPOT.TB (un tipo de ELISPOT) (Reino Unido) se desarrollaron posteriormente y fueron aprobadas por la Food and Drug Administration (FDA) para detectar la infección latente. La primera generación de la prueba QuantiFERON-TB Gold se basó en la estimulación de los linfocitos T con PPD y la medición de la producción de IFN-γ. El ensayo QuantiFERON-TB Gold mejorado, posteriormente utilizó ESAT-6 y proteínas CFP-10 como estimulantes de antígenos. La primera generación del T-SPOT.TB utilizó ESAT-6 y proteínas CFP-10 como estimulantes de antígenos para detectar células T. Desde su creación, estas pruebas comerciales han sido objeto de más mejoras. La versión más reciente del ensayo QuantiFERON-TB Gold se llama QuantiFERON-TB-Gold-en-tubo (QFT-G-IT) y como antígenos utiliza péptidos ESAT-6 y CFP-10 y TB7.7.
La nueva versión de T-SPOT.TB también utiliza como antígenos a péptidos de ESAT-6 y CFP-10 en lugar de todas las proteínas ESAT-6 y CFP-10. El rendimiento de ambas pruebas ha sido evaluado extensamente con/sin comparación directa con la PT y existen varias revisiones sobre su desempeño en diferentes configuraciones. Al igual que la PT, una limitación importante de ambos ELIG es su incapacidad para distinguir la ITL de la TBC activa. Esto puede ser particularmente importante en los países con incidencia elevada de TBC, en los que la ITL se ha generalizado y la reinfección sucede con frecuencia en los individuos inmunocomprometidos (como los coinfectados con el VIH) y los niños, debido al carácter subclínico de la enfermedad. Sin embargo, Los ELIG tiene mayor especificidad (más que la PT), ya que no están afectadas por la vacunación previa con BCG, porque los antígenos utilizados en estos ensayos no etán presentes en la BCG M. bovis y la reactividad cruzada con las micobacterias ambientales es menos probable. Por otra parte, a partir de los pocos datos en individuos inmunocomprometidos, la sensibilidad de los ELIG, en particular del T-SPOT.TB, es también superior a la PT. Sin embargo, los resultados clínicos de estas pruebas han sido variables en diferentes grupos en todo el mundo debido a las diferencias en el espectro y la gravedad de los casos de TBC y la proporción de personas coinfectadas por el VIH incluidas en diversos estudios.
En los países con baja incidencia de TBC, la detección de la ITL tiene como objetivo identificar a las personas con mayor riesgo de progresión de la fase latente a la TBC activa. Esto incluye a todas las personas recientemente infectadas (contactos cercanos de casos índice de TBC pulmonar activa), los inmigrantes recientes de países con incidencia elevada de TBC y las personas con inmunosuprimidas (como los infectados por el VIH) o los inmaduros (como los niños muy pequeños).
Los datos anteriores sobre la historia natural de la TBC sugieren que después de la exposición a M. tuberculosis, el 5-10% de las personas infectadas desarrollan TBC activa en los primeros 2 años de la infección inicial. En las personas con un sistema inmunológico sólido, otro 5-10% de los individuos desarrollará la enfermedad activa durante el resto de sus vidas, mientras que en los individuos inmunodeprimidos, el riesgo es mucho mayor. Por lo tanto, el diagnóstico y el tratamiento de la ITL serán mejores si se dirigen específicamente a los individuos con mayor riesgo de progresión de la ITL a la enfermedad activa, como los individuos recientemente expuestos, los niños pequeños y los infectados con el VIH y otros sujetos inmunocomprometidos.
La evidencia actual acumulada indica que el rendimiento de las dos pruebas es casi comparable para predecir el desarrollo de la enfermedad activa en individuos inmunocompetentes. Sin embargo, la concordancia entre ELIG y PT suele ser escasa debido a los resultados positivos falsos de la PT en los sujetos vacunados con BCG. La importancia clínica de un resultado positivo de la PT es por lo general poca (es decir, es incapaz de predecir qué pacientes desarrollarán la enfermedad activa en un futuro próximo) y tanto la sensibilidad como la especificidad están influenciadas por los diferentes valores de corte utilizados en diversos contextos. Sin embargo, el valor de una PT negativa para predecir el futuro desarrollo de enfermedad activa en los seres humanos presuntamente expuestos a M. tuberculosis es bastante elevado (valor predictivo negativo). Por otro lado, el valor predictivo de un resultado positivo de ELIG para el desarrollo de TBC activa es usualmente mejor que el de la PT mientras que el valor predictivo de un resultado negativo es muy elevado en los individuos inmunocompetentes, sobre todo si la PT también es negativa. La PT es a menudo negativa en los individuos inmunocomprometidos y su rendimiento también se ve influenciado por las condiciones de inmunosupresión, mientras que la sensibilidad de ELIG es en general mejor que la de la PT y, en condiciones experimentales, (en particular en el ensayo T-SPOT.TB) puede adaptarse muy bien para los individuos inmunocomprometidos.
Un problema importante asociado a los ELIG es la aparición de resultados indeterminados que parecen surgir, en su mayoría, por la supresión de la inmunidad celular y se producen con más frecuencia con el método ELISA que con la prueba ELI-SPOT o los resultados son discordantes si se realizan ambos, la PT y el análisis de sangre. Esto se complica aún más por las diferencias que existen en la forma en que estas pruebas se aplican para detectar la forma latente en las personas infectadas en diferentes entornos. En Estados Unidos y algunos otros países, las guías nacionales defienden el uso inicial de un análisis de sangre (ELIG) reemplazando directamente a la PT para todos los grupos de sujetos. Debido al aumento de la sensibilidad de ELIG, es probable que algunos individuos con un análisis de sangre positivo pueden haber sido PT negativos (si la prueba se llevó a cabo) y son tratados innecesariamente.
Por el contrario, en Estados Unidos y otros países europeos, la selección inicial se realiza con PT, excepto en personas en quienes la PT no es fiable (niños pequeños, mujeres seropositivas al VIH y otros individuos inmunosuprimidos). Para el posterior agrupamiento y para los individuos con PT positiva con mayor riesgo de desarrollar la enfermedad activa se recomienda un análisis de sangre, con el fin de confirmar una infección presunta. Por lo tanto, también es probable que un sujeto PT negativo que pueda haber tenido un resultado ELIG positivo no sea identificado como portador de TBC latente y, por tanto, no recibirá tratamiento. En consecuencia, este enfoque, aunque se supone que es más económico, puede generar el tratamiento deficiente de algunos individuos con ITL. Una individuo inmunocompetente con resultados discordantes (PT negativa y ELIG positiva) debe sser sometido a nuevas preubas al cabo de 3 meses, y si ELIG sigue siendo positiva debe ser tratado por TBC latente (la repetición de un ELILG negativo puede significar una infección transitoria por M. tuberculosis que fue depurada rápidamente). Sin embargo, un resultado similar en un individuo inmunocomprometido debe ser cuidadosamente evaluado: cualquier resultado positivo puede ser importante.
Aunque ambas pruebas, la PT y el ELIG, no pueden distinguir entre la ITL y la TBC activa en adultos inmunocompetentes, en individuos de alto riesgo con condiciones de inmunosupresión y en los niños, ELIG puede ayudar al diagnóstico de la enfermedad activa como una prueba coadyuvante, en particular si los especímenes para la prueba diagnóstica (lavado broncoalveolar, líquido cefalorraquídeo) se obtienen del sitio donde se sospecha la infección, en lugar de utilizarse la sangre. Mientras que el resultado de ELIG se correlaciona mejor con las mediciones sustitutas de la exposición a M. tuberculosis en los países con baja incidencia de TBC, su rendimiento suele ser subóptimo en los países donde dicha incidencia es elevada. La aplicación de la tuberculina para la prueba cutánea y ELILG para identificar a las personas con infección latente que requieren tratamiento ha ayudado mucho a reducir la incidencia de la TBC en los países ricos, avanzados. Estudios previos han mostrado que la mayoría de los casos de TBC activa en los países de incidencia baja o intermedia, en inmigrantes y expatriados procedentes de países con TBC endémica, se producen como consecuencia de la reactivación de una infección previamente adquirida, sobre todo a los 2años de su migración. Otros países de incidencia baja o intermedia con grandes poblaciones de expatriados procedentes de países con TBC endémica también son sometidos a las mismas estrategias para el control de la TBC.
También se ha desarrollado otra variante de los análisis basados en la inmunidad mediada por células convencional (ELIG) utilizando la citometría de flujo. A pesar de que ésta utiliza menor volumen de sangre (<1 ml), el ensayo tendrá una utilidad limitada en gran parte del mundo en desarrollo debido al alto costo de los citómetros de flujo y la necesidad de contar con personal técnico experimentado. La detección de niveles significativos de anticuerpos específicos contra algunas proteínas de M. tuberculosis también se ha observado en los contactos de los pacientes tuberculosos (personas con ITL), como así en pacientes con TBC activa, pero no en sujetos sanos. Sin embargo, los métodos basados en anticuerpos son solo experimentales y no se utilizan en la práctica clínica para detectar la infección latente.
Tratamiento de la infección latente por M. tuberculosis
El seguimiento de los contactos de casos de TBC pulmonar infecciosa (esputo con baciloscopia positiva), con exposición a los bacilos tuberculosos que conduce a la ITL y al tratamiento de las personas infectadas en forma latente con alto riesgo de que la infección latente se transforme en enfermedad activa, ha demostrado ser extremadamente eficaz en el control de la TBC, tanto en Estados Unidos como en otros países de baja carga de TBC. El tratamiento de la TBC latente en las personas infectadas reduce sustancialmente la probabilidad de activación de la ITL y el desarrollo posterior de TBC activa. En el año 2000, la American Thoracic Society y los CDC (Centros para el Control y Prevención de las Enfermedades) publicaron normas para el tratamiento de la TBC latente que también fue aprobado por la Infectious Diseases Society of America and American Academy of . En 2005t se publicó una actualización que incluyó recomendaciones para los pacientes pediátricos.
El régimen estándar para el tratamiento de la ITL en Estados Unidos y Canadá es el tratamiento diario autoadministrado con INH durante 9 meses, pero la duración del tratamiento puede reducirse a 6 meses en los adultos seronegativos para el VIH. La International Union Against recomienda el tratamiento diario con INH durante 12 meses ya que lo considera más eficaz que el curso de 6 meses (75% vs. 65%). La duración preferida del tratamiento para la mayoría de los pacientes con ITL en Estados Unidos y países europeos es de 9 meses, sobre la base de los resultados de ensayos que muestran que con el régimen de 6 meses la eficacia se reduce un 60%, mientras que para los individuos con mayor riesgo de desarrollar enfermedad activa abogan por el tratamiento de 12 meses. De acuerdo con las normas de los CDC, la frecuencia puede reducirse, y del tratamiento diario pasar al tratamiento de 2 veces/semana, con la dosis mayor de INH; sin embargo, el régimen de 2 veces/semana se debe dar como tratamiento directamente observado (DOT). La inclusión de DOT agrega un gasto adicional importante a las estrategias terapéuticas. La eficacia del tratamiento con INH para la prevención de la TBC activa supera el 90% en las personas que completan el tratamiento. Sin embargo, la eficacia global de estos regímenes es muy limitada ya que las tasas de cumplimiento en la práctica clínica han sido más bien bajas (30% a 64%. Las tasas de cumplimiento en otros lugares han sido aún más bajas. El tratamiento con RMP es el único que no es adecuado para los pacientes con otras condiciones subyacentes como la diabetes.
| Fármacos disponibles actualmente para el tt de la TBC latente | |||||
| Droga | Dosis Mx adultos (mg) | Duración | Administración | Frecuencia | Comentarios |
| INH | 300 | 9 meses | DOT | DOT | Recomendado por CDC |
| INH | 900 | 9 meses | DOT | 2/semana | Regimen alternativo |
| INH | 300 | 6 meses | Autoadministrado | Diario | Solo en VIH negativos |
| INH | 900 | 6 meses | DOT | 2/semana | Solo en VIH negativos |
| INH | 300 | 12 meses | Autoadministrado | Diario | Recomendado por IUAT |
| RMP | 600 | 4 meses | Autoadministrado | Diario | Para ITL con cepa INHr en VIH seronegativos |
| INH+RMP | 300 + 600 | 3 meses | Autoadministrado | Diario | Buena alternativa |
| RMP+PZA | 600 + 2000 | 2 meses | Autoadministrado | Diario | Mayor riesgo de hepatotoxicidad |
| RMP+PZA | 600 + 2500 | 2 meses | DOT | 2/semana | Mayor riesgo de hepatotoxicidad |
| INH+RPT | 900 + 900 | 3 meses | DOT | 1/semana | Opción prometedora |
| INHr: resistente a la isoniacida; IUAT. international Union Against Tuberculosis; | |||||
El tratamiento de la ITL con RMP + pirazinamida (PZA) durante 4 meses es otra opción alternativa, también defendida por las mismas instituciones en el año 2000. Aunque los estudios iniciales con 2 meses de RMP + PZA para los infectados por el VIH mostraron que ese régimen es tan efectivo y seguro como el tratamiento con INH; luego de la revisión de 2003 se informaron varios casos de daño hepático grave y/o muerte. Las guías revisadas recomendaron no ofrecer el tratamiento de 2 meses de RMP + PZA, independientemente de la positividad o negatividad serológica para el VIH. Un meta-análisis de 6 ensayos clínicos que compararon la eficacia de 2 meses de RMP + PZA con 6 o 12 meses de INH mostró que el régimen RMP + PZA se asoció con un riesgo mayor de hepatotoxicidad en personas con seronegatividad para el VIH, mientras que para los infectados por el VIH los resultados no fueron concluyentes. Sin embargo, cuando el resultado de 2 meses de RMP + PZA se comparó con 6 meses de INH sin suplementación con piridoxina en personas infectadas por el VIH, no se hallaron diferencias significativas en la hepatotoxicidad en ambos subgrupos. Los resultados de algunos estudios sugieren que 2 meses de régimen de RMP + PZA también pueden ser considerados cuando otros regímenes no son adecuados y es posible supervisar la función hepática.
Otras opciones que han sido probadas o están bajo evaluación para el tratamiento de la ITL incluyen 3 meses de INH + rifapentina (RPT) administradas diariamente o 2 veces/semana bajo DOT y 3 meses de INH + RMP, administradas 1 vez/semana. El régimen de 3 meses de INH + RMP ha sido probado sobre todo en el Reino Unido. Un meta-análisis de 5 estudios realizados en infectados por el VIH y en individuos VIH-seronegativos, como también 2 estudios posteriores, han demostrado que el régimen de 3 meses de INH + RMP se tolera bien y es tan eficaz y seguro como 6 a 12 meses de monoterapia con INH. La vida media más larga de RPT, aprobada en EE.UU. por la FDA en 1998 para el tratamiento de la TBC ha permitido una dosis semanal de INH + RPT para el tratamiento de ITL. Un pequeño estudio que comparó INH + RPT 1 vez/semana durante 3 meses con RMP + PZA diarias durante 2 meses comprobró una tasa menor de suspensión del tratamiento por causa de hepatotoxicidad en el grupo INH + RPT comparado con el grupo RMP + PZA, a pesar de que el riesgo de desarrollar TBC activa fue casi el mismo en ambos grupos. En la actualidad, el Tuberculosis Trials Consortium de los CDC está realizando un estudio multicéntrico para determinar la eficacia de INH + RPT 1 vez/semana, para la prevención de la TBC activa en los individuos de alto riesgo con ITL. Sin embargo, el costo de una dosis semanal de INH + RPT es un problema importante ya que actualmente la RPT es más cara que la RMP.
Perspectivas futuras
Una gran preocupación que ha surgido recientemente es la amenaza de la infección latente en una persona expuesta a un caso de origen por cepa multirresistente de M. tuberculosis. Como aproximadamente 440.000 casos de TBC-RMD corresponden a casi el 5% de todos los casos incidentes de TBC ocurridos en 2008, es posible que este problema atraiga mayor atención en el futuro próximo. La información al respecto es escasa ya que no se han hecho ensayos controlados y aleatorizados para evaluar la eficacia de los regímenes específicos. Los CDC recomiendan un régimen de 6-12 meses de una fluoroquinolona + PZA y etambutol + PZA. Sin embargo, la eficacia y la duración óptima de estos regímenes son en gran parte desconocidas, ya que son muy mal tolerados. Los nuevos medicamentos que se encuentran en diferentes etapas de desarrollo pueden ofrecer mejores alternativas para el tratamiento tanto de la TBC activa como de la ITL.
Las fluoroquinolonas de nueva generación como la moxifloxacina tienen excelente actividad bactericida frente a M. tuberculosis y puede ser más eficaz para el tratamiento de la ITL que los medicamentos más antiguos de la misma clase. En el modelo animal experimental de ITL se comprobó que el régimen de 1 vez/semana de RPT + moxifloxacina durante 3 meses fue tan eficaz como el tratamiento diario con INH durante 9 meses. El PA-824, una nitroimidazol-oxazina, es otro compuesto prometedor activo contra las cepas multirresistentes como así contra las bacterias persistentes no replicantes, por lo que es un fármaco candidato ideal para el tratamiento de la ITL. El régimen terapéutico que contiene PA-824, moxifloxacina y PZA fue muy efectivo en el modelo murino de TBC. El OPC-67683, una nitroimidazol-oxazona, es otro compuesto nuevo que muestra resultados prometedores contra la TBC en ratones. Una diarilquinolina (R207910 también conocida como TMC207) ha mostrado tener una actividad bactericida más potente y precoz que la INH durante la fase temprana de la infección y es más bactericida al final de la infección que la RMP sola y por lo tanto es otra opción para el tratamiento de la ITL. Otro fármaco prometedor es SQ109 (1,2-etilendiamina) que está relacionado estructuralmente con el etambutol, pero es más potente. Se espera que algunos de estos nuevos medicamentos sean opciones adicionales para el tratamiento de la ITL en un futuro próximo.
Otro enfoque que está siendo muy estudiado para el control del desarrollo de la enfermedad activa en personas con ITL es el desarrollo de nuevas vacunas que puedan prevenir la reactivación de la TBC de manera eficiente y que contengan patógenos en un estado latente en las personas infectadas. En los últimos años, más de 10 vacunas candidatas han entrado en ensayos clínicos. Dos de estas vacunas recombinantes son M. bovis BCG destinada a mejorar la antigenicidad y/o la inmunogenicidad de la vacuna BCG actual. Otras 7 subunidades de vacunas se están probando en ensayos clínicos y están siendo utilizadas como vacunas de refuerzo destinadas a reorientar la respuesta inmune después de aprestarla con la vacuna BCG recombinante. Tres de la subunidades de vacunas se han incorporado a los trasportadores virales, mientras que se están entregando otras 4 subunidades de vacunas a través de formulaciones adyuvantes. La BCG recombinante y las subunidades de vacunas de refuerzo están diseñadas para ser administradas antes de la infección por M. tuberculosis, para mantener la infección latente o bien impedir o retrasar su reactivación mediante la inducción de una respuesta de células T de memoria resistentes al agotamiento y la supresión. Otras vacunas en desarrollo incluyen otras modificaciones como la inclusión de genes reguladores de latencia para mejorar la eficacia de las vacunas candidatas a reemplazar a la BCG, para la vacunación post-exposición de las personas con ITL. Un inconveniente de las vacunas es que impiden o retrasan la reactivación de la ITL pero no erradican al patógeno. Sin embargo, los intentos que se están haciendo para combinar los antígenos de M. tuberculosis de ambos estados metabólicos, activo (por ej., proteínas secretadas) e inactivo (por ej., genes reguladores de latencia) en ambas, la vacuna BCG recombinante y las subunidades de vacunas de refuerzo para, con el fin de lograr la erradicación estéril del patógeno.
Conclusión
La infección por M. tuberculosis se inicia con la fagocitosis del bacilo de la TBC por las células presentadoras de antígeno en los alvéolos pulmonares de los seres humanos. Esto pone en marcha un complejo proceso de infección del patógeno y una respuesta inmune potencialmente protectora del huésped. M. tuberculosis ha dedicado gran parte de su genoma a las funciones que le permiten establecer con éxito la infección progresiva o latente en la mayoría de las personas infectadas. El fracaso de la depuración inmunológica se debe a múltiples estrategias de adaptación de M. tuberculosis que bloquean los mecanismos microbicidas de las células inmunitarias infectadas y a la formación de distintas lesiones granulomatosas con diferente capacidad para suprimir o apoyar la persistencia de M. tuberculosis viable (ITL). La PT cutánea positiva o el análisis sanguíneo de liberación de interferón-γ de las células T en una persona sin signos evidentes de TBC activa indica TBC latente y requiere el tratamiento de los individuos, en particular los de mayor riesgo de progresión de la infección latente a la enfermedad activa, como así las personas recientemente expuestos, los niños pequeños y los infectados por el VIH y otros inmunodeprimidos. El régimen terapéutico estándar para la TBC latente es la administración diaria de INH durante 9 meses. Se están desarrollando nuevos fármacos y combinaciones medicamentosas, como así nuevos enfoques como las vacunas, con el obejtifo de erradicar la infección latente en los individuos expuestos. La identificación y el tratamiento de la personas co infección latente ha ayudado mucho al control de la TBC en los países ricos, avanzados. Enfoques similares también son muy prometedores para otros países con incidencia de TBC baja e intermedia.
♦ Traducción y resumen objetivo: Dra. Marta Papponetti. Esp. Medicina Interna
► Para acceder a las referencias bibliográficas en formato PDF, haga clic aquí