Doença de Chagas de transmissão oral
| Introdução |
Uma forma de aquisição do protozoário Trypanosoma cruzi é a transmissão oral, que pode ocorrer em quem vive em regiões endêmicas ou viajam para elas. Cada vez há mais consciência sobre essa forma de transmissão e algumas regiões mostraram um aumento da frequência da infecção por esta via.
A possibilidade da transmissão oral de T. cruzi foi mencionada por Carlos Chagas e logo confirmada experimentalmente em 1921, associada a ingestão oral de tripomastigotos sanguíneos e, em 1933, pelas fezes. Desde então, suspeita-se que a ingestão oral de alimentou ou bebidas contaminadas pelo parasito ou carne de animais infectados cru ou pouco cozido, causam a doença de Chagas (DC).
Para completar seu ciclo de vida, o parasita circula naturalmente entre o inseto vetor triatomíneo e outros mamíferos suscetíveis da selva, peridomésticos e domésticos e reservatórios potenciais (incluindo caninos e humanos). As rotas de transmissão oral nos ciclos da selva ocorrem de duas maneiras diferentes. Isto inclui mamíferos não infectados que consomem e comem ou um mamífero ou um inseto triatomíneo infectado.
Durante várias décadas, as campanhas destinadas ao controle vetorial (Iniciativa dos Países Andinos) tiveram sucesso na redução da transmissão intradoméstica do vetor causada por Rhodnius prolixus. A sua diminuição ou eliminação em humanos e em torno de suas casas fez com que outras espécies de triatomíneos preenchessem a lacuna na cadeia alimentar, como os T. dimidiata, T. venosa, T. maculata e R. pallescens.
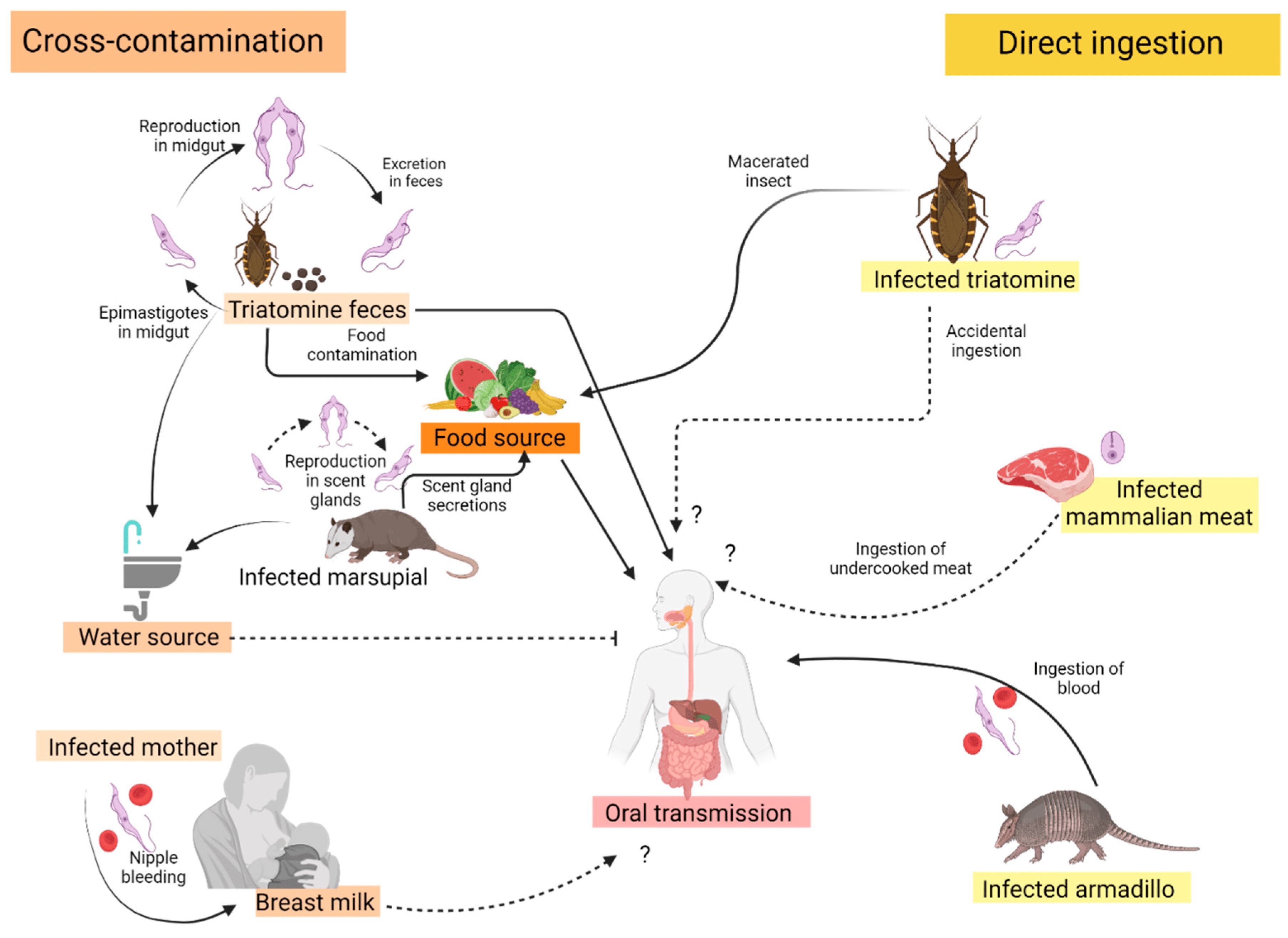
Figura 1: Fontes confirmadas (seta preta) e propostas (seta preta tracejada) de transmissão oral da doença de Chagas.
| Manifestações clínicas da doença de Chagas oral |
Desde a primeira evidência, os surtos de doença de Chagas (DC) oral ganharam importância como via de transmissão emergente. Estima-se que em determinadas regiões, como a bacia amazônica, a transmissão oral ocorra em até 50% dos casos. Devido à gravidade da doença, muitos dos infectados manifestam sinais e sintomas significativos de infecção aguda por DC, que pode levar a miocardite fulminante e insuficiência cardíaca, meningoencefalite e até mesmo choque fatal por parasitemia.
O período de incubação após a ingestão oral de produtos contaminados com T. cruzi é de cerca de 3 a 22 dias, em contraste com 4 a 15 dias para transmissão vetorial e 8 a 160 dias para relacionada a transfusões e transplantes.
Os sintomas e a rápida progressão da doença em pessoas imunocompetentes não são comuns como em outras formas de transmissão como vetorial, congênita ou transfusional. A grande maioria das pessoas com DC oral aguda apresenta febre (71-100%), mas outros sintomas sistêmicos são importantes, incluindo edema facial e dos membros inferiores, mialgia, linfadenopatia, desconforto abdominal, dispneia, vômito, diarreia, hepatomegalia., esplenomegalia, cefaleia, dor torácica, erupção cutânea eritematosa, icterícia, artralgia, epistaxe, hematêmese, melena e palpitações.
O edema facial, que geralmente afeta toda a face e parte dos lábios, está presente em 57 a 100% das pessoas com DC oral aguda.
Isto pode ser diferenciado da transmissão vetorial, em que o inchaço periorbital unilateral é mais comum em pessoas com sintomas agudos (também conhecido como sinal de Romagna).
Acredita-se que a resposta imune sistêmica significativa observada em pessoas com DC oral aguda seja devida à transmissão mais eficiente após a penetração pelas vias oral, faríngea e da mucosa gástrica. Por outro lado, também foram observadas cargas parasitárias muitas vezes mais elevadas em alimentos e bebidas contaminados em comparação com a transmissão vetorial e, portanto, sinais e sintomas clínicos exacerbados de infecção. Estima-se que um único triatomíneo esmagado contendo T. cruzi pode conter 600.000 tripomastigotos metacíclicos, em comparação com 3.000 a 4.000/microlitro de matéria fecal de triatomíneos infectados.
O maior surto de transmissão oral de Chagas esteve ligado ao consumo de suco de goiaba contaminado em uma escola primária venezuelana em Caracas. Foi relatado um total de 119 casos confirmados e suspeitos da doença. A evolução clínica mostrou que 75% foram sintomáticos e 20,3% necessitaram de internação. Um menino de 5 anos morreu de miocardite aguda. Em até 95-99% dos casos, essas porcentagens diferiram daquelas relatadas na DC transmitida por vetores, relatada como assintomática na fase aguda da infecção.
Anormalidades cardíacas foram observadas com mais frequência após a transmissão oral do T. cruzi, em oposição à vetorial. Com esta transmissão, observam-se anomalias cardíacas na maioria dos pacientes, especificamente alterações na polarização ventricular e envolvimento pericárdico, como foi encontrado em jovens soldados colombianos.
Anormalidades eletrocardiográficas na doença de Chagas oral (DC), como ocorreu no maior surto relatado (N = 103), estiveram presentes em 66% dos casos confirmados e são relatadas predominantemente em crianças <18 anos em comparação com adultos infectados (69,7% vs. 56 %). As alterações mais frequentemente observadas incluem alterações do segmento ST e da onda T (37%), bem como prolongamento do intervalo QT (2,9%).
O bloqueio de ramo direito, comum na cardiopatia chagásica crônica, também foi observado na DC oral aguda, mas com frequência muito menor (1,94%, N = 2/103); bloqueio de ramo esquerdo foi observado em 2,9% dos casos (N = 3/103). Anormalidades da onda T foram observadas em ambas as faixas etárias e foram mais comuns em <18 anos (72% vs. 19%) em comparação aos adultos.
No estudo, o achado de ECG anormal (66%; N = 68/103) motivou a realização de ecocardiograma, que revelou 32% (N = 22) dos pacientes com derrame pericárdico leve a moderado e 33% (N = 33/103 ) com arritmias. Isso inclui arritmias supraventriculares (22%; (N = 23/103), arritmias ventriculares (5,8%; N = 6/103) e bloqueio atrioventricular (2,9%; N = 3/102). Em 27% dos casos de DC oral, também foi encontrada disfunção ventricular com baixa fração de ejeção.
| Patogênese por transmissão oral do T. cruzi |
O T. cruzi é um parasita generalista que pode infectar mais de 136 espécies de triatomíneos vetores, essencialmente qualquer mamífero e quase todos os seus tecidos. O ciclo de vida deste parasita envolve 3 formas diferentes: tripomastigota e amastigota.
A patogênese tradicional do T. cruzi segue a rota de circulação sistêmica do tripomastigota, adesão ao tecido muscular liso, conversão para a forma amastigota, reprodução intracelular e expansão do ninho, e eventual dano celular que produz a saída. parasita. O ciclo se repete com tripomastigotos recém-formados circulando sistemicamente. O parasita demonstra tropismo pelos tecidos musculares lisos cardíacos e gastrointestinais, embora possa ser disseminado por todo o corpo humano.
Seu crescimento intracelular produz uma pronunciada resposta de infiltrado inflamatório com dano celular que se apresenta como lesões inflamatórias e fibrose. Esse pode destruir diretamente neurônios e fibras cardíacas, em contraste com o dano físico fibrótico causado por ninhos necróticos de amastigotas. Este ciclo desacelera e torna-se subclínico durante a fase intermediária, que, sem quimioterapia, dura indefinidamente. Em quase 30% dos pacientes, este continua enigmaticamente a um ritmo acelerado até que a doença progrida e se manifeste clinicamente.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.






