Adenocarcinoma do esôfago
| Introdução |
O câncer de esôfago (CE) é a sexta causa mais comum de morte associada a um tumor em todo o mundo, sendo responsável por aproximadamente 1 em cada 20 mortes por câncer.
Em todo o mundo, o tipo mais comum de CE é o carcinoma de células escamosas, seguido pelo adenocarcinoma, enquanto o carcinoma de pequenas células, melanoma, sarcoma e linfoma são raros. No entanto, nos países ocidentais, o adenocarcinoma de esôfago (AE) é muito mais comum do que o carcinoma de células escamosas do esôfago, e sua incidência está aumentando rapidamente nos países desenvolvidos, em parte devido à crescente prevalência de obesidade e doença do refluxo gastroesofágico.
O AE tem prognóstico favorável se diagnosticado precocemente, quando todas as vias não atingiram as camadas mucosa e submucosa do esôfago. No entanto, é lamentável que a maioria dos casos seja diagnosticada tardiamente, quando o prognóstico já é sombrio. A taxa de sobrevida global em 5 anos de pacientes com AE é <20%, comparável à de pacientes com câncer de fígado, pulmão ou pâncreas. Portanto, há uma necessidade premente de estratégias de triagem eficazes para o diagnóstico precoce.
O tratamento tem se concentrado principalmente na ressecção, seja cirúrgica ou, mais recentemente, endoscópica. Historicamente, radioterapia e quimioterapia têm sido aplicadas quando a ressecção é menos viável porque o câncer já se espalhou. Para CE em geral, a abordagem multidisciplinar pode ajudar a identificar a melhor estratégia terapêutica com base nas características do paciente e do tumor, bem como na experiência local.
| Fatores de risco |
> Obesidade
Uma meta-análise de mais de 16.000 casos confirmou uma estreita associação entre índice de massa corporal, obesidade e AE.
> Fatores de risco múltiplos
Em outro estudo, a prevalência do esôfago de Barrett (lesão precursora da AE) apresentou relação linear positiva com o número de fatores de risco, como doença do refluxo gastroesofágico, sexo masculino, idade >50 anos, história familiar de esôfago de Barrett ou AE e obesidade (definida como índice de massa corporal >35 kg/m2).
> Outros fatores não confiáveis
A maioria dos pacientes com AE em estágio inicial são maiores de 65 anos e assintomáticos. Devido à sua complacência, o esôfago pode mascarar tumores menores que permanecem assintomáticos até que a lesão cresça para um tamanho significativo. Como a doença do refluxo gastroesofágico afeta principalmente o esôfago distal e a junção gastroesofágica, 94% dos cânceres associados ao esôfago de Barrett são encontrados além da bifurcação traqueal.
A disfagia significativa associada a lesões precoces deve levar à suspeita de doença mais avançada ou, raramente, de uma causa não maligna concomitante, como estenose péptica, inflamação ou tumor submucoso concomitante.
A esofagite eosinofílica causa inflamação crônica do esôfago, levantando a questão de saber se pode aumentar a transformação maligna. No entanto, um grande estudo recente de banco de dados não conseguiu encontrar uma relação entre esofagite eosinofílica e CE.
O consumo de álcool não parece aumentar o risco de AE, e alguns estudos sugeriram que o vinho pode ser protetor.
| Quem deve ser examinado? |
Acredita-se que o esôfago de Barrett seja o principal precursor do AdE, à medida que progride através de estágios patológicos – metaplasia para displasia de baixo grau, depois displasia de alto grau para AE.
O aumento da AE e seu mau prognóstico em estágios avançados aumentaram o interesse na detecção do esôfago de Barrett e seu acompanhamento próximo. Em um estudo prospectivo, casos de CE em pacientes com esôfago de Barrett submetidos à vigilância endoscópica foram diagnosticados em estágio mais precoce do que na população geral. No entanto, os estudos não conseguiram identificar uma ferramenta precisa, custo-efetiva e amplamente aplicável que possa reduzir a taxa de mortalidade.
As diretrizes atuais, baseadas em evidências de baixa qualidade e opinião de especialistas, restringem a triagem a uma população de pacientes muito específica. Ou seja, aqueles com doença do refluxo gastroesofágico de longa data (> 5 anos) e aqueles com sintomas de refluxo frequentes (semanais ou mais) com ≥2 fatores de risco para esôfago de Barrett ou AE.
Esses fatores de risco incluíram sexo masculino, idade > 50 anos, obesidade central (circunferência da cintura > 102 cm ou relação cintura-quadril > 0,9), história de tabagismo passado ou presente, raça branca, história familiar de primeiro grau de esôfago de Barrett ou AE ou hérnia de hiato.
Pacientes diagnosticados com esôfago de Barrett sem displasia devem ser submetidos à endoscopia a cada 3 a 5 anos. Em um grande estudo nacional, o risco anual de EA a partir do diagnóstico de esôfago de Barrett foi de 0,12%, muito inferior ao risco assumido de 0,5% considerado pelas diretrizes atuais.
No entanto, quase 90% dos casos de EA são diagnosticados em pacientes nos quais o esôfago de Barrett é desconhecido. Isso demonstrou que as diretrizes atuais de triagem permanecem não cumpridas em um grande número de pacientes em risco.
A endoscopia digestiva alta é o padrão ouro para triagem, mas requer sedação e é relativamente cara e inconveniente como procedimento de triagem. Uma ferramenta de triagem ideal deve ser relativamente barata, bem tolerada e aplicável na prática geral.
As taxas de detecção do esôfago de Barrett melhoraram com os avanços na endoscopia, como imagens de alta definição, cromoendoscopia (que usa uma coloração especial para melhorar a visualização da mucosa) e imagem de banda estreita (que melhora a visualização da mucosa com resolução baseada em comprimentos de onda específicos selecionados de leve).
Estudos de deglutição, como a deglutição de bário, não permitem a avaliação da histologia da metaplasia ou displasia. Portanto, não devem ser utilizados para detecção ou vigilância do esôfago de Barrett.
| Novos métodos de detecção |
Métodos que não requerem endoscopia com sedação estão atualmente sob investigação.
> A citoesponja é uma cápsula ingerível contendo uma esponja presa a um barbante. A cápsula se dissolve ao chegar ao estômago e libera a esponja, que pode ser retirada do esôfago pela boca puxando o barbante. Ao sair do esôfago, a esponja coleta células epiteliais que são então analisadas para biomarcadores do esôfago de Barrett, como o fator Trefoil 3. É um método barato e seguro. Um estudo prospectivo encontrou sensibilidade de 73% e especificidade de 94% para detectar lesões de pelo menos 1 cm, resultados que se repetiram em uma revisão sistemática. Da mesma forma, um dispositivo de balão engolido pode amostrar o esôfago distal e detectar marcadores de metilação de DNA. Sua sensibilidade para a detecção de metaplasia do esôfago de Barrett foi de 90,3% e sua especificidade de 91,7%.
> A endoscopia transnasal, outra técnica de consultório, usa um endoscópio reutilizável com uma bainha externa estéril descartável. Parece ser mais bem tolerado do que a endoscopia padrão e seus achados são semelhantes.
> O teste respiratório utiliza um “nariz eletrônico” para detectar compostos orgânicos voláteis no ar exalado e tem apresentado resultados promissores, com sensibilidade de 91% e especificidade de 74%.
Essas novas ferramentas de triagem podem ser eficientes e econômicas na atenção primária. No entanto, mais pesquisas são necessárias antes que eles possam ser amplamente adotados. Ensaios clínicos estão em andamento para avaliar a aceitação e preferência do paciente por essas diferentes ferramentas.
| Medidas preventivas possíveis |
Embora estudos epidemiológicos sugiram que aspirina e anti-inflamatórios não esteroides possam prevenir o esôfago de Barrett e AE, esses medicamentos não tiveram sucesso nos ensaios clínicos.
| Dieta |
Dados retrospectivos de muitos centros mostram que dietas ricas em antioxidantes, frutas, vegetais, ácidos graxos ômega-3, gorduras poliinsaturadas e fibras estão associadas a um menor risco de esôfago de Barrett.
| A biopsia é o padrão ouro para o diagnóstico |
Na endoscopia, as lesões iniciais do AE podem ser planas, polipoides ou levemente deprimidas. Tumores avançados apresentam-se como massas que podem obstruir o lúmen esofágico. O padrão ouro para o diagnóstico é a amostragem de tecido por biópsia endoscópica. Um estudo prospectivo revelou uma precisão de 93% com uma única biópsia; com amostras de biópsia adicionais, o rendimento aumentou para >98%.
| O estadiamento do câncer é fundamental |
Uma vez diagnosticada a AE, seu estágio deve ser avaliado para determinar o prognóstico e o tratamento. Isso aciona o sistema de estadiamento tumor, nódulo e metástase (TNM) da seguinte forma:
• Profundidade do tumor (categorizado na escala Tis como T4b)
• Nódulos, ou seja, número de linfonodos afetados (classificados em uma escala de N0 a N3)
• Metástases em órgãos distantes (M0 para sem metástases à distância ou M1 para metástases à distância).
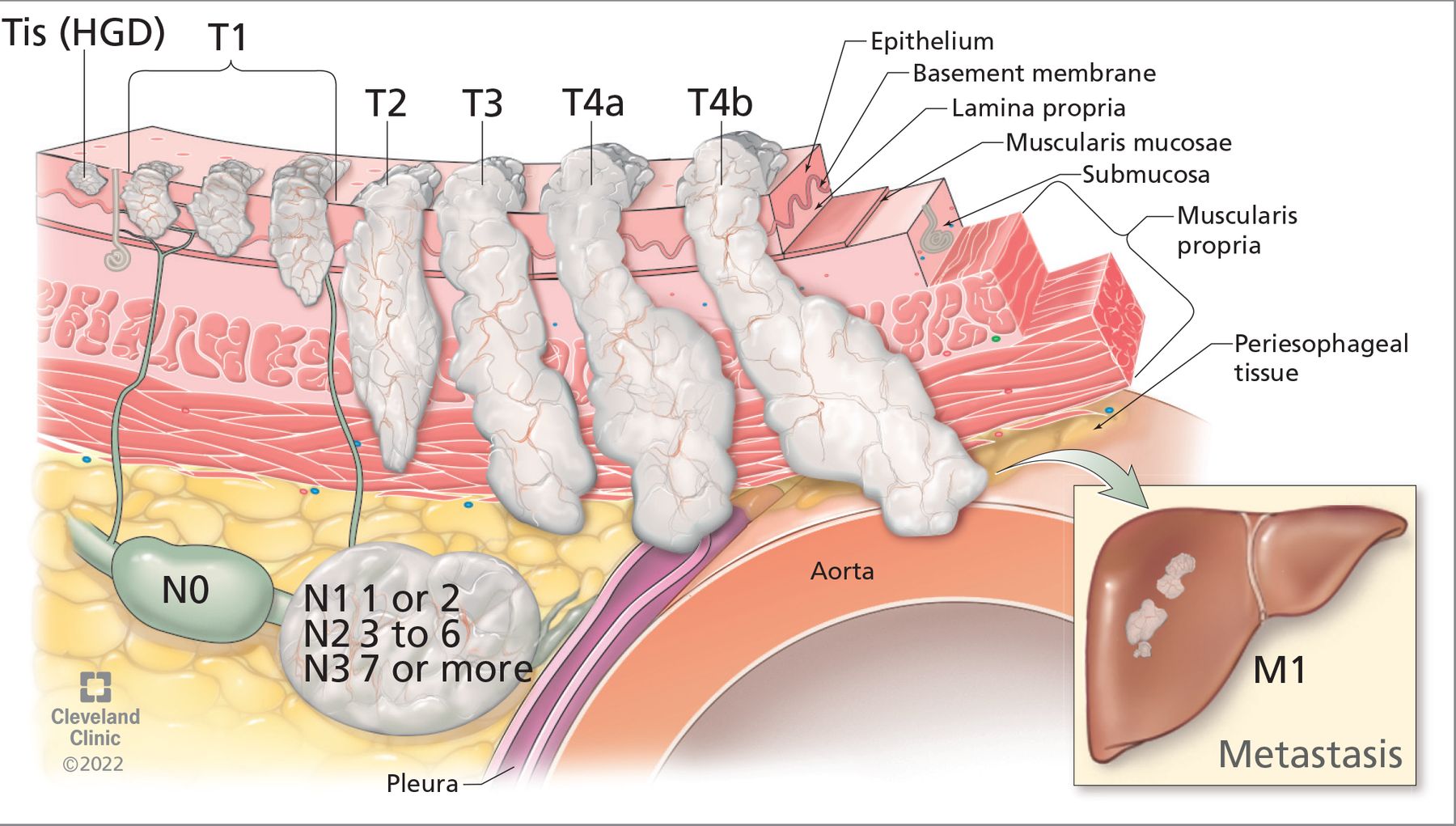
Figura 1: O sistema de estadiamento de tumor, nódulo e metástase (TNM) para câncer de esôfago ajuda a determinar o prognóstico e o tratamento com base na profundidade do tumor, número de linfonodos afetados e metástase para órgãos distantes. Figura retirada de Joseph e colaboradores (2022).
> Tomografia por emissão de pósitrons por tomografia computadorizada (PET-TC). O papel da tomografia por emissão de pósitrons com 18-fluorodesoxiglicose (FDG) por tomografia computadorizada e ultrassom endoscópico nos estágios iniciais da AE é controverso. No entanto, para avaliar a disseminação nodal em casos de câncer avançado (≥T1b), a diretriz da National Comprehensive Cancer Network recomendou o estadiamento PET-TC e ultrassonografia endoscópica. Esse método diagnóstico é menos benéfico em casos de AE precoce do que em doença avançada. Alguns estudos descobriram que não era possível detectar com segurança os estágios iniciais desse câncer, como tumores T1a e T1b.
Um estudo de 79 pacientes com estadiamento clínico de T1a e T1b AE submetidos a PET-CT pré-operatório mostrou que todos os linfonodos FDG-ávidos observados eram falsos positivos; outro estudo teve achados semelhantes. Isso sugere que esse método pode levar a mais biópsias desnecessárias. No entanto, se um tumor mais avançado for encontrado na patologia após a dissecção endoscópica da submucosa, a PET-CT pós-ressecção é de utilidade limitada, pois a inflamação do leito de ressecção é frequentemente FDG-ávida na PET. Portanto, PET-CT é considerado antes da ressecção de tumores volumosos ou limítrofes maiores que 15 mm ou lesões com suspeita de invasão superficial (SM1) > 500 mícrons.
A ultrassonografia endoscópica pode avaliar a profundidade da invasão tumoral e a disseminação linfonodal locorregional. No entanto, tem uma alta taxa de falso-positivos de até 10%. Consequentemente, as diretrizes da Sociedade Americana de Endoscopia Gastrointestinal desaconselharam seu uso rotineiro para o estágio da mucosa AE (T1a) e doença submucosa (T1b).<
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.






