Enfermedad de Chagas de transmisión oral
Introducción
Una forma de adquisición del protozoario Trypanosoma cruzi es la transmisión oral del parásito, que puede ocurrir en quienes viven en regiones endémicas o viajan a ellas. Cada vez hay más conciencia de la transmisión oral y algunas regiones ahora muestran un aumento de la frecuencia de la adquisición por esa vía. La posibilidad de la transmisión oral de T. cruzi fue mencionadas por Carlos Chagas y luego confirmada experimentalmente en 1921, asociada a la ingestión oral de tripomastigotes sanguíneos y, en 1933, por las heces de triatominos. Desde entonces, se sospecha que la ingestión oral de alimentos y/o bebidas contaminados con el parásito o, incluso, carne de animales salvajes infectados cruda o poco cocida, causan la enfermedad de Chagas (EC). Otra fuente potencial de contaminación por exposición ambiental son las secreciones olorosas de los didélfidos provenientes de la glándula anal de un marsupial infectado, como Didelphis marsupialis.
Para completar su ciclo de vida, el parásito circula naturalmente entre el insecto vector triatomino (más comúnmente conocido como “pito” en Colombia) y otros mamíferos selváticos, peridomésticos y domésticos susceptibles y reservorios potenciales (incluidos caninos y seres humanos). Las vías de transmisión oral en los ciclos selváticos ocurren de 2 maneras distintas. Esto incluye mamíferos no infectados que consumen y comen a un mamífero infectado y mamíferos no infectados que consumen un insecto triatomino infectado. En toda Colombia, la transmisión vectorial persiste en varias regiones como los municipios de Aguachica, Yopal y Paz de Ariporo (Casanare), Sierra Nevada de Santa Martha y, en los departamentos de Magdalena, La Guajira, Boyacá, Santander, Bolívar, Arauca, Antioquia, Chocó y Cesar, aunque los datos son limitados para la mayor parte de Colombia.
Durante varias décadas, las campañas dirigidas al control de vectores (Iniciativa de Países Andinos) han tenido éxito en la reducción de la transmisión vectorial intradoméstica causada por Rhodnius prolixus. La reducción o eliminación de R. prolixus en los seres humanos y los alrededores de sus viviendas ha llevado a que otras especies de triatominos llenen ese vacío en la red alimentaria. Esto incluye las especies de triatominos T. dimidiata, T. venosa, T. maculata y R. pallescens. En gran medida, ahora se está demostrando que los triatominos selváticos, peridomésticos y domésticos de estas especies invaden comúnmente a los seres humanos y plantean preocupación por los vectores emergentes de EC en Colombia.
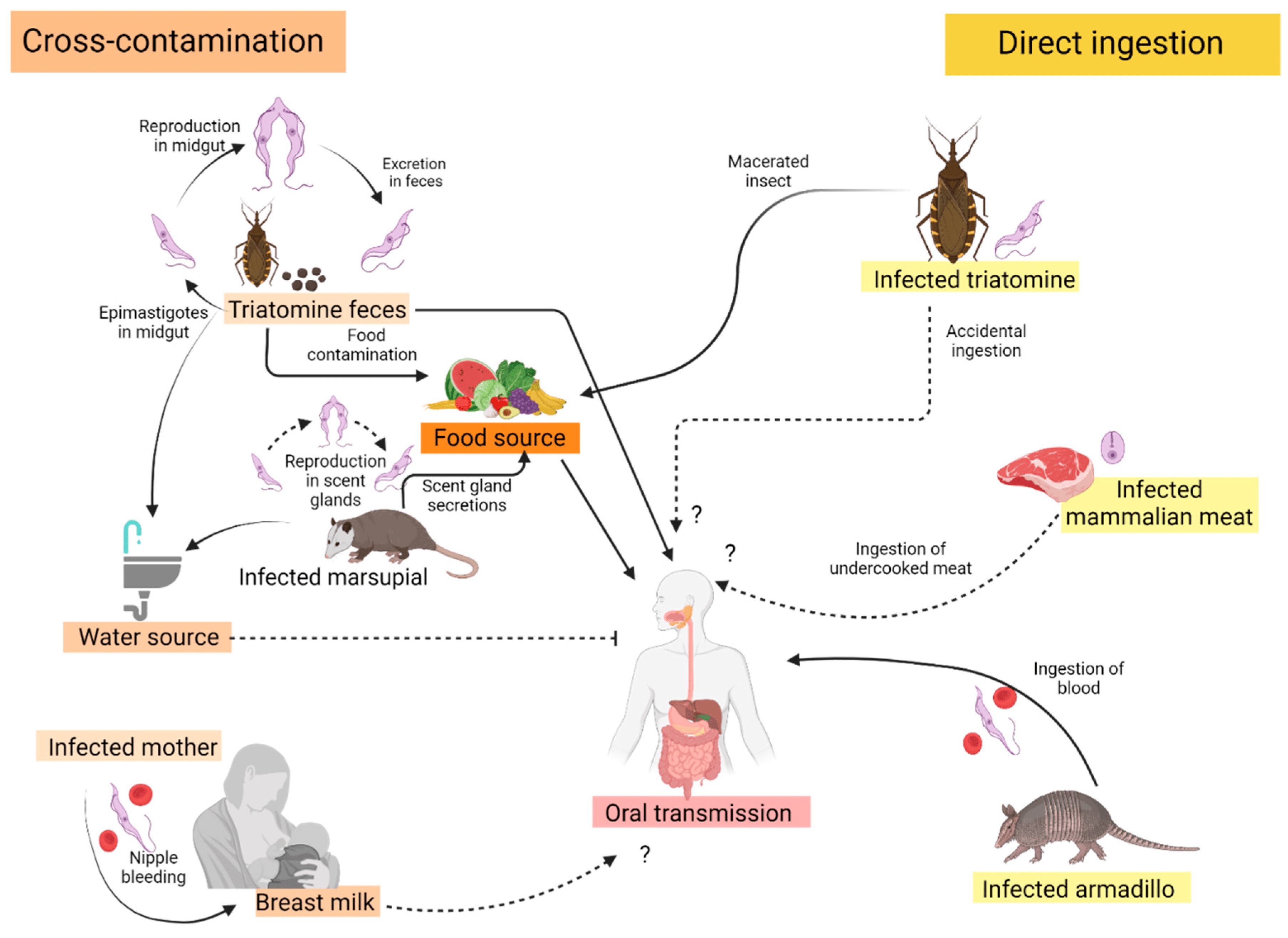
Figura: Fuentes confirmadas (flecha negra) y propuestas (flecha negra punteada) de transmisión oral de la enfermedad de Chagas en Colombia.
Manifestaciones clínicas de la enfermedad de Chagas oral
Desde la primera evidencia reportada de transmisión oral en 1965, los brotes de enfermedad de Chagas (EC) oral han ganado importancia como vía de transmisión emergente. Se calcula que en determinadas regiones geográficas, como la cuenca del Amazonas, la transmisión oral ocurre hasta en el 50% de los casos. Debido a la gravedad de la enfermedad, muchos de los infectados por ingestión oral manifiestan signos y síntomas importantes de infección de EC aguda, lo que puede provocar miocarditis fulminante e insuficiencia cardíaca, meningoencefalitis e, incluso, un shock potencialmente mortal por parasitemia.
El período de incubación después de la ingestión oral de productos contaminados con T. cruzi es de unos 3 a 22 días, en contraste con 4 a 15 días para la transmisión vectorial y 8 a 160 días para la transmisión relacionada con transfusiones y trasplantes. Si la incubación es más corta probablemente se deba a un aumento de la carga de parásitos en general, importante en comparación con las otras vías de transmisión.
Los síntomas y la rápida progresión de la enfermedad en inmunocompetentes no son comunes como en otras formas de transmisión como la vectorial, congénita o transfusional. La gran mayoría de las personas con EC oral aguda tienen fiebre (71-100%) pero son importantes otros síntomas sistémicos que incluyen edema facial, edema de las extremidades inferiores, mialgia, linfadenopatía generalizada, malestar abdominal, disnea, vómitos, diarrea, hepatomegalia, esplenomegalia, cefalea, dolor torácico, erupción cutánea eritematosa, ictericia, artralgias, epistaxis, hematemesis, melena y palpitaciones.
El edema facial, que suele afectar toda la cara y parte de los labios, está presente en el 57 al 100% de las personas con EC oral aguda.
Esto puede diferenciarse de la transmisión vectorial, en la que es más común hallar hinchazón periorbitaria unilateral en personas con síntomas agudos (también conocida como signo de Romaña).
Se cree que la significativa respuesta inmunitaria sistémica que se observa en personas con EC oral aguda se debe a una transmisión más eficiente después de la penetración por las vías oral, faríngea y mucosa gástrica. Por otra parte, también se observan cargas parasitarias muchas veces mayores en alimentos y bebidas contaminados en comparación con la transmisión vectorial y, por lo tanto, signos y síntomas clínicos de infección exacerbados. Se ha estimado que un solo triatomino triturado que alberga T. cruzi puede contener 600.000 tripomastigotes metacíclicos en comparación con 3000 a 4000/microlitro de materia fecal de triatominos infectados.
El mayor brote de transmisión oral de Chagas estuvo vinculado al consumo de jugo de guayaba contaminado en una escuela primaria venezolana de Caracas. El brote reportó un total de 119 casos de EC confirmados y sospechosos. El curso clínico de los casos confirmados o sospechosos mostró que el 75% fueron sintomáticos y el 20,3% requirieron hospitalización. Un niño de 5 años murió de miocarditis aguda. Hasta en el 95-99% de los casos estos porcentajes difieren de los reportados en las EC transmitidas vectorialmente, reportadas como asintomáticas en la fase aguda de la infección.
Las anomalías cardíacas se observan con mayor frecuencia después de la transmisión oral de T. cruzi como opuesto a la transmisión vectorial. Con esta transmisión en la mayoría de los pacientes se observan anomalías cardíacas, específicamente alteraciones de la polarización ventricular y afectación pericárdica como se comprobó en jóvenes soldados colombianos.
Las anomalías electrocardiográficas en la enfermedad de Chagas (EC) oral, como ocurrió en el brote más grande reportado (N = 103), estuvieron presentes en el 66% de los casos confirmados y se reportan con predominio en niños <18 años en comparación con los adultos infectados (69,7% vs. 56%). Las alteraciones electrocardiográficas más frecuentemente observadas incluyen anomalías del segmento ST y de la onda T (37%) así como prolongación del intervalo QT (2,9%).
El bloqueo de rama derecha, que es común en la cardiopatía chagásica crónica, también se observó en la EC oral aguda, pero con una frecuencia mucho menor (1,94%, N = 2/103); el bloqueo de rama izquierda se observó en el 2,9% de los casos (N = 3/103). En ambos grupos etarios se observaron anomalías de la onda T que fueron más comunes en <18 años (72% vs. 19%) en comparación con los adultos.
En el estudio, el hallazgo de un ECG anormal (66%; N = 68/103) motivó la realización de un ecocardiograma, lo que reveló un 32% (N = 22) de pacientes con derrame pericárdico leve a moderado y un 33% (N = 33/103) con arritmias. Esto incluye arritmias supraventriculares (22%; (N = 23/103), arritmias ventriculares (5,8%; N = 6/103) y bloqueo auriculoventricular (2,9%; N = 3/102). En el 27% de los casos de EC oral también se halló disfunción ventricular con baja fracción de eyección.
Patogenia por transmisión oral de T. cruzi
T. cruzi es un parásito generalista que puede infectar a >136 especies de vectores triatominos, esencialmente cualquier mamífero y a casi todos sus tejidos. El ciclo de vida de este parásito, un cinetoplasto flagelado, involucra 3 formas distintas, el tripomastigote y formas amastigotas de relevancia clínica. La patogénesis tradicional de T. cruzi sigue la ruta de circulación sistémica del tripomastigote, la adherencia al tejido muscular liso, la conversión a la forma amastigote, la reproducción intracelular de los amastigotes y la expansión del nido y, eventual daño celular que produce la salida del parásito. El ciclo se repite con los tripomastigotes recién formados que circulan sistémicamente. T. cruzi demuestra tropismo por los tejidos cardíaco y muscular liso gastrointestinal, aunque el parásito puede estar diseminado en todo el cuerpo humano.
Su crecimiento intracelular produce una pronunciada respuesta de infiltrado inflamatorio con daño celular que se presenta como lesiones inflamatorias y fibrosis. El infiltrado inflamatorio puede destruir directamente las neuronas y las fibras cardíacas, en contraste con el daño fibrótico físico causado por nidos de amastigotes necróticos. Este ciclo se enlentece y se vuelve subclínico durante la fase intermedia que, sin quimioterapia, dura indefinidamente. En casi el 30% de los pacientes, este ciclo celular de daño continúa crípticamente a un ritmo acelerado hasta que la enfermedad avanza y se manifiesta clínicamente.
Los factores que contribuyen a la patogénesis y la reactivación son en gran medida desconocidos pero se cree que se correlacionan con la unidad de tipificación discreta del parásito (DTU, por sus siglas en inglés), las dietas hipergrasas, las coinfecciones y la inmunogenética del huésped. Los modelos murinos indican 3 posibles vías patógenas que contribuyen de modo colectivo, independiente o inverso al daño celular: autoinmune, neurogénico o proinflamatorio mediado por ciertas citocinas como la interleucina (IL) -6 y la IL-17. Si bien la evidencia apoya las 3 vías, la evidencia contemporánea más sólida sustenta un mecanismo patogenético de activación autoinmune del huésped y material parasitario persistente que estimulan su respuesta inflamatoria.
Se cree que en la mayoría de las personas infectadas, la infección ha sido adquirida a través de la transmisión vectorial. Se trata de un triatomino infectado que defeca heces conteniendo tripomastigotes metacíclicos mientras muerde al individuo. Luego, el parásito puede ingresar al cuerpo a través de la mucosa o una brecha en la piel, en el sitio de la picadura o cerca de ella. El resto de quienes adquieren la infección pueden hacerlo por consumo oral, embarazo u otras vías. Dada la reciente aparición y rareza de la transmisión oral de T. cruzi, la literatura científica sobre la fisiopatología es escasa. Los informes de casos verifican que este mecanismo se asocia con mayores manifestaciones de la enfermedad y alta mortalidad, lo que sugiere que se produce una patogénesis alternativa de la enfermedad aguda.
Alimentos y bebidas contaminados con T. cruzi
Ingestión de jugos de frutas y alimentos contaminados con T. cruzi
En Colombia, la enfermedad de Chagas (EC) se ha asociado con el posible consumo de jugos de fruta y alimentos contaminados.
En otros huéspedes mamíferos, la vía oral es la forma de transmisión más importante. En los seres humanos se debate cuáles son las principales fuentes de infección bucal, de alimentos contaminados a través de heces de triatominos o triatominos macerados directamente en bebidas y jugos de frutas. Estas fuentes de alimentos contaminados combinan alimentos específicos que tienen más probabilidades de estar contaminados por insectos o heces de insectos. Sin embargo, cualquier comida o bebida puede no estar en buenas condiciones y podría contaminarse potencialmente con secreciones de la glándula olfativa de un animal que pueda estar contaminado.
La mayoría de las veces no se describe el origen de estas transmisiones orales: Sin embargo, en Colombia existen 2 bebidas que se han asociado con la enfermedad de Chagas (EC) oral: el vino de palma y el jugo de mandarina. En 1999, durante un brote en el municipio de Guamal (Magdalena), se hallaron 18 casos asociados al vino de palma, una bebida fermentada común en algunas regiones colombianas. Esta bebida se prepara realizando un corte profundo en la palma hasta llegar al corazón para obtener la savia, recogiendo varios litros que luego se dejan fermentar. En ocasiones, esta bebida se consume inmediatamente y podría infectarse por las heces de triatominos, los que luego podrían transmitir al parásito por vía oral.
En 2008, un brote se asoció con la ingestión de jugo de mandarina y se describió como una fuente de EC adquirida por vía oral en Santander. Afectó a 9 personas que visitaron la misma finca y todas tomaron el mismo jugo en el desayuno. Se pensó que la fuente posible era el jugo de naranja contaminado con las heces de los insectos que contaminan las naranjas usadas para obtener el jugo, o por triatominos infectados macerados dentro de la caña del azúcar que posteriormente se habría mezclado con el jugo. Ya que el jugo de naranja no era macerado sino exprimido, no está claro cómo se contaminó el jugo, lo que inclina la sospecha hacia la contaminación de la caña de azúcar.
Una serie de casos publicada en 2022 describió 2 casos pediátricos de EC oral aguda, supuestamente relacionada con el consumo de jugo de caña de azúcar, también denominado “guarapo de caña”. De manera similar, los estudios en animales demuestran que el jugo de la caña de azúcar puede permanecer infeccioso hasta 24 horas después de la inoculación.
El jugo de açai es una fuente común de enfermedad de Chagas (EC) adquirida por vía oral en Brasil, aunque los colombianos tienen algunas granjas nacionales de fruta de açai y regularmente importan este jugo de Brasil. Se cree que los triatominos infectados o los frutos contaminados con heces de triatominos se maceran con los frutos, contaminando así la bebida. En un estudio experimental se observó que el parásito sobrevive entre 24 y 72 horas en varias bebidas, entre ellas mandarina, guayaba y guanábana, y hasta 384 horas en guanábana conservada a 4◦C. Los resultados fueron reproducidos en un estudio separado con condiciones similares para el jugo de açai.
Por otra parte, algunas poblaciones utilizan culturalmente el jugo de açai como una forma de destetar a los bebés de la leche materna y así, los bebés han desarrollado miocardiopatía de Chagas tras el consumo de jugo de açai contaminado. Teniendo en cuenta que los jugos se suelen consumir enseguida después de su preparación, es importante señalar la posibilidad de que la transmisión se haga en 24 horas. No se ha documentado directamente que ningún otro jugo o alimento sea una fuente de infección en Colombia, pero otras formas de contaminación de alimentos y bebidas pueden suceder y deben ser consideradas.
Consumo de carne de mamíferos infectados por T. cruzi
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.