Un equipo de investigadores de la Universidad de Bath, en colaboración con las Universidades de Oxford y Bristol, ha desarrollado una molécula que previene la acumulación tóxica de alfa-sinucleína, una proteína asociada con la enfermedad de Parkinson y algunas demencias. Este descubrimiento, probado en modelos de laboratorio y animales, muestra resultados prometedores en la estabilización de la proteína y la mejora de la función motora.
La alfa-sinucleína es una proteína que se encuentra naturalmente en las células cerebrales (neuronas), donde regula la liberación de neurotransmisores como la dopamina, permitiendo la sinapsis. En la enfermedad de Parkinson, esta proteína se agrupa en grumos tóxicos que causan la muerte de las células nerviosas, lo que lleva a síntomas como temblores, dificultades para moverse y rigidez muscular.
El equipo de investigadores diseñó un fragmento de péptido que bloquea la conversión de la alfa-sinucleína en grumos tóxicos, manteniéndola en su forma no tóxica. Las pruebas de laboratorio mostraron que el péptido es estable, penetra en células similares a las cerebrales y restaura el movimiento al tiempo que reduce los depósitos de proteína en un modelo animal de la enfermedad de Parkinson.
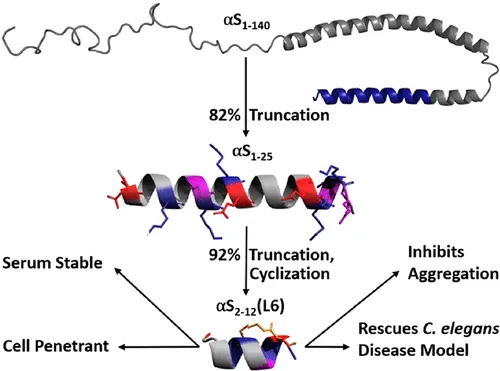
El avance demuestra el potencial del diseño racional de péptidos para transformar proteínas grandes e inestables en moléculas compactas similares a fármacos. La profesora Jody Mason, del Departamento de Ciencias de la Vida de la Universidad de Bath, comentó: "Nuestro trabajo muestra que es posible diseñar racionalmente pequeños péptidos que no solo previenen la agregación proteica dañina, sino que también funcionan dentro de sistemas vivos".
Julia Dudley, jefe de investigación en Alzheimer's Research UK, que financió la investigación, añadió: "La demencia no es una parte inevitable del envejecimiento; es causada por enfermedades como el alzhéimer. Para avanzar hacia una cura para todas las formas de demencia, necesitamos investigación enfocada en desarrollar una amplia gama de tratamientos que puedan ralentizar, detener y, en última instancia, revertir estas enfermedades".
Aunque la investigación se encuentra en una etapa temprana en un modelo animal, esta nueva molécula podría prevenir la acumulación de alfa-sinucleína mal plegada. Al estabilizarla en su forma "saludable", abriría la puerta a una nueva clase de tratamientos que podrían ralentizar la progresión en enfermedades como el párkinson y la demencia con cuerpos de Lewy.
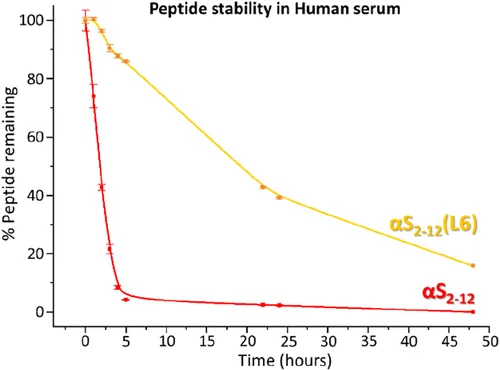
Lactamización de αS2–12(L6) mejora la estabilidad de los péptidos en el suero humano. La estabilidad sérica se evaluó mediante la incubación de αS2–12 (lineal) y αS2–12(L6) (lactamizado) en suero humano a 37 °C. La concentración de péptidos se cuantificó mediante HPLC analítica en puntos temporales seleccionados y se normalizó a t = 0. Después de 5 h, el 96% de los αS lineales2–12 se degradó, mientras que solo el 14% de los αS lactamizados2–12(L6), lo que indica un aumento sustancial de la resistencia a la proteasa conferida por la restricción de lactámicos. Los datos representan la media de tres experimentos independientes.