|
Resumen • Definición: la gastroparesia es un trastorno caracterizado por retardo del vaciamiento gástrico de los alimentos sólidos en ausencia de obstrucción mecánica del estómago. • Síntomas: Saciedad precoz, plenitud posprandial, náuseas, vómitos, eructos y distensión abdominal. • Diagnóstico: mediante medición del retraso del vaciamiento gástrico por gammagrafía gástrica o prueba del aliento. • Etiología: la gastroparesia puede ser idiopática, diabética, iatrogénica, pos quirúrgica o pos viral. • Tratamiento: corregir las deficiencias de líquidos, electrolitos y nutrientes; identificar y tratar la causa y eliminar los síntomas con fármacos |
La función clave del estómago es producir ácido y facilitar la digestión de los alimentos. Las funciones motoras principales son la acomodación, que permite la recepción y el almacenamiento de los alimentos, seguida por la trituración y el vaciamiento de los alimentos sólidos.
La gastroparesia es un trastorno crónico caracterizado por retardo del vaciamiento gástrico posprandial en ausencia de obstrucción mecánica. Los síntomas principales son saciedad tras haber ingerido unos pocos bocados, náuseas, vómitos, eructos y distensión abdominal. La causa es la disfunción neuromuscular que conduce al retardo del vaciamiento gástrico.
La gastroparesia puede ser idiopática, estar asociada con la diabetes mellitus o con trastornos neurológicos, aparecer tras una intervención quirúrgica o tras una infección viral o bacteriana. Además, muchos otros trastornos, entre ellos la enfermedad de Parkinson, las colagenopatías vasculares y la seudobstrucción intestinal crónica, (SOIC) pueden conducir a la gastroparesia.
Existe superposición de los síntomas entre la gastroparesia y el síndrome de distrés postprandial, que es uno de los tipos de dispepsia funcional.
| Epidemiología |
Conocer la epidemiología global de la gastroparesia es difícil, ya que algunos de sus síntomas, como molestia o el dolor epigástricos, eructos, distensión abdominal, saciedad precoz, se superponen con los de la dispepsia funcional. Una causa importante de gastroparesia es la diabetes mellitus.
La prevalencia de gastroparesia es similar en la diabetes 1 y 2. Es necesario documentar el retardo del vaciamiento gástrico mediante la gammagrafía gástrica o la prueba del aliento a fin de distinguir entre la gastroparesia y la dispepsia funcional.
> Incidencia y prevalencia
Un estudio demográfico de los E.E.U.U. estimó que la incidencia de gastroparesia ajustada para la edad durante un período de 10 años fue de 2,4 pacientes por 100.000 años persona para los hombres y 9,8 pacientes por 100.000 años persona para las mujeres; la prevalencia se estimó en 9,6 pacientes por 100.000 para los hombres y 37,8 pacientes por 100.000 para las mujeres.
Según un estudio hasta el 1,8% de la población general quizás sufra gastroparesia, pero solo se diagnostica al 0,2%. Es posible que esto se relacione con la falta de conciencia de la enfermedad y con la confusión diagnóstica causada por la superposición de los síntomas de la gastroparesia y la dispepsia funcional.
> Factores de riesgo
No se sabe con certeza el motivo de la mayor incidencia y prevalencia de gastroparesia en las mujeres. La motilidad gástrica depende de la síntesis neuronal de óxido nítrico y esa vía puede ser regulada por el estrógeno.
Hay pocos estudios acerca del efecto de la masa corporal sobre la gastroparesia. En un estudio de pacientes con diabetes tipo 2, la obesidad se asoció con casi 10 veces mayor posibilidad de sufrir síntomas de gastroparesia. Casi el 50% de los pacientes con gastroparesia idiopática tienen sobrepeso o son obesos.
Gastroparesia diabética. En una cohorte de pacientes con diabetes mellitus y personas de control (269 con diabetes tipo 1, 409 con diabetes tipo 2 y 735 individuos de control), las proporciones acumuladas de pacientes que sufrieron gastroparesia durante un período de 10 años fueron el 5,2% de pacientes con diabetes tipo 1, el 1,0% de pacientes con diabetes tipo 2 y el 0,2% de las personas de control.
La gastroparesia en los pacientes con diabetes mellitus se asocia con otras complicaciones, entre ellas retinopatía y neuropatía periférica, mayores valores medios de hemoglobina glucosilada (HbA1c) y menor nivel socioeconómico.
Entre los pacientes con diabetes mellitus, la gastroparesia puede persistir hasta 25 años a pesar del descenso de los valores de glucemia.
| Mecanismos y fisiopatología |
Si bien hubo adelantos en los conocimientos de los mecanismos y la fisiopatología de la gastroparesia, aún hay lagunas, inconsistencia entre los estudios y diferencias según los distintos grupos etiológicos.
> Función neuromuscular gástrica
La gastroparesia y la disminución de la acomodación gástrica se producen debido a la disfunción neuromuscular del estómago. La trituración de los alimentos en el estómago los reduce a fragmentos que son licuados por la combinación de la digestión por el ácido gástrico y las contracciones del antro. Estas contracciones establecen grandes fuerzas líquidas de cizallamiento y empujan a las partículas contra el píloro, que está cerrado antes de que las partículas de ~1–2 mm pasen al duodeno.
La inervación gástrica por el vago aferente es esencial para la acomodación gástrica de los alimentos consumidos. Las contracciones gástricas son inducidas por la inervación vagal extrínseca y las neuronas colinérgicas intrínsecas.
Además, los mecanismos inhibitorios intrínsecos, como las neuronas nitrérgicas, facilitan la relajación pilórica y el peristaltismo intragástrico. Las neuronas nitrérgicas son esenciales para la relajación del músculo GI antes de una contracción y son responsables de la inhibición ascendente de la contracción, que es inducida por neuronas excitatorias, como la neuronas colinérgicas y taquinérgicas.
Estos efectos neurales inhibitorios y excitatorios se transmiten a través de las células intersticiales de Cajal (CIC) a las células del músculo liso GI. Esto causa que la capa muscular del estómago se comporte como un sincicio eléctrico multicelular, de modo que las contracciones coordinadas que se inician en el estómago proximal e involucran a toda la circunferencia gástrica se puedan propagar hacia la región antropilórica.
Este sincicio eléctrico está formado por las células del músculo liso, las CIC y células tipo fibroblastos, que son positivas para el receptor α (PDGFRα) derivado de las plaquetas.
Las CIC y las células positivas α PDGFR se consideran células marcapaso del tubo digestivo y poseen la capacidad de transmitir señales eléctricas. En la gastroparesia, el retardo del vaciamiento gástrico se asocia con hipomovilidad del antro y, en algunos pacientes, con disfunción del esfínter pilórico causada por disfunción neuromuscular.
> Neuropatía intrínseca
Estudios recientes exploraron las características histopatológicas y la expresión de neurotransmisores en el tejido gástrico para dilucidar los mecanismos intrínsecos involucrados en la función motora gástrica. En un estudio de biopsias gástricas efectuado con microscopía óptica no se hallaron diferencias estadísticamente significativas entre la gastroparesia diabética y la idiopática en nueve criterios de valoración morfológicos.
Se halló sin embargo disminución de la cantidad de neuronas inhibitorias que expresaran la óxidonítrico sintasa neuronal (nNOS) en pacientes con gastroparesia, con disminución de las neuronas nNOS en el 40% de los pacientes con gastroparesia idiopática y en el 20% de los pacientes con gastroparesia diabética en relación con individuos de control.
La reducción de las neuronas nNOS positivas puede contribuir al retardo del vaciamiento gástrico al disminuir la coordinación del peristaltismo gástrico que es esencial para la trituración de los alimentos sólidos en el antro gástrico.
Participación del sistema inmunitario. Estudios proporcionaron información discordante sobre las células inmunitarias en muestras de biopsia — disminución del número de macrófagos M2 en un estudio, pero números similares a los del tejido sano en otro.
Estas observaciones contradictorias sobre los macrófagos M2 se complican porque la función del nervio vago (que afecta la función de las células inmunitarias) no se estudió en relación con los datos histopatológicos y la neuropatía vagal se asocia con la gastroparesia diabética.
Las señales vagales eferentes liberan noradrenalina de los nervios esplénicos y el transmisor activa el receptor adrenérgico β2 (β2-AR) expresado en las células T, que activa las mismas para liberar acetilcolina, que actúa sobre el receptor de acetilcolina α7-nicotínico (α7-nAChR) de los macrófagos y otras células inmunitarias. Por último, toda la vía estimulada por el vago suprime la liberación de citosinas proinflamatorias.
Haem oxygenasa 1. La HO1 atenúa la producción global de especies reactivas del oxígeno. En tejidos gástricos obtenidos de modelos animales, la pérdida de HO1 produce aumento del estrés oxidativo, pérdida de expresión de Kit (que implica sobre todo la pérdida de CIC) y disminución de la expresión de nNOS, así como desarrollo de retardo del vaciamiento gástrico.
Estas observaciones llevaron a la hipótesis de que cuando los macrófagos no producen HO1 para reducir el estrés oxidativo (consecuencia frecuente de la diabetes), los mecanismos intrínsecos responsables de la función motora normal se dañan.
Las alteraciones de la actividad de HO1 que se pueden producir por la variación en la expresión de HMOX1 que codifica a HO1) apoyan la posible asociación entre la alteración de la función de HO1 y la gastroparesia.
> Gastroparesia diabética
La gastroparesia diabética es multifactorial y contribuyen a ella la hiperglucemia, la desnervación extrínseca (vagal) y la desnervación neural intrínseca.
Los mecanismos parecen ser los mismos en la diabetes tipo 1 y tipo 2, probablemente porque la gastroparesia tiende a aparecer años después del diagnóstico de diabetes, asociada con otras características como la neuropatía y el estrés oxidativo, propios de ambos tipos de diabetes.
Hiperglucemia. La importancia de la hiperglucemia en la fisiopatología de la gastroparesia diabética es poco clara. Estudios sobre la historia natural de la enfermedad proporcionan evidencia incierta de la relación entre la normalización de la glucemia y el vaciamiento gástrico.
En un estudio de 129 pacientes, la HbA1c no fue un factor pronóstico estadísticamente significativo de gastroparesia. Tampoco se sabe con certeza si la mejoría de la hiperglucemia crónica mejora el vaciamiento gástrico.
> Gastroparesia iatrogénica y quirúrgica
La asociación quirúrgica más frecuente con la gastroparesia es con la fundoplicatura y los procedimientos bariátricos. Las asociaciones iatrogénicas más frecuentes son con los agonistas μ-opioides y los fármacos hipoglucemiantes como los análogos de la amilina o los análogos o agonistas del péptido 1 tipo glucagón (GLP1), como liraglutida y exenatida. Los medicamentos para el parkinsonismo, entre ellos la levodopa y los anticolinérgicos también pueden causar gastroparesia iatrogénica.
Gastroparesia posquirúrica. La gastroparesia posquirúrgica por lo general es causada por lesión o aprisionamiento del nervio vago. Esto ocurre más comúnmente con la fundoplicatura o la cirugía bariátrica.
Opioides. Los agonistas μ-opioides como la codeína, la oxicodona y la morfina tienen efectos farmacológicos sobre el tubo digestivo. En el estómago, los opioides estimulan el tono del esfínter pilórico e inhiben la motilidad gástrica, como la contractilidad del antro. Producen así alteración del vaciamiento gástrico, náuseas posprandiales y saciedad precoz.
> Posviral
La gastroparesia se asoció raras veces con infecciones virales específicas, como el virus de Epstein–Barr, el norovirus, el herpes virus y el citomegalovirus, habitualmente en asociación con la aparición de disfunción neurovegetativa, como hipotensión postural o sudoración anormal. Esta forma de gastroparesia postviral en el marco de la disautonomia tiene mal pronóstico.
Cuando una enfermedad viral precede al inicio de la gastroparesia generalmente el pronóstico es bueno.
> Otras causas de gastroparesia
Los trastornos gástricos neuromusculares se pueden producir por desnervación extrínseca, neuropatía intrínseca o problemas de las células marcapaso o del músculo liso. Estos últimos son los trastornos miopáticos, que pueden ser infiltrativos, como la esclerodermia, o degenerativos como la miopatía de vísceras huecas o la amiloidosis.
Las enfermedades miopáticas se asocian siempre con un componente de trastorno de la motilidad más generalizado, que afecta a otras zonas del intestino.
Más aún, la esclerodermia se asocia con características sistémicas como el síndrome CREST (por las siglas del inglés de calcinosis, Raynaud, esofágico, esclerodactilia y telangiectasia). Se considera que la degeneración de las células del músculo liso o la fibrosis de alrededor son el mecanismo subyacente de la deficiencia del vaciamiento gástrico en estas enfermedades.
| Diagnóstico, pesquisa y prevención |
En general, la gravedad de la gastroparesia se evalúa por el grado de deficiencia nutricional, el descenso de peso o el grado de demora del vaciamiento gástrico (por ejemplo, la proporción de alimentos retenidos en el estómago cuatro horas después).
> Signos y síntomas
Los síntomas de gastroparesia comprenden náuseas, vómitos, saciedad temprana, plenitud postprandial, distensión abdominal, eructos y molestias epigástricas. Existen varias escalas de gravedad de los síntomas
(Gastroparesis Symptom Index (GCSI) y GCSI–Daily Diary (GCSI-DD)).
> Conjunto de síntomas. Los síntomas principales de la gastroparesia aparecen en conjunto, no como síntomas separados — por ejemplo, dolor con saciedad temprana y acidez; acidez con distensión abdominal, saciedad temprana, náuseas y vómitos; regurgitación con distensión abdominal, náuseas y vómitos
> Diagnóstico
Los pacientes con síntomas abdominales posprandiales, como náuseas, vómitos plenitud posprandial, distensión abdominal y epigastralgia son candidatos para la pruebas de motilidad gástrica. Primero se les debe efectuar una endoscopía gastroesofagoduodenal. Si esta no revela la causa de los síntomas, se pueden iniciar las investigaciones de motilidad y funcionales.
El cuadro 1 muestra algunos de los estudios más empleados para medir la motilidad gástrica en una presunta gastroparesia.
Cuadro 1. Pruebas de vaciamiento gástrico
| Método | Ventajas | Limitaciones |
| Gammagrafía con alimentos sólidos | Está respaldado por estudios. Es reproducible. | Los pacientes asíáticos no están familiarizados con los alimentos occidentales. Algunos pacientes no toleran los alimentos sólidos. |
| Prueba de aire exhalado con isótopos estables. | Procedimiento sencillo. No emite radiaciones. | Fácilmente influido por la actividad física. |
| Cápsulas motoras inalámbricas. | Aporta información sobre el tránsito en el intestino delgado y el colon | Esta prueba aún no está validada para pacientes con presunta gastroparesia. |
Manometría gastroduodenal. La manometría antroduodenal es una técnica empleada solo en muy pocos centros. Consiste en la medición intraluminal de la presión en el estómago distal y en el asa duodenal en ayunas y después de comer y se la emplea para evaluar alteraciones de la motilidad gástrica o del intestino delgado.
> Diagnóstico diferencial
Los síntomas de la gastroparesia son inespecíficos y se pueden producir debido a otros trastornos sensitivos o motores del tubo digestivo superior, entre ellos la afectación de la acomodación gástrica.
La gastroparesia es indistinguible de la dispepsia funcional con retardo del vaciamiento gástrico. Se estima que alrededor del 25–35% de los pacientes con síntomas dispépticos tienen retardo del vaciamiento gástrico.
La gastroparesia grave se debe diferenciar de la SOIC. Ambas tienen manifestaciones clínicas similares, alteraciones motoras GI y alguna forma de trastorno neuromuscular subyacente. La diferencia principal es que los pacientes con SOIC sufren episodios que semejan una obstrucción intestinal mecánica y pueden estar expuestos a procedimientos quirúrgicos inútiles y hasta peligrosos.
Otros problemas que se deben diferenciar de la gastroparesia son el síndrome de rumiación, el síndrome de hiperemesis por canabinoides y el síndrome de vómitos cíclicos. El síndrome de naúseas y vómitos crónicos también tiene superposición de síntomas con la gastroparesia y la dispepsia funcional.
Los pacientes con síndrome de rumiación regurgitan repetida e involuntariamente los alimentos parcialmente o no digeridos, los mastican nuevamente y luego los vuelven a deglutir o los expulsan de la boca. El diagnóstico se basa sobre una anamnesis cuidadosa y la observación clínica. Las principales características que distinguen s estas dos entidades de la gastroparesia es que ambas son asintomáticas entre los episodios.
> Prevención
Existen pocas estrategias preventivas específicas para la gastroparesia. La normalización de la hiperglucemia en los pacientes con diabetes mellitus puede prevenir la aparición de neuropatía diabética. El riesgo de gastroparesia posquirúrgica puede disminuir con la piloroplastia, que es una incisión de la zona pilórica que aumenta el diámetro de la unión gastroduodenal y elimina todo impedimento al tránsito, a fin de mejorar el vaciamiento gástrico en pacientes sometidos a cirugía gástrica.
Por último, la elección de la medicación puede contribuir a prevenir la gastroparesia iatrogénica (por ejemplo la gastroparesia asociada a los opioides) empleando otros fármacos.
| Tratamiento |
El tratamiento de la gastroparesia comprende:
- Corregir las deficiencias de líquidos, electrolitos y nutrientes
- Identificar y tratar la causa del retardo del vaciamiento gástrico
- Eliminar los síntomas.
Las estrategias terapéuticas se basan sobre la modificación alimentaria, los medicamentos que estimulan la actividad motora gástrica, el tratamiento antiemético y las medidas no farmacológicas, como la intervención endoscópica o quirúrgica o la estimulación eléctrica gástrica. (Véase cuadro 2)
Cuadro 2. Estrategias terapéuticas.
| Tipo de tratamiento | Gastroparesia Leve: retención gástrica del 10 al 15% a las 4 horas | Gastroparesia Moderada: retención gástrica del 15 al 35% a las 4 horas | Gastroparesia Grave: retención gástrica > 35% a las 4 horas |
| Alimentación | Comidas frecuentes y reducidas, bajas en grasas y fibras. En partículas pequeñas cuando hay síntomas | Comidas frecuentes y reducidas, bajas. en grasas y fibras. En partículas pequeñas cuando hay síntomas | Comidas licuadas. Empleo habitual de suplementos de nutrientes líquidos |
| Apoyo nutricional | Pocas veces necesario | Líquidos con calorías. Vía oral. Raramente necesita alimentación por sonda endoscópica percutánea yeyunal | Líquidos con calorías. Puede necesitar alimentación por sonda endoscópica percutánea yeyunal |
| Fármacos procinéticos | Metoclopramida | Metoclopramida | Metoclopramida o domperidona. Eritromicina. Pricaloprida |
| Fármacos antieméticos | Prometazina o proclorperazina | Prometazina o proclorperazina. Ondansentron | Ondasentron. Aprepitant o mirtazapina |
| Fármacos moduladores de los síntomas | No necesita | No necesita | Nortriptilina |
| Tratamiento no farmacológico | No necesita | No necesita | Sonda de gastrostomía para descompresión. Procedimientos endoscópicos y laparoscópicos. |
Existen varios fármacos nuevos aún en estudio, como relamorelina y prucalopride, que son procinéticos y estimulan las contracciones gástricas, acelerando el vaciamiento gástrico. La acotiamida también aumenta la acomodación y el vaciamiento gástricos.
Algunos fármacos autorizados para otras enfermedades se emplean también para tratar los síntomas de la gastroparesia, como nortriptilina, amitriptilina y mirtazapina (Véase cuadro 2).
También buspirona, un ansiolítico, aumenta la acomodación gástrica en pacientes con dispepsia funcional y aprepitant se emplea para tratar la emesis inducida por la quimioterapia, siendo eficaz para las náuseas en pacientes con gastroparesia.
> Intervention pilórica
Como ya se mencionó, el retardo del vaciamiento gástrico en la gastroparesia se asocia con hipomotilidad del antro y, en algunos pacientes, con piloroespasmo. La toxina botulínica bloquea el aumento del tono o el espasmo del esfínter pilórico. Las inyecciones de toxina botulínica no producen mejoría sostenida de los síntomas, pero pueden brindar alivio temporario durante unos tres meses.
La piloroplastia (para ensanchar el píloro y prevenir el espasmo) o la piloromiotomía (incisión en la pared del píloro por endoscopía, llamada piloroplastia peroral o POEM gástrica (siglas en inglés de miotomía endoscópica peroral), son procedimientos quirúrgicos o endoscópicos para pacientes resistentes a otros tratamientos, entre ellos los farmacológicos
> Estimulación eléctrica gástrica
Sobre la base delos estudios iniciales que mostraron mejoría de los síntomas, especialmente en pacientes con gastroparesia diabética, el neuroestimulador eléctrico gástrico fue autorizado por la FDA dentro del marco de la Humanitarian Device Exemption (Exención para dispositivo de uso humanitario) para tratar las náuseas y vómitos resistentes a los fármacos secundarios a la gastroparesia idiopática o diabética en pacientes de 18–70 años.
En 151 pacientes con gastroparesia resistente, la estimulación eléctrica gástrica mejoró moderadamente los síntomas en el 43%. La respuesta en pacientes con diabetes mellitus fue mejor que en pacientes con gastroparesia de otras etiologías. Se recomienda cautela para indicar este procedimiento fuera de los estudios de investigación.
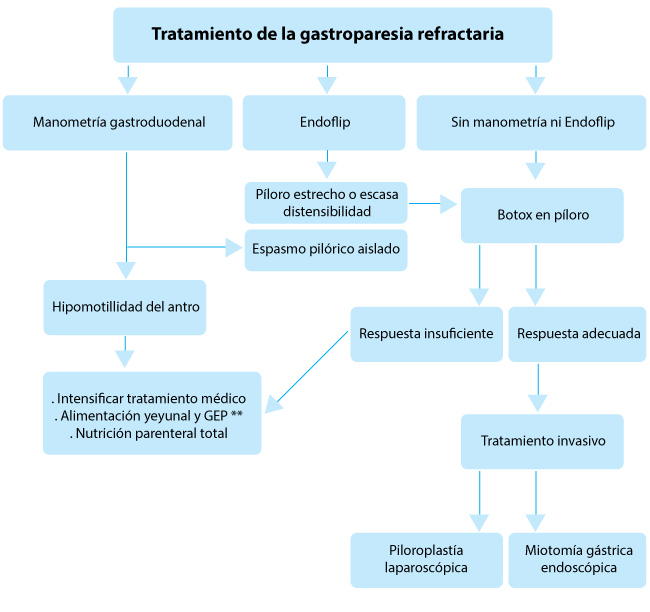 |
| Figura. Algoritmo para el tratamiento de la gastroparesia resistente al tratamiento *Endoflip :mide las anomalías del esfínter pilórico **Gastrostomía endoscópica percutánea |
> Diabetes y gastroparesia
La velocidad del vaciamiento gástrico tiene impacto importante sobre la respuesta glucémica a las comidas con hidratos de carbono en personas sanas y en pacientes con diabetes mellitus, especialmente en el aumento posprandial inicial de la glucemia.
Es por eso que la alteración posprandial de la glucemia es un objetivo importante para el tratamiento de los pacientes con gastroparesia diabética.
En los pacientes tratados con insulina, el retardo del vaciamiento gástrico puede producir discordancias en la sincronización de la insulina exógena, preprandial y la llegada de los nutrientes, entre ellos los hidratos de carbono, del estómago al intestino delgado.
En un estudio con 11 pacientes con diabetes mellitus tipo 1, fue necesario administrar menos insulina a los cinco pacientes con gastroparesia (en relación con los seis pacientes sin gastroparesia) para lograr la euglucemia durante los primeros 120 minutos después de una comida. Asimismo, los pacientes con gastroparesia necesitaron más insulina entre los 180 y los 240 minutos.
Además, recientemente se informó que el vaciamiento gástrico en pacientes con diabetes mellitus tipo 1 se asocia con el aumento global de la glucemia durante el día, que puede reflejar la discordancia entre la sincronización de la insulina preprandial y la absorción más tardía de la comida debido al retardo del vaciamiento gástrico.
Los pacientes con gastroparesia diabética con frecuencia tienen glucemia lábil con períodos de gran hiperglucemia e hipoglucemia frecuente, especialmente posprandial. No existen estudios a largo plazo que documenten la utilidad del mantener una glucemia óptima en pacientes con gastroparesia diabética.
Sin embargo, optimizar el control de la glucemia también puede ser útil en la gastroparesia, como se mostró en un estudio piloto multicéntrico reciente en el que la infusión continua de insulina subcutánea con bomba de insulina, con monitoreo continuo de la glucosa, redujo los valores de hiperglucemia y de HbA1c en pacientes con gastroparesia diabética. Los pacientes también mostraron mejoras en los síntomas de gastroparesia y en la tolerancia a los nutrientes, que se mantuvieron durante la fase de 24 semanas de monitoreo y tratamiento intensivos.
| Calidad de vida |
La calidad de vida (CV) en los pacientes con gastroparesia es inferior a la de la población general, con un nivel similar a la de los pacientes con otras enfermedades médicas y psicológicas.
El grado de disminución de la CV depende de la duración y la gravedad de los síntomas.
Los síntomas principales de la gastroparesia son náuseas y vómitos.
La distensión abdominal y el dolor o molestia epigástrica también afectan la CV. La mayor intensidad de los síntomas se asoció con alteración en el cuestionario sobre CV (PAGI-QOL por las siglas del inglés) y en los componentes físicos y mentales del cuestionario SF-36.
La alteración crónica de la salud y la percepción de enfermedad en los pacientes con gastroparesia parecen afectar negativamente la salud psicológica y la CV.
| Perspectivas |
Los autores ven el futuro con optimismo, ya que se avizoran adelantos importantes.
> Adelantos diagnósticos
Existen nuevas técnicas que se pueden aplicar para investigación o diagnóstico de las disfunciones motoras en la gastroparesia; no obstante estas técnicas exigen más estudio y validación, entre otros aclarar la importancia diagnóstica de la medición de las anomalías del esfínter pilórico mediante Endoflip para identificar la la distensibilidad pilórica patológica.
Además es necesario definir la importancia de la anatomía patológica. Varios estudios demostraron la posibilidad de obtener muestras de biopsia adecuadas de las capas neuromusculares del estómago a fin de investigar la causa de la gastroparesia.
Estudios recientes sugirieron que una técnica nueva de biopsia muscular endoscópica gástrica y duodenal parecía ser técnicamente posible, reproducible y segura a fin de obtener tejido muscular apropiado para evaluar el estado anatomopatológico del sistema nervioso entérico.
> Tratamiento de la hiperglucemia
En pacientes con gastroparesia diabética, la hiperglucemia asociada con discordancia entre el vaciamiento de los nutrientes ingeridos y la administración de insulina preprandial se debe tratar proactivamente. Se recomienda cada vez más que el tratamiento de la diabetes mellitus tipo 1 y 2 sea personalizado según las características de cada paciente.
Una de las variantes fenotípicas que afectan el control de la glucemia es el vaciamiento gástrico. Quizás a futuro la medición de este será habitual a fin de optimizar la dosis de insulina preprandial. La disponibilidad de una prueba del aliento validada y estandarizada y que permite la medición en el lugar de la atención médica sugiere que estas mediciones son factibles. Otra ventaja es que esta técnica permite la identificación precoz de la gastroparesia.
> Tratamiento personalizado
En pacientes con gastroparesia, el tratamiento personalizado puede estar indicado para pacientes con características fisiopatológicas específicas — por ejemplo gravedad del retardo del vaciamiento, hipomotilidad, piloroespasmo, disminución de la acomodación y desnervación vagal extrínseca.
> Nuevos fármacos e intervenciones
Se necesitan nuevos fármacos validados para el tratamiento de la gastroparesis. Algunos agentes farmacológicos nuevos, como reamorelina, prucaloprida y aprepitant son prometedores y necesitan más validación en estudios sólidos de fase III También las intervenciones pilóricas, entre ellas la piloroplastia endoscópica exigen más validación.
Resumen y comentario objetivo: Dr. Ricardo Ferreira