Descubren un mecanismo responsable de la septicemia
De acuerdo con la Organización Mundial de la Salud (OMS), la sepsis o septicemia es una disfunción orgánica, potencialmente mortal, causada por una respuesta desregulada del huésped a una infección.
Una publicación científica reciente, citada por el organismo internacional, estimó que en 2017 hubo cerca de 49 millones de casos de sepsis y 11 millones de muertes relacionadas con esta enfermedad en todo el mundo, lo que representa casi el 20 por ciento de las defunciones globales que se produjeron ese año. Sin embargo, no afecta a todos por igual: aproximadamente el 85 por ciento de los casos y de las muertes relacionadas con esta patología en todo el mundo se produjeron en países de ingresos bajos y en los sectores más vulnerables, en los cuales representa una de las principales causas de morbilidad y mortalidad materna y neonatal.
En ocasiones, la septicemia puede ser consecuencia de la respuesta del sistema inmune a infecciones hospitalarias, que frecuentemente son resistentes a los antibióticos, por lo que se vuelve necesario encontrar terapias alternativas. Pero, dado que esta patología está vinculada, en realidad, a una respuesta inflamatoria exacerbada y desregulada por parte del sistema inmunológico, una vez que el proceso se instauró, es difícil que pueda controlarse conteniendo solamente la infección originaria.
Recientemente, una investigación conjunta entre un equipo de la Facultad de Medicina de la Universidad de Connecticut (UConn Health), dirigido por Vijay Rathinam, y científicos del CONICET del Laboratorio de Inmunopatología del Instituto de Biología y Medicina Experimental (IBYME, CONICET), a cargo de Gabriel Rabinovich, reveló el rol central de la proteína Galectina -1 (GAL1) en el desarrollo de la sepsis.
Como parte del mismo trabajo, los científicos pudieron comprobar que un anticuerpo monoclonal desarrollado en IBYME para neutralizar la Gal1, y publicado recientemente en la revista Angiogenesis, permite atenuar la severidad de los efectos de la sepsis en ratones, reduciendo la letalidad. Este último resultado es muy importante porque alienta la posibilidad de poder obtener, en base a este anticuerpo monoclonal, un tratamiento farmacológico para la septicemia en humanos.
El trabajo, publicado hoy en la prestigiosa revista Nature Immunology, amén de su contribución al área de la biomedicina, permite responder además, al menos en parte, una pregunta que hasta ahora para el campo de Biología Celular y Molecular resultaba un misterio: ¿Cómo es posible que Gal1 se secrete al espacio extracelular cuando tiene todas las características bioquímicas de una proteína que permanece dentro de la célula?
El papel protagónico de Galectina-1 en la septicemia
En el año ’93, Rabinovich -que en ese momento trabajaba en la Universidad Nacional de Córdoba- identificó, junto con su equipo, que GAL1 estaba involucrada en el funcionamiento del sistema inmunológico. Desde ese momento, y por las siguientes tres décadas, numerosas investigaciones avanzaron en mostrar que esta proteína de unión a carbohidratos es un modulador fundamental del sistema inmune, que cumple un rol clave en tumores malignos, infecciones, situaciones de autoinmunidad e inflamación.
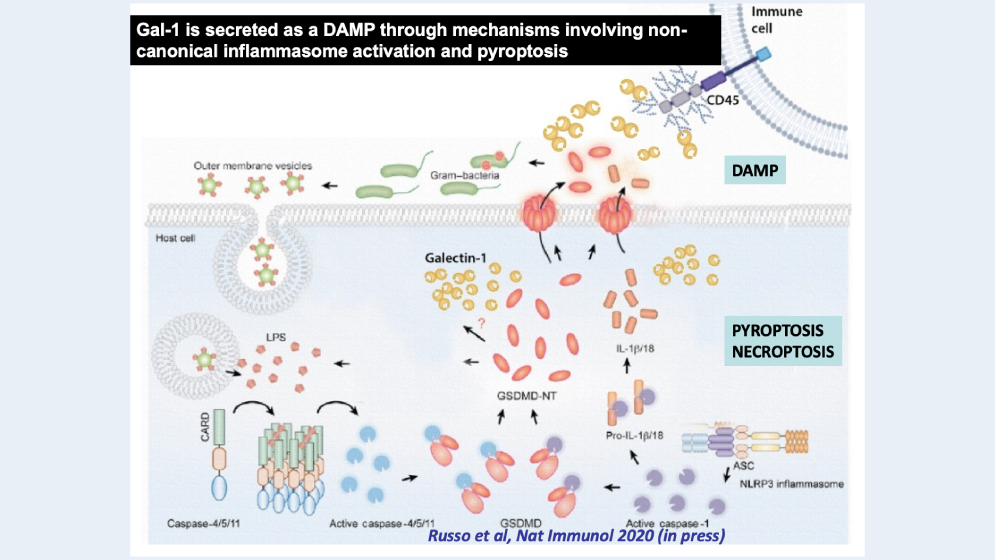
Hace unos años, Vijay Rathinam se comunicó con Rabinovich para pedirle su colaboración. El científico de la Universidad de Connecticut había detectado que entre el grupo de moléculas que liberan las células del sistema inmune en casos de muerte celular inflamatoria (como la piroptosis o la necroptosis), a modo de alarma, se encontraba Gal1 incrementada en forma jerárquica.
Cuando esto ocurre en el marco de una infección tan masiva que el sistema inmunológico no puede dar un respuesta eficaz -como sucede en la sepsis-, este conjunto de moléculas liberadas por las células antes de morir (denominadas alarminas) lo que hacen es contribuir a amplificar la respuesta inflamatoria y hacerla más incontrolable. Fue la experiencia de Rabinovich y el Laboratorio de Inmunopatología del IBYME en el estudio de esta proteína lo que llevo al investigador de nacionalidad india a contactarse con los científicos argentinos.
Hasta esta investigación, en lo que se refiere al estudio de respuestas inflamatorias, el equipo de Rabinovich había trabajado con modelos crónicos de inflamación no tan severos ni agudos como la sepsis. En esos casos, Gal1 cumple un papel antinflamatorio, al comportarse como un inmunosupresor frente a la inmunidad adaptativa -la respuesta inmunológica que tiene lugar una vez desencadenada la inmunidad innata-.
Sin embargo, en este trabajo se mostró que en el contexto de una inflamación tan dramática como la sepsis, Gal-1 incrementa y potencia la respuesta inflamatoria.
“Algo que me parece importante aclarar es que no estamos frente a una paradoja, porque la mayoría de las moléculas del sistema inmune actúan en su contexto, siendo inmunosupresoras cuando hay necesidad de resolver la enfermedad y amplificando el proceso inflamatorio en un contexto temprano más severo”, destaca Rabinovich.
Caracterización del proceso
“Lo que se pudo observar es que al ser invadidas por bacterias Gram negativas, las células (en este caso macrófagos), como parte de su respuesta inmunitaria, detectan la presencia de la infección a través del llamado inflamasoma no canónico. Al ocurrir este reconocimiento, se produce un corte de la proteína Gasdermina D, que a su vez genera poros en la membrana plasmática de la célula, que permiten que (antes de que ocurra la muerte celular con la concomitante inflamación) se liberen las alarminas, cuya función es, como su nombre lo indica, advertir la presencia del peligro al sistema inmunológico”, señala Rabinovich.
Lo que detecta el inflamasoma no canónico en el citoplasma de la célula, a través de las proteínas Caspasa-4 y 5 (Caspasa -11 en ratones), es la presencia de lipolisacáridos (LPS), endotoxinas de las bacterias Gram negativas, y a partir de allí se desencadena el resto del proceso. Aunque la detección de LPS, en principio, protege al huésped de Infecciones bacterianas, su excesiva activación puede comprometer la supervivencia del paciente, como ocurre en la septicemia.
“Cuando el sistema está en condiciones de dar una respuesta regulada y dosificada, esto funciona muy bien. Al morir una célula infectada, se produce una inflamación y se liberan una serie de moléculas que advierten al sistema inmune de la presencia del peligro. Así el problema se aísla y se soluciona. Pero cuando la infección es generalizada, tiene lugar una respuesta inflamatoria desregulada y desmesurada, que es la que termina poniendo en riesgo la vida de la persona o del animal, según se trate”, explica Juan Manuel Pérez Sáez, investigador del CONICET en el IBYME y uno de los autores del trabajo.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.






