Gastrectomía total y esplenectomía por carcinoma gástrico proximal

► Introducción:
El tratamiento del cáncer gástrico que compromete el estómago proximal es la gastrectomía total con una adecuada linfadenectomía regional. Cuando un tumor invade directamente el bazo o el páncreas, es necesaria la esplenectomía o la pancreatectomía para lograr una resección R0. Aún sin esa invasión directa, la esplenectomía es efectuada también apuntando a una linfadenectomía completa a nivel del hilio esplénico, porque el 10% al 20% de los cánceres proximales metastatiza en los ganglios linfáticos en esa área y la disección completa no es técnicamente posible sin la esplenectomía.
El beneficio en la sobrevida de la esplenectomía para una linfadenectomía profiláctica o terapéutica es controversial. Varios estudios retrospectivos comparando la esplenectomía con la preservación del bazo, mostraron que la esplenectomía se asoció con un aumento de la morbilidad y mortalidad postoperatorias, pero no con una mejora en la sobrevida [1-3]. No obstante, esos estudios estuvieron fuertemente sesgados a favor de la preservación del bazo dado que la esplenectomía había sido realizada en pacientes con enfermedad más avanzada y que el grupo de preservación del bazo incluyó muchos casos de gastrectomía distal para tumores distales.
Dos ensayos prospectivos controlados y randomizados (ECR) fueron efectuados para evaluar la esplenectomía en la gastrectomía total. El ensayo chileno [4] enroló a 187 pacientes en una única institución mostrando una sobrevida a 5 años ligeramente mejor con la esplenectomía que con la preservación del bazo (42% vs 36%), pero la diferencia no fue estadísticamente significativa. Ese estudio concluyó que la esplenectomía debería restringirse a tumores con metástasis macroscópica o invasión directa. El ensayo coreano [5] enroló a 207 pacientes en una única institución mostrando también una sobrevida ligeramente pero no significativamente mejor con la esplenectomía.
En ese ensayo, la randomización fue efectuada antes de la cirugía y la resección no fue curativa en cerca del 20% de los pacientes. El estudio concluyó que la linfadenectomía profiláctica con esplenectomía no estaba justificada. Estos dos ensayos deberían ser considerados no conclusivos y sin el poder estadístico necesario. Existe también otro ECR japonés de pequeña escala (79 pacientes) reportado en 1985 [6] y un meta-análisis de esos 3 ECR mostró una sobrevida a 5 años levemente superior con la esplenectomía, pero la diferencia no fue estadísticamente significativa (riesgo relativo 1,17 con intervalo de confianza de 95% [IC]: 0,97 – 1,41) [7].
En 2 ECR europeos comparando linfadenectomías D1 y D2 para cáncer gástrico [8,9], se incluyó a la esplenectomía o a la pancreatectomía en la gastrectomía total D2 y se demostró un aumento significativo de la morbilidad y de la mortalidad con esos procedimientos. Por lo tanto, en Occidente, la esplenectomía o la pancreatectomía son desalentadas en la gastrectomía total por cáncer gástrico [10].
En Japón, por el otro lado, la mortalidad operatoria en la gastrectomía total con esplenectomía ha sido reportada como baja [11]. Los pacientes con metástasis en los ganglios linfáticos del hilio esplénico son frecuentemente curados con la esplenectomía [12], y, por lo tanto, la esplenectomía ha sido considerada como una parte estándar de la gastrectomía total D2 [13]. No obstante, estudios retrospectivos en Japón fallaron también en mostrar una ventaja en la sobrevida con la esplenectomía sobre la preservación del bazo [14,15].
Para clarificar el rol de la esplenectomía para el cáncer gástrico proximal que requiriere una gastrectomía total para lograr una resección R0, los autores de este trabajo realizaron un ECR a gran escala en instituciones especializadas del Japan Clinical Oncology Group (JCOG). El estudio fue registrado en ClinicalTrial.gov como NCT00112099 y en el UMIN Clinical Trials Registry (UMIN-CTR) como C000000004.
► Pacientes y métodos
♦ Diseño del estudio y objetivos finales
Se comparó la esplenectomía y la conservación del bazo en la gastrectomía total. Cuando se planificó el ensayo en el año 2001, la esplenectomía era el procedimiento estándar en Japón para la gastrectomía total curativa, para los tumores T2-4 en pacientes físicamente aptos. En consecuencia, el ensayo estableció la preservación del bazo como la rama de prueba y fue diseñado para confirmar la no inferioridad de la preservación del bazo, en relación con la esplenectomía, en la sobrevida global (SG). El objetivo final primario fue la SG, definida como el intervalo entre la asignación al azar y la muerte por cualquier causa. Los objetivos finales secundarios fueron la sobrevida libre de recidiva (SLR), definida como el intervalo entre la asignación al azar y la primera recidiva o la muerte por cualquier causa; la morbilidad operatoria; la duración de la cirugía y la pérdida de sangre.
Los hallazgos clínico-patológicos y los estadios del tumor fueron registrados en el ensayo de acuerdo con la 13º edición de la Japanese Classification of Gastric Carcinoma [16] y la 6º edición de la Union for International Cancer Control (UICC) [17] y son presentados en el trabajo según esta última.
♦ Criterios de elegibilidad
Los pacientes con cáncer gástrico proximal T2-4 considerado curable, y aptos para la cirugía, fueron enrolados dentro del ensayo después de dar su consentimiento informado por escrito. Los pacientes con metástasis macroscópicas en los ganglios linfáticos en el hilio esplénico o a lo largo de la arteria esplénica no fueron incluidos porque los cirujanos participantes consideraron que esos tumores deberían ser tratados en bloque con la esplenectomía.
Los tumores comprometiendo a la curvatura mayor del estómago fueron excluidos también, debido a la alta posibilidad de metástasis ganglionar en el hilio esplénico. Los pacientes con tumores tipo 4 de Borrmann (linitis plástica) o aquellos con citología positiva en el lavado peritoneal fueron excluidos también por su mal pronóstico, independientemente de los métodos quirúrgicos. En consecuencia, el ensayo incluyó a pacientes con cáncer gástrico proximal resecable, con posibilidad ni baja ni alta de metástasis en el hilio esplénico.
♦ Instituciones y control de la calidad de la cirugía
Inicialmente, 29 instituciones del Grupo de Estudio del Cáncer de Estómago del JCOG participaron en este ensayo [18]. Durante el período de enrolamiento, el grupo de estudio se expandió gradualmente de acuerdo con la política de manejo del sitio del JCOG, y finalmente 36 instituciones registraron pacientes. Todas las instituciones tenían una unidad quirúrgica especializada para el cáncer gástrico, en donde la gastrectomía total D2 con o sin esplenectomía fue realizada rutinariamente. con una baja mortalidad postoperatoria (< 2%). Todos los cirujanos participantes estuvieron de acuerdo con los detalles técnicos para la cirugía y su adhesión al protocolo fue monitoreada en reuniones llevadas a cabo 3 veces por año. El protocolo del estudio fue aprobado por el JCOG Clinical Trial Review Committee y por las juntas de revisión institucional de todas las instituciones participantes. Los procedimientos fueron efectuados de acuerdo con los estándares éticos de la Declaración de Helsinki de 1975.
♦ Randomización y manejo de los datos
Después de la confirmación de los criterios pre e intraoperatorios, el cirujano telefoneaba al Data Center, en donde el paciente era asignado al azar para recibir una gastrectomía total con esplenectomía (grupo A) o sin esplenectomía (grupo B). Las asignaciones se hicieron por el método de minimización, con una técnica de la moneda cargada balanceando los grupos de acuerdo con la institución y la profundidad de la invasión tumoral (T2/T3/T4). Durante el período en estudio, el protocolo fue enmendado, como se describirá posteriormente, para adoptar la nueva evidencia producida por otros ECR y la presencia o ausencia de invasión esofágica fue añadida como un factor de balanceo.
El Centro de Datos del JCOG realizó el manejo de datos, monitoreo central y análisis estadístico. El Centro brindó reportes de seguimiento semestral que fueron enviados a y revisados por el JCOG Data and Safety Monitoring Committee (DSMC). Ninguno de los cirujanos participantes estuvo involucrado en el análisis de los datos.
♦ Cirugía
Inmediatamente después de la laparotomía, se efectuó una citología por lavado peritoneal. Mientras se esperaba el resultado, el cirujano inspeccionó y palpó el estómago y los órganos adyacentes para confirmar los criterios de elegibilidad. El cirujano luego comenzó con la parte inicial de la operación en el estómago distal. Después de obtener un resultado citológico negativo el cirujano contactaba con el JCOG Data Center para el enrolamiento. El resultado de la randomización fue reportado inmediatamente al cirujano, quien luego completó la operación de acuerdo con los procedimientos asignados, de la siguiente manera:
Grupo A: gastrectomía total con esplenectomía. Se movilizó el cuerpo y cola del páncreas del retroperitoneo y se disecaron los ganglios linfáticos alrededor de la arteria esplénica (No. 11p, mitad proximal; 11d mitad distal; Fig. 1). El bazo fue removido en bloque con los ganglios hiliares (No. 10). La arteria esplénica fue ligada y cortada a unos 5-6 cm de su raíz, distal al origen de la gran arteria pancreática, pero se la preservó más larga cuando había temor de una isquemia pancreática subsecuente.
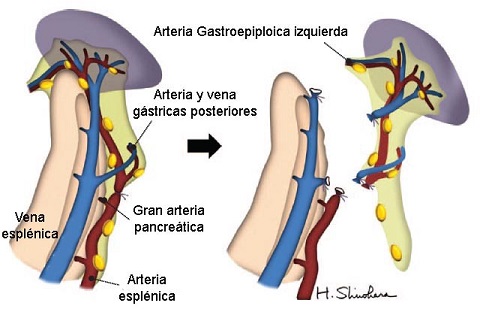
FIGURA 1: Movilización del páncreas distal y el bazo, seguida por la esplenectomía
Grupo B: gastrectomía total sin esplenectomía. El páncreas y el bazo no fueron movilizados. La arteria gastroepiploica izquierda fue ligada y cortada en su origen, el ligamento gastroesplénico fue cortado cerca del hilio esplénico y el bazo fue preservado. Los ganglios linfáticos No. 11p y 11d fueron disecados sin movilización pancreática. Los ganglios No. 10 fueron generalmente dejados intactos, pero fueron disecados si se los consideró fácilmente removibles en pacientes delgados.
En ambos grupos, se realizó la linfadenectomía D2 excepto para la disección de los ganglios No. 10 en el grupo B. La linfadenectomía para-aórtica no fue permitida. Los métodos de reconstrucción y la colecistectomía adicional fueron a discreción del cirujano. La bursectomía no fue obligatoria, pero la extensión de la remoción de la envoltura pancreática fue registrada. Los cuidados perioperatorios, incluyendo el manejo de la anestesia y la selección de los dispositivos quirúrgicos, no fueron especificados en el protocolo. Los ganglios linfáticos disecados fueron recuperados del espécimen quirúrgico fresco y fueron clasificados de acuerdo con los números de estación definidos por la JCGC [16]. Las estaciones y el número de los ganglios linfáticos recogidos fueron registrados en formularios de reporte de casos y fueron monitoreados.
♦ Seguimiento
Los pacientes fueron seguidos de acuerdo con un esquema fijo. Los análisis de sangre, incluyendo marcadores tumorales (CEA y CA19-9) y la tomografía computada (TC) o la ecografía abdominal fueron realizados cada 6 meses. Se monitoreó la presencia o ausencia de episodios infecciosos durante cada intervalo del seguimiento (fiebre > 38ºC o neumonía). Siguiendo con la práctica estándar en Japón para esa época, no se realizó vacunación profiláctica para neumococos.
♦ Enmiendas al protocolo
En el protocolo original, no se empleaba quimioterapia adyuvante, de acuerdo con las guías de tratamiento en ese momento [19]. Sin embargo, cuando 319 pacientes (64% del plan original) fueron enrolados en este ensayo, un ECR japonés (ensayo “ACTS-GC” [20]) mostró beneficios en la sobrevida con la terapia adyuvante sobre la cirugía solamente, y se esperó un cambio en el tratamiento estándar en Japón. Los autores de este estudio decidieron suspender el agregado de pacientes y esperar hasta el primer análisis interino que había sido programado para 3 meses después.
Dado que la JCOG DSMS recomendó continuar con el ensayo luego de análisis interino, se enmendó el protocolo para brindar terapia adyuvante S-1 a los pacientes con estadio patológico II/III por 1 año, y se reabrió el registro de pacientes después de una suspensión de 11 meses. También se enmendó el protocolo para incluir a los tumores que invadían el esófago, si la invasión era de 3 cm o menor. Eso se debió a que el ECR precedente de los mismos autores (JCOG9502) había demostrado que esos tumores no debían ser tratados por toracotomía sino mediante un abordaje abdominal [21], que era el estándar en este ensayo sobre la esplenectomía.
♦ Tamaño de la muestra y análisis estadístico
La sobrevida a 5 años esperada en el grupo con esplenectomía estándar era del 70% y la del grupo con preservación del bazo, del 73%. Se planificó enrolar a 500 pacientes (250 en cada grupo) para observar 196 muertes en total, con un alfa de un lado de 0,05, un poder estadístico del 70% y un margen de no inferioridad de la tasa de riesgo (TR) de 1,21, correspondiendo a un 5% en términos de sobrevida a 5 años, con un período de 5 años de acumulación de pacientes, continuado por un período de 5 años de seguimiento alejado.
Debido a la enmienda del protocolo descrita, se recalculó el tamaño de la muestra basado en los efectos estimados de la quimioterapia adyuvante y la inclusión de los tumores con invasión esofágica. La sobrevida a 5 años esperable del grupo estándar después de recalcular fue del 70%, la misma que en el protocolo original y, por lo tanto, se dejó el mismo tamaño para la muestra. El período de acumulación después de las enmiendas se fijó en 2 años.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.