Caso clínico + imagen + revisión temática

Revisión de la literatura
MIASTENIA GRAVIS
Generalidades
La Miastenia Gravis (MG) es un trastorno autoinmune frecuente, caracterizado por debilidad fluctuante y fatiga de los músculos esqueléticos ocasionado, principalmente, por una disminución en el número de receptores de acetilcolina en las uniones neuromusculares. La prevalencia es de 20 casos por cada 100.000 habitantes, aunque la incidencia varía dependiendo del lugar del reporte. Se asocia con enfermedades autoinmunes, como artritis reumatoide, lupus eritematoso sistémico y anemia perniciosa. En un 10% de los casos puede coexistir con tiroiditis autoinmune. Los síntomas pueden comenzar durante cualquier etapa de la vida; sin embargo, hay un pico entre la segunda y tercera décadas de vida en las mujeres, mientras que entre los hombres este incremento se constata entre la quinta y sexta décadas.
Etiopatogenia
La enfermedad se encuentra mediada por autoanticuerpos que operan a nivel de la unión neuromuscular. Los anticuerpos son de tipo IgG contra el receptor de acetil-colina (ACRA) de la membrana post-sináptica. Aunque en la mayoría de los pacientes pueden detectarse en suero, cerca de un 15-20% esto no sucede, dando lugar a la denominación de MG seronegativa. En este subgrupo de pacientes, puede constatarse hasta en un 40% la presencia de anticuerpos frente a una tirosin-cinasa muscular espefcífica (MusK) u otras proteínas de la unión neuromuscular.
Aproximadamente, un 75% de los pacientes presentan compromiso del timo, 65% en forma de hiperplasia y un 10% en forma de timoma. En estos últimos, las manifestaciones clínicas tienden a ser más severas que en los pacientes sin timoma pudiendo presentarse con anticuerpos contra las fibras esqueléticas.
Manifestaciones clínicas
El inicio de la enfermedad suele ser insidiosa. Puede desencadenarse por un estrés emocional, procesos infecciosos o exposición a ciertas drogas (por ejemplo, miorrelajantes o aminoglucósidos). También puede comenzar o exacerbarse durante el embarazo o puerperio.
La debilidad y la fatiga muscular agravadas por el ejercicio físico son los síntomas predominantes. La tendencia a intensificarse conforme atardece es otro signo típico. También puede precipitarse tras una vacunación, la menstruación y exposición a temperaturas extremas.
La especial vulnerabilidad de algunos músculos es característica. A menudo los primeros en afectarse son los párpados y músculos extraoculares, siendo la manifestación inicial en el 50 % de los pacientes. La ptosis palpebral y la diplopía terminan presentándose en un 90% de los pacientes miasténicos. Los músculos de la expresión facial, faríngeos y laríngeos, que alteran la masticación, la deglución y el habla se afectan en un 80%.
Conforme avanza la enfermedad puede extenderse a los músculos axiales y a los de las extremidades. Los músculos proximales son mucho más vulnerables que los distales. Con el tiempo toda la musculatura se debilita (diafragma, músculos intercostales y abdominales, etc.). Los músculos liso y cardíaco no se ven afectados. Los reflejos osteotendinosos y otras funciones nerviosas se encuentran preservados.
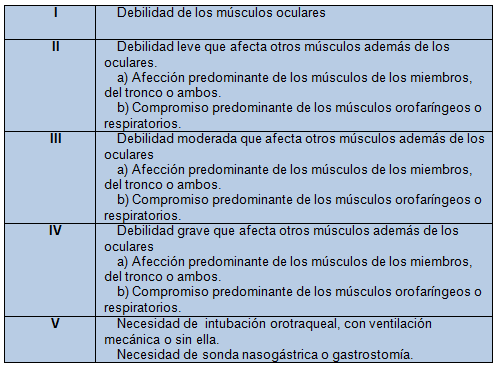
El compromiso de los músculos de la deglución o de la respiración, que provocan necesidad de soporte nutricional y asistencia respiratoria, respectivamente, se define como crisis miasténica. En la Tabla 1 se expone la clasificación de la MG según criterios clínicos.
Tabla 1. Clasificación de la MG basada en criterios clínicos, según la Myasthenia Gravis Fountation.
Diagnóstico
Se basa en los antecedentes de debilidad fluctuante y hallazgos que lo corroboran durante la exploración física y su confirmación por medio de pruebas farmacológicas (prueba del edrofonio), el test del cubito del hielo, electrofisiológicas y/o dosaje de anticuerpos. Sistemáticamente, deberá complementarse con métodos por imágenes para descartar patología tímica.
Test del cubito
Una prueba simple y segura que ha caído en el olvido en la literatura neurológica y que es de utilidad en la diferenciación de la MG con otras condiciones.
Consiste en la aplicación de hielo cubierto (para evitar quemaduras) directamente sobre el músculo elevador del ojo con ptosis durante 2-5 minutos. Si la ptosis es bilateral colocarlo sobre el más afectado. Los resultados se consideran positivos cuando se constata una mejoría de la diplopía o un aumento de 2 mm de la hendidura palpebral tras la retirada del hielo.
La sensibilidad del test en la MG ocular con ptosis, asociada o no a síntomas generalizados, varía entre el 80 al 100%. La especificidad es cercana al 98%, ya que los pacientes con ptosis palpebral no miasténicos no mejoran tras la prueba.
Diversos autores defienden la teoría de que el simple enfriamiento de los tejidos es responsable de la mejoría de la ptosis ya que inhibiría la actividad de la acetilcolinesterasa. Movaghar y Slavin compararon en pacientes con MG ocular con ptosis, la respuesta del parpadeo después de la aplicación de compresas calientes versus hielo. Concluyeron que tanto el calor como el frío fueron capaces de causar una mejoría de la ptosis. Luego sometieron a los pacientes a una prueba del sueño modificada. Se les pidió a que cierren los ojos durante 15 minutos y luego se mantengan en reposo. Como todos los pacientes mostraron una mejoría clara, concluyeron que el descanso sería el factor determinante de la mejoría de la ptosis, y no el frío o el calor. En otro estudio, Kubis y col. hallaron que en pacientes miasténicos, la mejoría media de la ptosis con el uso de hielo, era estadísticamente significativa en comparación con el descanso. Por lo tanto, concluyeron que la elevación del párpado después de la prueba del hielo es, en parte, causada por el descanso, sin embargo, la prueba de hielo mejora significativamente la ptosis más que el descanso solo.
La prueba presenta algunos inconvenientes. En primer lugar, su uso en pacientes con MG sin ptosis no se aconseja porque se obtiene poco o nulo efecto sobre la contracción del músculo ocular y el diagnóstico en esta forma puede ser dificultoso. En segundo lugar, los pacientes que se presentan con diplopía pero sin ptosis, muestran sólo una mejoría subjetiva de los síntomas. Los estudios electrofisiológicos han evidenciado que los músculos oculares no se afectan por las bajas temperaturas que la bolsa de hielo administra.
A modo de conclusión, el test del cubito es más seguro e incluso puede sustituir a la prueba de edrofonio en pacientes con MG con ptosis, ya que su especificidad y la sensibilidad es cercana al 100%, mientras que la sensibilidad de la prueba de edrofonio es del 75 al 90 % en enfermedad generalizada, y la especificidad difícil de determinar ya que ha sido reportada positiva a distintos procesos diferentes de MG. El test del cubito es útil incluso en pacientes con niveles negativos de ACRA séricos. La principal desventaja es que sólo es aplicable cuando la ptosis está presente. Por lo tanto, no es de utilidad en pacientes con debilidad proximal de las extremidades como única manifestación de la enfermedad.
Anticuerpos Antirreceptor de Acetilcolina (ACRA)
Se encuentran en aproximadamente un 80-90% de los pacientes con MG y en un 60% en la MG ocular. Los resultados falsos negativos son, básicamente, por inmunosupresión o cuando la prueba se realiza en etapa muy temprana de la enfermedad. La especificidad de la prueba no es muy clara, pero los falsos positivos son extremadamente raros en laboratorios confiables. No se ha demostrado correlación entre los títulos de los ACRA y la severidad clínica. Incluso pueden permanecer elevados tras la remisión completa de la enfermedad.
Tratamiento
El tratamiento de la MG puede dividirse en:
1) Sintomático (inhibidores de colinesterasa).
2) Terapéutica a corto plazo (plasmaféresis, inmunoglobulina intravenosa).
3) Terapéutica a largo plazo (prednisona, azatioprina, micofenolato, ciclosporina, tacrolimus, ciclofosfamida, rituximab).
4) Tratamiento quirúrgico.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.









