Colestasis neonatal

| Introducción |
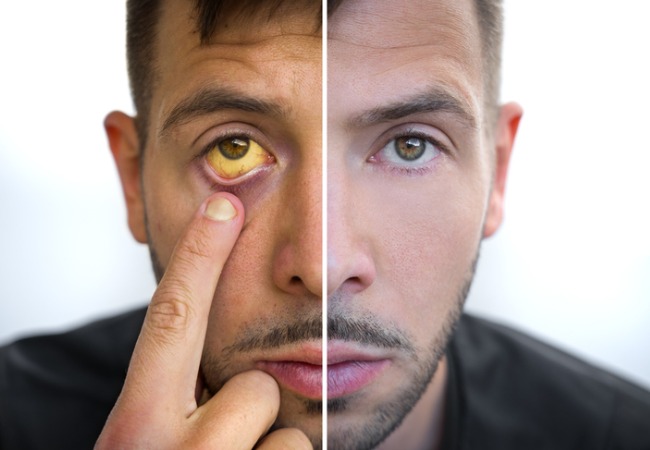
La ictericia cutánea y escleral son hallazgos clínicos comunes en las primeras 2 semanas después del nacimiento.
Aunque la ictericia puede ocurrir en hasta el 15% de los recién nacidos amamantados,(1) en la gran mayoría de los casos, es causada por aumento de la bilirrubina indirecta/no conjugada resultante de ictericia fisiológica, ictericia asociada a leche materna, hemólisis de glóbulos rojos, hipotiroidismo, síndrome de Gilbert, o muy raramente, síndrome de Crigler-Najjar. Sin embargo, la ictericia también se puede asociar con hiperbilirrubinemia conjugada y puede ser el primer signo de disfunción hepatobiliar y metabólica.
En los lactantes que continúan teniendo ictericia más allá de las 2 semanas de vida, así como en aquellos con hepatomegalia, heces pálidas o diarrea, se debe obtener la concentración de bilirrubina sérica y fraccionada en una porción directa y otra indirecta (es decir, bilirrubina conjugada y no conjugada, respectivamente).
|
La colestasis es causada por la reducción del flujo de bilis, y se define clínicamente como un nivel de bilirrubina directa superior a 1 mg/dL (17,1 mmol/L; cuando la bilirrubina total es < 5 mg/dL [85,5 mmol/L]) o más del 20% de la bilirrubina total (cuando la bilirrubina total es > 5 mg/dl [85,5 mmol/l]).(2) Estudios actuales sugieren que en los primeros 5 días después del nacimiento, debe considerarse el diagnóstico de colestasis cuando el nivel de bilirrubina conjugada es superior a 0,3 a 0,4 mg/dL (5,1–6,8 mmol/L; o por encima del límite superior normal en neonatos según el laboratorio) o más del 10% de la bilirrubina total.(3)(4)(5)(6) |
La colestasis nunca es fisiológica y siempre debe evaluarse inmediatamente para determinar la etiología específica.
Ciertas etiologías, incluyendo galactosemia, tirosinemia, quiste de colédoco, sepsis bacteriana y viral, y atresia biliar (AB), son susceptibles de intervenciones médicas o quirúrgicas que pueden prevenir la progresión a insuficiencia hepática o el desarrollo de manifestaciones extrahepáticas graves (Tabla 1). Independientemente de la etiología, los lactantes con colestasis se benefician con la optimización de la nutrición y la suplementación con vitaminas liposolubles y la prevención o tratamiento de las complicaciones de la enfermedad hepática, incluyendo colangitis, prurito, hipertensión portal y ascitis.
Desafortunadamente, a pesar de los datos que demuestran la importancia crítica de reconocer la ictericia colestásica lo antes posible, el retraso en el diagnóstico sigue siendo un problema.
El alta hospitalaria temprana de los neonatos, la falta de una consulta de niño sano estándar al mes de vida, la falsa tranquilidad por la apariencia de heces pigmentadas, los niveles fluctuantes de la bilirrubina sérica total, y el malentendido de que no toda ictericia se relaciona con la lactancia materna, todos contribuyen al diagnóstico tardío de lactantes colestásicos. (7)(8)(9)(10)
Aunque la edad promedio al momento del diagnóstico de la AB y la portoenterostomía hepática de Kasai (PEH) ha mejorado en ciertos países como Japón y Taiwán,(11) la edad media al momento de la PEH en Estados Unidos se ha mantenido en 63 días durante los últimos 15 años, muy por fuera del período de 30 a 45 días asociado con mejores resultados clínicos.(12)
Estudios recientes sugieren que la colestasis y la AB pueden ser identificables dentro de las primeras 72 horas después del nacimiento, lo que indica una oportunidad potencial para identificar a los bebés con AB mediante la obtención del nivel de bilirrubina directa en todos los neonatos antes del alta hospitalaria. (3)(4)(5)(6)(13)
| Epidemiología y etiología |
La ictericia colestásica afecta aproximadamente a 1 de cada 2500 bebés y puede resultar de varias causas, incluyendo infecciones, anomalías anatómicas del sistema biliar, endocrinopatías, trastornos genéticos, anormalidades metabólicas, exposición a toxinas y drogas, administración de nutrición parenteral (NP), disfunción cardiovascular y procesos neoplásicos (Tabla 2). (14)(15)
Las causas identificables más comunes incluyen AB (25%-40%); enfermedades genéticas y metabólicas, incluyendo deficiencia de α1-antitripsina (A1AT) (10%–20%), síndrome de Alagille (SALG; 2%–14%), fibrosis quística (FQ); colestasis intrahepática familiar progresiva (CIFP); hipopituitarismo (5%); síndrome de bilis espesa; hepatitis neonatal idiopática (HNI) o colestasis neonatal transitoria (CNT); y colestasis asociada a NP (CANP) en neonatos prematuros y en aquellos con insuficiencia intestinal.(16)
La HNI/CNT fue anteriormente la segunda causa más común de colestasis neonatal.(17) Sin embargo, el descubrimiento de muchas causas genéticas de colestasis que comparten las características clínicas y el fenotipo histológico de la HNI/CNT ha disminuido significativamente el número de bebés actualmente diagnosticados con HNI/CNT. Más recientemente, mutaciones heterocigóticas en genes asociados con el transporte de bilis (ATP8B1, ABCB11 y ABCB4) han sido descriptas en la HNI/CNT. (18)(19)(20)
La colestasis es común en los lactantes prematuros, con hasta el 20% de los bebés prematuros cumpliendo los criterios de bilirrubina directa para colestasis.
La colestasis suele ser multifactorial, como resultado de infecciones, ausencia de alimentación enteral y estimulación de la vesícula biliar, hipotensión que causa isquemia, lesión e inflamación intestinal, medicamentos, y NP. (21)
De los lactantes que reciben NP por más de 14 días, 18% a 67% desarrollará CANP. Los factores de riesgo incluyen bajo peso al nacer, trastornos que conducen a alteración de la función de barrera intestinal y del microbioma intestinal, disfunción inmunológica, NP de larga duración y NP con emulsiones lipídicas a base de soja. (21)(22)(23)(24)
Aproximadamente 20% a 30% de los bebés y niños con síndrome de intestino corto que requieren NP desarrollarán CANP o insuficiencia intestinal–enfermedad hepática asociada (IIEHA). La inflamación hepática, la colestasis y la fibrosis en la IIEHA son el resultado de la absorción de patrones moleculares asociados a microbios biológicamente activos, como endotoxinas (lipopolisacáridos) (que se absorben a través de un intestino lesionado e hiperpermeable, o por sepsis), en combinación con componentes de emulsiones lipídicas intravenosas (ILE) en la NP. (24)
| Aspectos clínicos |
Los lactantes con colestasis a menudo tienen ictericia en piel y esclerótica indistinguible de la de los bebés con hiperbilirrubinemia indirecta; sin embargo, la presencia de heces pálidas, orina de color amarillo oscuro o hepatomegalia deben sugerir colestasis.
Además, uno no debe quedarse tranquilo al mejorar la ictericia durante las primeras semanas después del nacimiento, ya que esto puede ser el resultado de una mejora de la porción de bilirrubina indirecta (por ictericia fisiológica, ictericia asociada a leche materna o un cefalohematoma en resolución), mientras que la porción directa permanece alta o incluso se eleva.
Las heces acólicas significan obstrucción biliar y siempre deben impulsar una evaluación adicional.
Hallazgos clínicos específicos podrían sugerir trastornos colestásicos individuales. El sangrado o los moretones pueden resultar de una coagulopatía inducida por vitamina K (es decir, malabsorción de vitamina K en deficiencia de A1AT o SALG) o por insuficiencia hepática (ej., en la enfermedad hepática aloinmune gestacional, tirosinemia o trastornos de la cadena respiratoria mitocondrial).
La esplenomegalia puede resultar de cirrosis con hipertensión portal asociada, enfermedades de almacenamiento, trastornos hemolíticos o linfohistiocitosis hemofagocítica congénita. Anomalías neurológicas, incluyendo irritabilidad, letargo, mala alimentación, hipotonía, o convulsiones, se pueden encontrar en lactantes con infección, hemorragia intracraneal, trastornos metabólicos (ej., síndrome de Zellweger) y mitocondriales, o hiperamonemia por insuficiencia hepática.
Los lactantes con infección congénita pueden tener bajo peso al nacer, trombocitopenia, petequias y púrpura, y coriorretinitis. Se pueden observar dismorfismos faciales en trastornos cromosómicos o en el SALG. Los soplos cardíacos, particularmente los asociados con la arteria pulmonar, son frecuentes en pacientes con SALG o AB.
Es fundamental tener en cuenta que muchos lactantes con AB parecerán “saludables” durante el primer mes de vida, y la hepatoesplenomegalia, el crecimiento deficiente e incluso las heces acólicas pueden escapar a la identificación temprana.
| Evaluación de la colestasis neonatal |
En los lactantes que siguen teniendo ictericia a las 2 semanas de vida, independientemente de si están siendo alimentados con leche materna, la bilirrubina sérica debe fraccionarse en directa (o conjugada) e indirecta (o no conjugada).
Como se señaló anteriormente, si la bilirrubina directa es superior a 1 mg/dL ([17,1 mmol/L] cuando la bilirrubina total es <5 mg/dL [85,5 mmol/L]) o es más del 20% de la bilirrubina total (cuando la bilirrubina total es >5 mg/dl [85,5 mmol/l]), el bebé tiene colestasis y requiere una evaluación adicional.
Datos recientes sugieren que en los primeros 5 días después del nacimiento, si la bilirrubina directa es mayor de 0,3 a 0,4 mg/dL ([5,1–6,8 mmol/L] o está por encima del límite superior normal para recién nacidos según el laboratorio) y/o es más del 10% de la bilirrubina total, debe sospecharse colestasis y realizar una evaluación adicional. (3)(4)(5)(6) Si un lactante con ictericia tiene hepatomegalia o esplenomegalia, heces pálidas/acólicas, o diarrea y poco aumento de peso, la bilirrubina debe fraccionarse, independientemente de la edad del niño.
Si hay colestasis, se debe realizar una evaluación adicional con un sentido de urgencia para identificar o excluir la AB y otras condiciones tratables (ej., hipotiroidismo, infección del tracto urinario, sepsis, galactosemia y tirosinemia). Se debe realizar un examen físico cuidadoso y obtener los antecedentes familiares para identificar señales de alerta que podrían apuntan a una etiología específica (Tabla 3). Los exámenes de sangre iniciales deben incluir un panel metabólico integral, un hemograma completo, y un índice internacional normalizado (INR, siglas en inglés).
Los resultados de la función hepática, incluyendo alanina aminotransferasa, aspartato aminotransferasa y fosfatasa alcalina, por lo general están elevados en lactantes colestásicos y no apuntan a una etiología específica.
La ƴ-glutamil transpeptidasa (GGT) puede estar inapropiadamente baja, normal, o elevada en lactantes colestásicos. Una GGT baja o normal (<125 U/L [2,0 µkat/L]) se observa con tipos de CIFP 1–2 y 4–6, errores innatos de la síntesis de ácidos biliares, y panhipopituitarismo, mientras que una GGT elevada (>150–200 U/L [2,5–3,3 µkat/L]) a menudo se observa en lactantes con AB, quiste de colédoco, deficiencia de A1AT, FQ, SALG, colangitis esclerosante neonatal y CIFP tipo 3.
La GGT puede estar normal o elevada en pacientes con CANP. Hipoalbuminemia, hipoglucemia e INR elevado (a pesar de la administración parenteral de vitamina K) indican alteración de la síntesis hepática.
Todos los bebés con colestasis deberían someterse inicialmente a pruebas de deficiencia de A1AT (una causa común de colestasis) con un nivel sérico de A1AT y/o prueba de electroforesis/genotipo (un nivel de <50 mg/dL [9,2 mmol/L] o un genotipo ZZ/SZ sugieren enfermedad). Se debe revisar el screening neonatal o realizar pruebas específicas para evaluar hipotiroidismo, tirosinemia o galactosemia, que son todas condiciones tratables. Si el lactante tiene fiebre, resultados anormales en el análisis de orina u otros signos clínicos de infección, se deben realizar cultivos de sangre, orina y/o líquido cefalorraquídeo.
La ecografía abdominal puede identificar la obstrucción física del árbol biliar (es decir, un cálculo biliar, un quiste de colédoco o una masa) o anomalías de la vesícula biliar asociadas con AB.(25) Si estas pruebas no revelan una etiología para la colestasis del bebé, y si se puede realizar una biopsia de hígado de manera segura, debe hacerse para evaluar AB. Si están presentes banderas rojas para enfermedades individuales (Tabla 3), entonces se deben realizar pruebas diagnósticas específicas.
En el pasado, múltiples pruebas de sangre y orina individuales se utilizaron simultáneamente para evaluar varias causas genéticas/metabólicas de colestasis después de excluir la deficiencia de A1AT y la AB; estas pruebas incluyeron:
- Tripsinógeno inmunorreactivo en el screening del recién nacido o test del sudor para evaluar FQ.
- Sustancias reductoras en orina o galactosa 1-fosfato uridil transferasa de glóbulos rojos para evaluar galactosemia.
- Succinilacetona en orina para evaluar la tirosinemia hereditaria.
- Nivel total de ácidos biliares en suero y perfil de ácidos biliares en orina para evaluar los trastornos de la síntesis de ácidos biliares.
- Prueba JAGGED para evaluar SALG.
- Aminoácidos séricos y productos orgánicos y aminoácidos en orina para evaluar deficiencia de citrina, defectos de oxidación de ácidos grasos y otras enfermedades metabólicas.
- Niveles de ácidos grasos de cadena muy larga para evaluar trastornos peroxisomales
Sin embargo, este enfoque de prueba única y resultado único fue oportuno y costoso. El paradigma para evaluar la colestasis ahora ha cambiado en muchas instituciones donde la secuenciación de nueva generación (SNG) con paneles genéticos dirigidos, la secuenciación del exoma completo (SEC) y/o la secuenciación del genoma completo (SGC) están clínicamente disponibles en una forma relativamente rápida y rentable.
Estas pruebas pueden identificar todas las mutaciones genéticas conocidas asociadas con enfermedades colestásicas y también descubrir nuevas anormalidades genéticas que resultan en colestasis.(26)(27)(28)(29)(30)
Sin embargo, no hay una rápida disponibilidad de resultados de estas pruebas genéticas en todos los centros. No obstante, cuando están disponibles, estas pruebas genéticas tienen el potencial de identificar a los bebés cuya enfermedad puede ser susceptible de intervención médica (ej., galactosemia o tirosinemia), aquellos que probablemente requerirán un trasplante de hígado(ej., enfermedad por almacenamiento de glucógeno tipo 4), o aquellos para quienes el trasplante de hígado puede ser inútil (ej., enfermedad mitocondrial).
El ritmo de evaluación depende de la edad gestacional, la edad posnatal y otras complejidades del cuidado del paciente. Por ejemplo, los bebés prematuros con múltiples factores de riesgo para colestasis, una vesícula biliar normal en la ecografía, una GGT normal, y heces pigmentadas pueden ser cuidadosamente evaluados de manera secuencial en base al volumen de sangre del bebé, la estabilidad clínica y el riesgo de más procedimientos.
Por el contrario, un bebé a término de 6 semanas con colestasis requiere evaluación urgente para excluir AB y otras condiciones tratables.
Idealmente, la cirugía de PEH para la AB debe realizarse antes de los 30 a 45 días de edad para lograr las mejores oportunidades de flujo de bilis postoperatorio y para evitar o retrasar la necesidad futura de un trasplante de hígado.(31)(32)
> Imágenes
Todos los lactantes con colestasis deben someterse a ecografía abdominal como parte de su evaluación inicial para evaluar estructura, tamaño, posición intraabdominal y composición del hígado; identificar el número de bazos (puede ocurrir asplenia o poliesplenia en el síndrome de malformación esplénica por AB); evaluar la presencia de ascitis; e identificar los hallazgos de una lesión obstructiva extrahepática (quiste de colédoco, masa, cálculos biliares, lodo obstructivo).
Aunque los hallazgos ecográficos como ausencia de vesícula biliar, signo de cordón triangular (masa fibrótica en forma de cono craneal a la bifurcación de la vena porta), vena cava inferior interrumpida, vena porta pre duodenal, situs inversus y heterotaxia, pueden sugerir AB, ninguno de estos hallazgos es diagnóstico de AB, y por el contrario, algunos lactantes con AB tienen ecografía hepatobiliar normal. (33)(34)
En el pasado, la gammagrafía hepatobiliar con un análogo del ácido iminodiacético marcado con tecnecio (HIDA) se utilizó para evaluar la permeabilidad biliar y descartar AB. Sin embargo, la especificidad de la exploración HIDA es baja (33%–80%); la falta de excreción se observa no solo en bebés con AB, sino también en aquellos con colestasis intrahepática sustancial, incluyendo lactantes con SALG e HNI, o en aquellos que reciben NP. (25)(35)(36) Además, un estudio reciente sugiere que, en ocasiones, los lactantes con AB pueden tener resultados de exploración HIDA falsamente tranquilizadores que muestran permeabilidad biliar.(37)
Los autores recomiendan reservar la gammagrafía HIDA para lactantes prematuros con colestasis en quienes la sospecha de AB es baja (es decir, un bebé con heces pigmentadas que está recibiendo NP) y en aquellos para quienes la biopsia hepática sería de alto riesgo.(35)
La colangiografía es, en última instancia, necesaria para establecer el diagnóstico de AB, y esta es comúnmente realizada como colangiografía intraoperatoria (CIO) por un cirujano con experiencia en realizar PEH durante el mismo procedimiento quirúrgico si la CIO muestra AB.
Actualmente, la colangiopancreatografía retrógrada endoscópica, la colangiopancreatografía por resonancia magnética y la colecistografía transhepática son de utilidad limitada en la evaluación de la colestasis neonatal, excepto en centros con amplia experiencia.
> Histología del hígado
La biopsia hepática percutánea sigue siendo una herramienta fundamental para evaluar la colestasis neonatal.
Varios estudios han encontrado que el diagnóstico de AB fue sugerido correctamente por la histología de la biopsia hepática en el 85% a 95% de los casos (incluyendo neonatos pretérmino y de término).(38)(39)(40) En un análisis multivariable, las características histológicas que distinguieron los casos de AB de los casos sin AB con un índice de concordancia de 0,89 (intervalo de confianza del 95% [IC]=0,84–0,93)(39) incluyeron:
- Tapones de bilis en conductos biliares portales (odds ratio [OR]=13,65; IC 95%=5,90-31,60, p <0,001)
- Edema del estroma portal (OR=10,20; IC 95%=1,92–53,96, p=0,063)
- Sin escasez de conductos biliares (OR = 4,26; IC 95 % = 1,64–1,09, p=0,0029)
- Transformación de células gigantes ausente a rara (OR=2,20; IC 95% =0,98-4,63, p=0,054)
- Hematopoyesis extramedular ausente o rara (OR=3,49; IC 95 % = 1,41–8,62)
La biopsia hepática también puede ser útil para establecer otras causas de colestasis neonatal, que incluyen:
- Deficiencia de A1AT (glóbulos intrahepatocíticos)
- SALG (escasez de conductos biliares)
- Colangitis esclerosante neonatal (lesiones ductales necroinflamatorias)
- Infección viral (citomegalovirus o virus del herpes simple)
- Enfermedades hepáticas metabólicas (esteatosis y formación seudoacinar de hepatocitos)
- CIFP y enfermedad por almacenamiento (hallazgos de microscopía electrónica)
- HNI (células gigantes multinucleares, hematopoyesis extramedular, colestasis hepatocelular)
Es importante recordar que otras causas de colestasis (incluyendo deficiencia de A1AT, SALG, CANP, CIFP tipo 3 y CF) pueden imitar la apariencia histológica de la AB, y se requiere CIO para confirmar el diagnóstico de AB. Además, varios procesos colestásicos son de naturaleza dinámica, evolucionando con el tiempo, y por lo tanto, pueden no ser diagnosticables en la primera biopsia hepática si se realiza antes de las 4 a 6 semanas de edad.
> Evaluación no invasiva de la rigidez del hígado
En la AB, la fibrosis hepática es una característica universal, y la cirrosis biliar ocurre temprano en la vida; el tiempo exacto varía de semanas a años, dependiendo del niño. Estudios previos sugieren que los métodos no invasivos más recientes para evaluar rigidez y fibrosis hepática (ej., impulso por fuerza de radiación acústica, elastografía transitoria o elastografía de onda pura) podrían usarse para acelerar la sospecha de AB y acortar el tiempo para la CIO y la PEH.(41)(42)(43)
> Nuevos biomarcadores
Estudios recientes han sugerido que los niveles séricos elevados de metaloproteinasa de matriz 7 (MMP7) del mes a los 2 meses de edad pueden discriminar confiablemente la AB de otras causas de colestasis, con valores predictivos positivos superiores al 90% y valores predictivos negativos superiores al 95%.(44)(45)(46)(47)
Se necesitan más estudios para determinar la edad más temprana a la que se puede utilizar la MMP7, para aclarar si la MMP7 es confiable en poblaciones únicas de lactantes colestásicos, incluidos los prematuros y los lactantes con cardiopatías congénitas y, por último, evaluar si los niveles de MMP7 pueden pronosticar qué lactantes con AB finalmente necesitarán un trasplante de hígado.(48)
| Trastornos seleccionados que resultan en colestasis neonatal |
> Atresia biliar
La AB ocurre en 1 en 6.000 a 18.000 nacidos vivos y es una enfermedad fibroinflamatoria de inicio en los primeros meses de vida que conduce a la obstrucción completa de parte o la totalidad del árbol biliar extrahepático, con cirrosis biliar progresiva, y eventual muerte a los 2 años de edad si no se trata. La AB es la principal causa de colestasis neonatal, la causa más común de enfermedad hepática en etapa terminal en los primeros 2 años de vida, y la indicación más frecuente de trasplante de hígado en pediatría, representando del 40% al 50% de los niños que se someten a un trasplante hepático.
A pesar de su frecuencia y graves consecuencias, la etiología de la AB sigue siendo difícil de alcanzar. Los bebés con AB por lo general se ven bien al nacer y se observa que tienen ictericia persistente con el desarrollo de heces acólicas alrededor de las 3 a 6 semanas de vida. Al momento del diagnóstico se realiza un procedimiento de PEH, durante el cual se conecta un asa de intestino en Y de Roux al hilio del hígado para establecer un nuevo camino para el drenaje biliar.
El éxito de la PEH es inversamente dependiente de la edad del lactante. Si se realiza la PEH antes de los 45 días de vida, la tasa de éxito es de hasta el 80%; sin embargo, si se realiza después de los 90 días de vida, menos del 20% de los pacientes logran el drenaje biliar. (32)(49)(50)
Si la ictericia desaparece exitosamente a los 3 meses después de la PEH (bilirrubina sérica total <2 mg/dl [34,2 mmol/l]), la tasa de sobrevida sin trasplante a 10 años oscila entre el 75% y el 90%; por el contrario, si la ictericia (bilirrubina sérica total >6 mg/dl [102,6 mmol/l]) persiste después la PEH, la tasa de sobrevida sin trasplante a 3 años es solo del 20%.
Actualmente, aproximadamente el 50% de los niños con AB requieren un trasplante de hígado antes de los 2 años de edad, y finalmente el 75% requiere un trasplante de hígado a los 20 años de edad.(51)(52)(53) De los que sobreviven hasta la tercera década de vida, casi todos tienen hipertensión portal u otras complicaciones de la cirrosis.(51)
> Deficiencia de A1AT
La deficiencia de A1AT es un trastorno autosómico recesivo que afecta aproximadamente 1 de cada 2000 a 5000 nacidos vivos en poblaciones norteamericanas y europeas. Los individuos afectados (genotipo PiZZ o PiSZ) tienen retención en hepatocitos de polímeros de la proteína Z mutante, que puede conducir a lesión hepatocitaria y cirrosis.
Los lactantes con deficiencia de A1AT pueden ser asintomáticos (40%), tener resultados anormales en las pruebas de bioquímica hepática (40%) o estar colestásicos (10%–20%).(54) De todos los niños que presentan deficiencia de A1AT durante la infancia, el 7% desarrolla cirrosis y el 17% requiere un trasplante.(55)
Tener colestasis neonatal no es predictivo de una futura enfermedad hepática grave.(56) Los individuos con deficiencia de A1AT también están en riesgo de enfisema temprano porque los niveles insuficientes de A1AT circulante no logran neutralizar la elastasa de neutrófilos en los pulmones.
Actualmente no hay un tratamiento específico para la enfermedad hepática causada por deficiencia de A1AT, aunque varios están en desarrollo. Sin embargo, solo una minoría de niños tendrá enfermedad hepática progresiva que requiere trasplante hepático.
> Síndrome de Alagille
El SALG es un trastorno autosómico dominante que ocurre en aproximadamente 1 de cada 70.000 nacidos vivos. Se identifican mutaciones en el gen JAGGED1 en más del 90% de las personas con SALG; las mutaciones en NOTCH2 se informan en el 4%.(57) El SALG tiene una variabilidad fenotípica que puede incluir:
- Colestasis neonatal y escasez de conductos biliares
- Cardiopatía congénita que afecta principalmente al lado derecho del corazón (88%)
- Facies dismórfica (cara triangular; frente ancha; ojos hundidos; mentón pequeño y puntiagudo; nariz bulbosa) (79%–88%)
- Embriotoxon ocular posterior (43%)
- Vértebras en mariposa (39%)
- Anomalías renales (22%)
- Anomalías vasculares (incluyendo lesiones intracraneales en hasta el 12% de los pacientes)
- Baja estatura (17)(57)(58)
A la edad de 20 años, el 40% de las personas desarrolla hipertensión portal clínicamente evidente, y sólo el 24% sobrevive a la adultez temprana con su hígado nativo.(57)
> Colestasis asociada a NP (CANP)
Una de las complicaciones más comunes de los lactantes que reciben NP es la CANP o enfermedad hepática asociada a NP. En un estudio de 1366 lactantes que recibieron NP durante más de 14 días, ocurrió CANP en 14%, 43%, 72% y 85% de los niños que recibieron NP de 14 a 28 días, de 29 a 56 días, de 57 a 100 días y más de 100 días, respectivamente. (59)
La incidencia de CANP se correlaciona inversamente con el peso al nacer y la edad gestacional, y se observa con mayor frecuencia en lactantes con sepsis, sobrecrecimiento bacteriano del intestino delgado, gastrosquisis, atresia intestinal, enterocolitis necrotizante, y síndrome de intestino corto. (59)(60)
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.