La resolución del caso: ¿Cuál es su diagnóstico?XXIX

Discusión:
María Virginia Fernández Zenobi
Nos encontramos frente a una mujer de 37 años de edad con infección por HIV, con serología positiva para VHC que presenta un cuadro de 72 hs de evolución caracterizado por fiebre, cefalea, vómitos y adenopatías laterocervicales bilaterales. El laboratorio evidencia leucocitosis, bicitopenia (anemia y trombocitopenia), hipoalbuminemia, falla renal y eritrocitos dismórficos en la orina. Durante la evolución presenta deterioro progresivo de la función renal que requiere terapia de reemplazo renal y se detecta en hemocultivos y LCR (PCR) Neisseria meningitidis por lo que inicia tratamiento con ceftriaxona.
Para guiar mi discusión me planteo los siguientes objetivos e interrogantes:
• ¿Se puede considerar una paciente inmunocompetente?
• ¿Tiene relación la insuficiencia renal con la infección por el HIV?
• ¿Tiene relación la insuficiencia renal con la infección por el VHC?
• ¿Tiene lupus eritematoso sistémico (LES)?
• Breves consideraciones acerca de poliadenopatías y HIV.
• Consideraciones acerca de la meningococcemia.
Inicialmente me planteo si nuestra paciente con un recuento de linfocitos T CD4+ (LTCD4+) mayor a 500 cel/ul y una carga viral (CV) indetectable puede considerarse inmunocompetente. Las variables antes mencionadas son las que habitualmente utilizamos para clasificar a los pacientes, luego de instaurar una terapia antirretroviral de alta eficacia (HAART), en respondedores o no respondedores. ¿Son estas las únicas variables que se modifican? ¿O son las que podemos medir fácilmente? La interrelación entre el virus HIV y el sistema inmune es extremadamente compleja. El virus genera un estado progresivo e irreversible de inmunosupresión, que si bien es enlentecido por la HAART disminuyendo la morbi-mortalidad sabemos que no produce la curación. Se plantea, entonces, que existe un estado de inflamación persistente asociado a una replicación viral continua (indetectable por los actuales métodos de medición) que provoca señales homeostáticas defectuosas e inefectivas. Por todo lo antedicho, creo que nuestra paciente no es una inmunocompetente.
El 30% de los pacientes con HIV presenta algún tipo de daño renal. La insuficiencia renal aguda es frecuente en aquellos que presentan morbilidades asociadas como diabetes mellitus, hipertensión arterial, nefrotóxicos o intercurrencias infecciosas graves. La insuficiencia renal crónica (definiendo esta como proteinuria o un filtrado glomerular -FG- menor a 60 ml/min) puede tener múltiples etiologías dentro de ellas las morbilidades antes mencionadas, el uso de nefrotóxicos en forma prolongada y dentro de ellos se encuentra como prototipo el tenofovir provocando daño tubular, pero con las dos variables que más se asocia la nefropatía crónica es con un recuento de LTCD4+ bajos y una CV mayor a 4000 cop/ul. La lesión histológica más frecuentemente descripta es una glomeruloesclerosis focal y lesión túbulo- intersticial aunque pueden encontrarse depósitos de IgA, glomerulonefritis membranoproliferativa, nefropatía membranosa y glomerulonefritis Lupus-like. Por la frecuencia con la que se detecta daño renal en pacientes con HIV, las guías de manejo de insuficiencia renal crónica recomiendan: realizar examen de orina, determinar si existe proteinuria y estimar FG al momento del diagnóstico de la infección por HIV, repetir este análisis anualmente si presenta factores de riesgo, si se pesquisa proteinuria se debe profundizar el estudio con imágenes y evaluar biopsia renal, mantener un control estricto de la presión arterial (el fármaco que se debería utilizar inicialmente son los IECA), siempre se debe iniciar HAART. Las indicaciones para la realización de una biopsia renal se basan en la presencia de proteinuria, un rápido deterioro de la función renal y el desarrollo de un síndrome nefrítico. El diagnóstico clínico basado en el recuento de LTCD4+, CV y proteinuria no predice la lesión histológica por lo que el diagnóstico anatomopatológico puede guiar la terapéutica a instaurar. Considero que en nuestra paciente está indicada la realización de una biopsia renal por los motivos antes mencionados.
Es bien conocida la asociación entre enfermedad renal e infección por el VHC. La glomerulonefritis membranoproliferativa es la lesión glomerular más frecuentemente encontrada aunque no la única. Ésta puede asociarse a la presencia de crioglobulinas en sangre. La clasificación de las crioglobulinemias se basa en el predominio de las inmunoglubulinas (Ig) circulantes, en el caso de la asociación con el VHC se presenta con mayor frecuencia una crioglobulinemia mixta (presencia de IgG policlonales y IgM monoclonales). Ésta entidad es una vasculitis sistémica de pequeños vasos que se presenta habitualmente con fiebre, púrpura palpable y artralgias. En los exámenes complementarios además de la presencia de crioglobulinas puede observarse un descenso notorio del complemento. En los pacientes que se evidencia la asociación de enfermedad renal con VHC siempre deben recibir tratamiento antiviral y el esquema del mismo dependerá del FG teniendo en cuenta que el uso de ribavirina no se recomienda ante la presencia de falla renal crónica estadio IV así como el interferón pegilado es desaconsejado en el estadio V. Si existe en forma conjunta la presencia de crioglobulinas debe instaurarse tratamiento inmunosupresor (siempre en forma conjunta con la terapéutica antiviral) que consta de metilprednisolona asociado a ciclofosfamida como primera elección, teniendo como otras opciones el uso de rituximab y en menor medida plasmaféresis.
Nuestra paciente presenta infección por el HIV y serología positiva para VHC. La interrelación entre estas dos entidades es por poco compleja. Los reportes en pacientes con HIV plantean que la reconstitución inmune luego del inicio del tratamiento HAART es modesta es aquellos pacientes que además se encuentran infectados por VHC. Es importante destacar también el uso de fármacos con toxicidad hepática, no solo los antirretrovirales, sino también las drogas para el tratamiento de infecciones oportunistas. En relación al VHC conocemos que el mayor factor pronóstico es la reserva hepática, en los pacientes que se encuentran co-infectados las manifestaciones clínicas y hallazgos de laboratorio (como elevación de aminotransferasas) no se correlacionan con el grado de fibrosis que se evidencia con posterioridad en la biopsia hepática. Por otro lado, la tasa de respuesta al tratamiento es menor que en los pacientes no-HIV, independientemente del genotipo de VHC.
La presencia de artralgias de un año de evolución, rash malar, el hallazgo de alopecia en el examen físico y la bicitopenia en el laboratorio me obliga a plantear un interrogante: ¿Tiene nuestra paciente un LES? Existen criterios de clasificación de esta entidad autoinmune, los inicialmente descriptos de la American College of Rheumatology (ACR) y posteriormente los desarrollados por Systemic Lupus International Collaborating Clinics Group (SLICC). De las manifestaciones clínicas que plantean estos criterios nuestra paciente presenta rash malar, artritis, fotosensibilidad, alteración renal y alteración hematológica ¿Pueden estas manifestaciones ser explicadas por las morbilidades asociadas que presenta? Las lesiones dérmicas pueden aparecer en contexto de una meningococcemia, las artritis pueden explicarse por las infecciones virales (ya sea el HIV o el VHC) o por una artritis reactiva. Como mencionamos con anterioridad, el deterioro de la función renal puede estar justificado por las infecciones virales y también por una intercurrencia grave como una meningoccocemia y, por último, la bicitopenia puede deberse a la propia infección por HIV. Presenta además un factor antinúcleo (FAN), anticuerpos anti-ADN negativos y complemento normal. Por todas estas razones me permito dudar de este diagnóstico, creo que las patologías que padece esta paciente pueden explicar su cuadro clínico.
Las poliadenopatías son hallazgos frecuentes en pacientes inmunocomprometidos. La realización de una historia clínica exhaustiva y un examen físico minucioso nos permite definir características que nos ayudan a predecir su etiología. En forma práctica, para su estudio, podemos clasificar a las adenopatías según su etiología en cambios reactivos, infecciosas y neoplásicas. En pacientes con infección por HIV pueden presentarse cualquiera de ellas e incluso coexistir. Nuestra pacientes presenta poliadenopatías, localizadas en región cervical, dolorosas, duro-elásticas y que evolucionan en forma favorable. Sugiero entonces mantener una conducta expectante y evaluar en forma diferida una biopsia si es que no resuelven de forma completa.
Por último, estamos frente a una paciente con meningococcemia. La infección por Neisseria meningitidis es entidad grave con una alta mortalidad a pesar del tratamiento correcto. La infección aguda puede clasificarse de la siguiente manera: meningitis, meningitis asociada a meningococcemia y meningococcemia sin meningitis. La presentación clínica es, habitualmente, florida y, muchas veces, catastrófica evolucionando con coagulación intravascular diseminada, miocarditis y coma. El tratamiento debe instaurarse en forma empírica ante la sospecha y el antibiótico de primera elección es la ceftriaxona. Ante un cuadro meníngeo por Neisseria los corticoides no han mostrado beneficios en estudios retrospectivos, aunque la administración inicial por sospecha de otra etiología se realiza en la práctica clínica habitual. Las manifestaciones clínicas en nuestra pacientes no fueron las clásicas de esta entidad, pero ante el aislamiento en hemocultivos y LCR sugiero continuar con tratamiento antibiótico. Existe una vacuna para este microorganismo que presenta indicaciones precisas: esplenectomizados y en pacientes HIV positivos que viajan a lugares donde se considera endemia o que habitan comunidades cerradas.
Para concluir, planteo las siguientes conductas, sugiero continuar con HAART como tratamiento para la infección por HIV. En relación al hallazgo de la serología positiva para VHC propongo la confirmación de la misma y si resulta positiva la tipificación del virus, el inicio del tratamiento antiviral. Con respecto a la infección aguda por Neisseria meningitidis sería correcto continuar con el tratamiento antibiótico, realizar profilaxis a convivientes y planteo realizar un ecocardiograma como estudio complementario para evaluar compromiso cardíaco. Como mencioné con anterioridad considero que nuestra paciente no presenta LES. El deterioro de la función renal y el requerimiento de terapia de reemplazo renal dominan el cuadro clínico y considero que, actualmente, es el principal problema a resolver. La descripción histopatológica nos aportará datos para instaurar y guiar la terapéutica. Por último, cabe destacar, que es una paciente con múltiples morbilidades asociadas por tal motivo resalto la importancia de las medidas higiénico-dietéticas, el control de la presión arterial y la vacunación para el virus de la hepatitis B.
Anatomía patológica de la biopsia renal (imágenes e informe):
Martín Mondino, Susana Márquez, Ana Lía Nocito
Parénquima renal representativo de la porción cortical que incluye en los diferentes niveles realizados hasta quince glomérulos, de los cuales dos se hallan transformados en obleas fibrosas totales. Los restantes son parcialmente permeables con leve incremento de la matriz mesangial y células homónimas, variable de un glomérulo a otro, y en cuatro se acompaña de proliferación segmentaria de células epiteliales, leucocitos polimorfonucleares, cariorrexis, necrosis fibrinoide y adherencias flóculo – capsular (Imágenes 7 y 8). En otros dos glomérulos se reconoce esclerosis glomerular segmentaria con adherencia flóculo – capsular e hipertrofia de células epiteliales (Imagen 9).
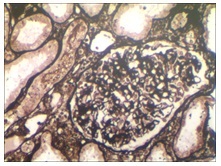
Con la coloración de metenamina de plata las membranas basales glomerulares son delgadas, excepto en las áreas de esclerosis (Imagen 10).
A nivel intersticial se destaca focalmente un denso infiltrado inflamatorio mixto con compromiso tubular y cilindros celulares con detritus. Se destaca también la presencia de numerosos cilindros hemáticos (Imagen 11).
Hay varios focos de atrofia tubular y cilindros proteicos.
Los vasos arteriales y arteriolares muestran leve engrosamiento parietal hialino PAS (+).
Imágenes 7 y 8:
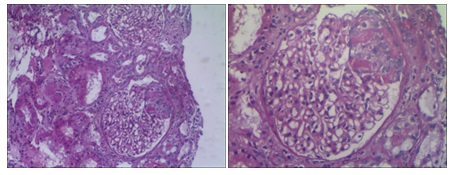
Imágenes 7 y 8: un glomérulo con lesión necrotizante segmentaria, con hiperplasia de células epiteliales. Un glomérulo más preservado (Tinción PAS).
Imagen 9:
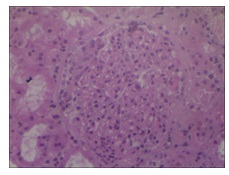
Imagen 9: Glomérulo con proliferación mesangial, endotelial y células epiteliales entre hora 9 y 12. (H&E).
Imagen 10:
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.






