Esófago de Barrett

 Se estima que en Estados Unidos el 5,6% de los adultos sufre esófago de Barrett (EB), una afección en la que la mucosa escamosa del esófago es sustituida por epitelio columnar metaplásico, el cual predispone al cáncer del esófago que ha sido dañado a causa de la enfermedad por reflujo gastroesofágico (ERGE). La ERGE y el EB son los principales factores de riesgo de adenocarcinoma de esófago, un tumor mortal cuya frecuencia en los Estados Unidos ha aumentado más de 7 veces durante las últimos 4 décadas. La mucosa columnar metaplásica del EB no ocasiona síntomas, y la enfermedad tiene importancia clínica solo porque confiere predisposición al cáncer.
Se estima que en Estados Unidos el 5,6% de los adultos sufre esófago de Barrett (EB), una afección en la que la mucosa escamosa del esófago es sustituida por epitelio columnar metaplásico, el cual predispone al cáncer del esófago que ha sido dañado a causa de la enfermedad por reflujo gastroesofágico (ERGE). La ERGE y el EB son los principales factores de riesgo de adenocarcinoma de esófago, un tumor mortal cuya frecuencia en los Estados Unidos ha aumentado más de 7 veces durante las últimos 4 décadas. La mucosa columnar metaplásica del EB no ocasiona síntomas, y la enfermedad tiene importancia clínica solo porque confiere predisposición al cáncer.
Patogénesis
La metaplasia, el proceso en el que un tipo de célula adulta sustituye a otro, es una consecuencia de una lesión tisular crónica. En los pacientes con lesión esofágica crónica por ERGE, la metaplasia de Barrett se desarrolla cuando las células columnares secretoras de moco reemplazan a las células escamosas dañadas por el reflujo. Se desconocen cuáles son las células que dan lugar a esta metaplasia.
Se ha propuesto que la ERGE puede inducir alteraciones en la expresión de factores de transcripción claves en el desarrollo, dando lugar a células escamosas esofágicas maduras que se conviertan en células columnares (transdiferenciación) o dan lugar a células progenitoras esofágicas inmaduras que se someten a la diferenciación columnar en vez de a la diferenciación escamosa (transcompromiso).
En un modelo de rata con esofagitis por reflujo, la metaplasia se desarrolló a partir de células madre de la médula ósea que entran en la sangre y se depositan en las células esofágicas dañadas por el reflujo. Estudios en modelos de ratón han sugerido que la metaplasia podría derivar de la migración ascendente de células madre del estómago proximal (cardias gástrico) o de la expansión proximal de las células de tipo embrionario de la unión gastroesofágica. No está claro cuál de estos procesos contribuye a la patogénesis del EB en los seres humanos.
Diagnóstico
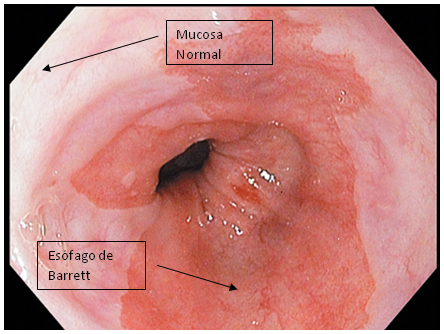
El diagnóstico de EB requiere la visualización endsocópica de mucosa columnar extendida más allá de la unión gastroesofágica y que recubre el esófago distal, además de los resultados de la biopsia esofágica que confirman la presencia de metaplasia columnar. En la endoscopia, la unión gastroesofágica se identifica como la parte más proximal de los pliegues gástricos, mientras que la mucosa columnar se caracteriza por ser gruesa y de color salmón, en contraste con la palidez y brillantez de la mucosa escamosa del esófago.
La medida de la metaplasia columnar del esófago determina el diagnóstico de EB de segmento corto o largo (≥3 cm o <3 cm de metaplasia columnar, respectivamente). Sin embargo, los especialistas no están de acuerdo sobre el tipo histológico de mucosa columnar que establece el diagnóstico de EB.
Para hacer el diagnóstico definitivo de EB, las sociedades gastroenterológicas estadounidenses requieren la presencia de metaplasia intestinal con células caliciformes en las muestras de biopsias esofágicas (también llamada metaplasia intestinal especializada o epitelio columnar especializado).
Esta metaplasia intestinal es un factor de riesgo bien establecido de carcinoma. Sin embargo, para el diagnóstico de EB, otras sociedades como la British Society of Gastroenterology también requieren la presencia de mucosa gástrica en las biopsias esofágicas (comprendiendo células columnares secretoras de moco sin células caliciformes).
La mucosa del cardias, aunque clásicamente considerada el revestimiento normal del cardias gástrico, puede tener características histoquímicas intestinales y anormalidades del contenido de ADN, mientras que en algunos casos, no en todos, parece ser una metaplasia inducida por la ERGE. Sin embargo, no está claro si la mucosa del cardias representa un factor de riesgo importante de adenocarcinoma.
Por lo tanto, el principal desacuerdo en cuanto a los criterios histológicos para el diagnóstico de EB es si el cuadro debe definirse como una curiosidad histológica (metaplasia mucosa, independientemente de su importancia clínica) o como una enfermedad médica (metaplasia de la mucosa que predispone al cáncer). Las sociedades gastroenterología de EE. UU. han tomado este última posición.
Epidemiología
En cada paciente, la extensión de la metaplasia de Barrett varía con la gravedad de la ERGE subyacente. Los pacientes con EB de segmento largo no tratado tienen ERGE grave con esofagitis erosiva mientras que el EB de segmento corto no se asocia con síntomas de ERGE o signos endoscópicos de esofagitis por reflujo.
Se supone que el EB de segmento corto se desarrolla como consecuencia del reflujo ácido prolongado que afecta solamente la porción distal del esófago, un fenómeno que puede ser documentado en personas aparentemente sanas. El EB de segmento corto no era muy reconocido hasta 1994 y en general, los primeros estudios incluían exclusivamente a pacientes con EB de segmento largo.
Estudios más recientes han incorporado una fracción variable de pacientes con EB de segmento corto y largo, y su proporción puede influir notablemente en la frecuencia de los síntomas asociados de ERGE y de las complicaciones. En general, la afección se descubre durante la endoscopia realizada en pacientes de raza blanca, ≥50 años.
A menudo, esta endoscopia está indicada intencionalmente por la presencia de síntomas de ERGGE pero también la afección se detecta en forma incidental cuando la endoscopia se realiza por otra causa no relacionada con la ERGE. El EB es 2-3 veces más común en los hombres que en las mujeres; es infrecuente en personas de raza negra o asiáticas, y es raro en los niños. Entre los factores de riesgo importantes se hallan la obesidad (con distribución predominantemente intrabdominal y, el tabaquismo, existiendo una forma familiar de EB (7-10% de los casos).
La mayoría de las condiciones asociadas a la metaplasia del EB también se asocia a factores de riesgo de adenocarcinoma esofágico. Por el contrario, los factores que podrían brindar protección contra el EB son el uso de antiinflamatorios no esteroides, la infección gástrica con Helicobacter pylori y el consumo de una dieta con elevado contenido de frutas y vegetales.
Aun no se conoce cuál es el factor de riesgo responsable del notable aumento de la incidencia de adenocarcinoma de esófago en los países occidentales durante los últimos 40 años, un período en el que la frecuencia de la ERGE y el EB parecen haber aumentado solo un poco. Ha habido un marcado aumento de la obesidad central, lo cual podría contribuir a la carcinogénesis de Barrett a través de la predisposición a la ERGE y del aumento de la producción de hormonas promotoras de la proliferación celular, como la esliptina, y los factores de crecimiento símil insulina.
La infección por H. pylori, que puede proteger al esófago de la ERGE mediante la producción de gastritis con reducción de la producción de acido gástrico, ha disminuido la frecuencia en el mismo período, durante el cual el adenocarcinoma esofágico ha aumentado en todos los países del mundo. Otra hipótesis que relaciona el aumento de la incidencia del adenocarcinoma esofágico es la mayor ingesta de nitratos, los cuales están más difundidos por el uso de fertilizantes nitrogenados.
La incidencia anual de adenocarcinoma de esófago en los pacientes con EB no displásico ha variado de 0,1% a 2,9%, con un pico máximo en estudios que tienen sesgos de publicación. Un estudio reciente de mejor calidad mostró que el riesgo de adenocarcinoma de esófago en la población general es de pacientes con EB no displásico de solo 0,1% a 0,3% por año.
Sin embargo, existen varios factores que influyen en el riesgo individual de cáncer. Por ejemplo, el riesgo de cáncer en los pacientes con EB es casi el doble en las mujeres y es mayor cuando el segmento de metaplasia de Barrett es más largo; es especialmente elevado en las personas con ciertas formas familiares de EB. Por otra parte, el riesgo parece disminuir cuando en el seguimiento endoscópico no aparecen signos de progresión hacia la displasia.
Detección y vigilancia del esófago de Barrett
Durante décadas, la principal estrategia para la prevención de muertes por adenocarcinoma de esófago ha sido el cribado de los pacientes con síntomas de ERGE por EB, mediante la detección endoscópica del progreso hacia la neoplasia curable. Lamentablemente, no hay ninguna prueba de que esta estrategia sea eficaz, y con una incidencia anual de cáncer de solo 0,1 a 0,3% la logística para realizar un ensayo aleatorizado para demostrar si la detección y vigilancia previenen las muertes por cáncer de esófago es desalentadora.
Estudios de observación demostraron que los pacientes con cánceres asociados al EB que fueron diagnosticados endoscópicamente durante el período de vigilancia tienen tumores en etapas más tempranas y mayor supervivencia que aquellos cuyos tumores se descubrieron por síntomas como la disfagia y la pérdida de peso.
Sin embargo, tales estudios son altamente susceptibles de sufrir sesgos que podrían exagerar los beneficios de la vigilancia. Algunos modelos de estudios computarizados han llegado a la conclusión que el cribado y la vigilancia pueden ser rentables en determinadas circunstancias, pero tales estudios no son definitivos.
A pesar de la falta de evidencia de alta calidad para apoyar la práctica, actualmente las sociedades médicas recomiendan el cribado endoscópico del EB en los pacientes con síntomas de ERGE crónica que tienen al menos un factor de riesgo adicional para el adenocarcinoma de esófago, como la edad ≥50 años, el sexo masculino, la raza blanca, la hernia del hiato, un índice de masa corporal elevado, distribución intraabdominal de la grasa corporal o. tabaquismo.
Si el examen preliminar no identifica al EB, no se recomienda continuar con el cribado endoscópico. Para los pacientes en los que se identifica EB no displásico, ya sea por selección o por casualidad, las sociedades médicas recomiendan la vigilancia endoscópica e a intervalos de 3 a 5 años. No obstante, existen razones para cuestionar el valor del cribado y la vigilancia del EB.
El requisito previo para hacer el cribado de la existencia de síntomas de ERGE limita la utilidad de la práctica porque los pacientes con EB de segmento corto no suelen tener síntomas de ERGE, mientras que aproximadamente el 40% de los pacientes con adenocarcinoma de esófago no tiene antecedentes de ERGE.
Los estudios han mostrado que menos del 10% de los pacientes con adenocarcinoma de esófago han recibió previamente el diagnóstico de EB, lo que indica que esas prácticas de cribado recurrente son altamente ineficaces. Por otra parte, un estudio de casos y controles reciente ha puesto en duda la eficacia de de la vigilancia en la prevención del cáncer en los pacientes con EB.
Ese estudio comparó la frecuencia de la vigilancia endoscópica durante un período de 3 años en 38 casos (pacientes con diagnóstico de EB que fallecieron por adenocarcinoma esofágico) con la utilizada en 101 pacientes vivos, pacientes control con EB, comparables por edad, sexo y duración del seguimiento. Los pacientes de ambos grupos fueron vigilados endoscópicamente con una frecuencia similar (55% y 60%, respectivamente).
La vigilancia no se asoció con menor riesgo de muerte por adenocarcinoma de esófago (riesgo relativo ajustado 0,99; 0,36 a 2,75). Sin embargo, este intervalo de confianza relativamente amplio no excluye la posibilidad de que la vigilancia sea beneficiosa. Una razón importante para el cribado ha sido poder identificar a los pacientes con EB que luego pueden beneficiarse de la vigilancia.
Si, como lo indica el informe antes mencionado, la vigilancia tiene un beneficio limitado, entonces la práctica del cribado podría basarse en una premisa básicamente defectuosa. Lo cierto es que se necesitan mejores métodos para estratificar el riesgo e identificar a aquellos pacientes con EB que podrían beneficiarse de la vigilancia o de las intervenciones.
Con este propósito se han investigado nuevas técnicas de cribado por imágenes endoscópicas, como la cromoendoscopia con tinción, la cromoendoscopia óptica y digital, la autofluorescencia endoscópica y la endomicroscopia con laser confocal. En las muestras de biopsia de pacientes con metaplasia de Barrett, las anormalidades en la presión del p53 y del contenido de ADN celular en la citometría de flujo han sido asociadas la progresión neoplásica.
Las anormalidades citogenéticas detectadas por medio de la hibridación in situ por fluorescencia y los paneles de biomarcadores que identifican a múltiples anormalidades en el contenido de ADN, la expresión genética y la metilación del ADN prometen ser buenos predictores del riesgo de cáncer, como algunos modelos de estratificación de riesgo que incorporan una variedad de cuadros clínicos, histológicos y moleculares. Sin embargo, esos métodos no han sido validados suficientemente como para justificar su aplicación en la práctica clínica.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.