Espondiloartritis
|
Resumen Clásicamente, los pacientes con espondiloartritis (EspA) se clasifican en cinco subgrupos: espondilitis anquilosante (EA), artritis soriásica (AS), artritis asociada con enfermedad intestinal inflamatoria (EII), artritis reactiva y EspA indiferenciada. Si bien no se sabe a ciencia cierta, se considera que la patogenia es multifactorial, debida a la interacción entre factores de riesgo genéticos y desencadenantes ambientales, que producen la activación de la autoinflamación y la autoinmunidad. Este grupo de enfermedades se caracteriza por la inflamación crónica de las entesis y otras estructuras anatómicas, que causa sacroileitis, entesitis y artritis periférica. Otra característica distintiva de la EspA es la asociación con manifestaciones extrarticulares, como soriasis, uveítis y EEI. Los criterios de la Assessment of Spondyloarthritis International Society (ASAS) clasifican la EspA en dos grupos: EspA axial,(que incluye la EA clásica y la EspA axial no radiográfica) y la EspA periférica. El tratamiento de la EspA progresó mucho. La introducción del tratamiento biológico mejoró el pronóstico funcional y clínico de los pacientes. |
El término espondiloartritis (EspA) comprende un grupo heterogéneo de enfermedades con ciertas características en común que las diferencian de otras enfermedades reumáticas: los antecedentes familiares, la patogenia, la asociación con HLA-B27, la relación con infecciones gastrointestinales o genitourinarias y un cuadro clínico similar caracterizado principalmente por entesitis, sacroileitis y artritis.1
El grupo comprende la espondilitis anquilosante (EA), la artritis soriásica (AS), la artritis asociada con la enfermedad intestinal inflamatoria (EII), la artritis reactiva y la EspA indiferenciada.1 Sin embargo, en la fase inicial de la enfermedad puede ser difícil clasificar a los pacientes. Los criterios de la Assessment of Spondyloarthritis International Society (ASAS) permiten clasificar a los pacientes con EspA según los síntomas predominantes en: EspA axial (Figura 1) y EspA periférica (Figura 2).2-4

Figura 1. Evaluación de los criterios de clasificación de la Spondyloarthritis International Society para la espondiloartritis axial. Para emplear en pacientes con lumbalgia ≥3 meses y edad de inicio <45 años. 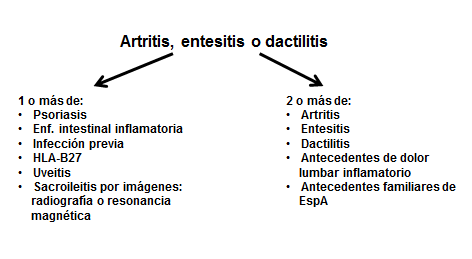
Figura 2. Evaluación de los criterios de clasificación de la Spondyloarthritis International Society para la espondiloartritis periférica.
≈ EPIDEMIOLOGÍA
La prevalencia de EspA depende de los antecedentes genéticos, especialmente la frecuencia de HLA-B27, la etnia y la distribución geográfica de la población en estudio. Por lo tanto la prevalencia varía y se estima que es del 0,1–2,5%.
≈ PATOGENIA
La patogenia es el resultado dela compleja interacción entre los factores de riesgo genéticos y los desencadenantes ambientales que activan la autoinmunidad y la autoinflamación.
► Factores de riesgo genéticos
La herencia es poligénica y se relaciona con varios factores genéticos. La posibilidad de heredar la EA es >90%.6 Los familiares de primero, segundo y tercer grado de pacientes con EA tienen un riesgo relativo del 94%, 25% y 4%, respectivamente, de sufrir la enfermedad.7
La importancia de la microbiota intestinal anormal y de las infecciones en la aparición de la enfermedad articular se confirmó en varios estudios
Los principales factores genéticos asociados con la EspA son:
Genes CMH
El HLA-B27 es al factor genético más importante en la EA. Está presente en el 85–95% de los pacientes blancos con EA, aunque sólo el 7–8% de los portadores de HLA-B27 en la población general sufren EA.8 El HLA-B27 también se asocia en menor grado con otras formas de EspA 7,9. El HLA-B27 está codificado por un alelo clase I de la región HLA-B del complejo mayor de histocompatibilidad. Varias hipótesis diferentes explican la función del HLA-B27 en la patogenia de la EspA.
► Hipótesis de los péptidos artritogénicos
Ciertos péptidos microbianos muy similares a los autopéptidos podrían imitarlos y causar reactividad de los linfocitos T, produciendo autorreactividad y enfermedad autoinmune. 10-12 La validez de esta hipótesis se cuestiona, ya que ratones con HLA-B27 pueden sufrir artrosis en ausencia de células T CD8+.13
► Hipótesis de los homodímeros de cadena pesada
Las cadenas pesadas de HLA-B27 pueden formar dímeros estables que afectan a los receptores de varios tipos de células de manera diferente a la estructura convencional de modo que pueden ser reconocidas por los receptores de los linfocitos citolíticos naturales, creando un proceso inflamatorio. Los receptores leucocitarios que podrían reconocer a los homodímeros son: LILRA1, LILRB2, KIR3DL1 y KIR3DL2.14
► Hipótesis del plegado erróneo de HLA-B27
Debido a varios motivos, el proceso de plegado de HLA-B27 es más lento que otros alelos de HLA y podría generar proteínas de plegado erróneo que se acumulan en el retículo endoplásmico, provocando activación de la autofagia y la vía IL23/17.14
Se caracterizaron más de 100 subtipos de HLA-B27, si bien no todos tienen el mismo grado de asociación con la EspA/EA. B27:02, 04 y 05 tienen fuerte asociación con la EA. Otros alelos de HLA-B, como HLA-B60, B39, B38, y B40 se asociaron con la EA.14
► Genes no CMH
Estudios de asociación del genoma completo involucraron a varios genes en la patogenia de la EspA agrupados en varias clases funcionales.
Polimorfismos en la aminopeptidasa 1 y 2 del retículo endoplásmico (ERAP1 y ERAP2 por las siglas del inglés) tienen una fuerte asociación con la EspA. Aún no se sabe el mecanismo por el que ERAP1 predispone a la EspA, ni tampoco el mecanismo por el que ERAP2 afecta el riesgo de sufrir la enfermedad.
► Vía de IL17/23
Estudios de asociación del genoma completo identificaron la asociación con genes para el receptor de IL23 (IL23R), así como la tirosina cinasa 2 (TYK2) y el transductor de señales y activador de la transcripción (STAT3), que participan en la vía de IL23R. Nuevas opciones terapéuticas contra estos blancos fueron eficaces.16
Otros genes no-CMH implicados son la familia del gen receptor del factor de necrosis tumoral (TNF por las siglas del inglés) y los genes que modulan la activación y la diferenciación de los linfocitos CD4+ o CD8+.
► Desencadenantes ambientales
La importancia de la microbiota intestinal anormal y de las infecciones en la aparición de la enfermedad articular se confirmó en varios estudios. De los pacientes con EII el 10–20% sufre sacroileitis y muchos pacientes con EA tienen lesiones inflamatorias microscópicas en la biopsia sin padecer síntomas. En otros casos, como la artritis reactiva y el síndrome de Reiter, la artritis aparece poco después de una infección gastrointestinal o genitourinaria.16
La importancia del estrés mecánico en la inflamación y la formación de hueso se analizó ampliamente en la literatura sobre la patogenia de la EspA. El “complejo sinovio-entésico” representa la integración sofisticada entre las inserciones y la sinovial adyacente. Los fibrocartílagos en las inserciones son proclives al microdaño o a la reparación tisular aberrante que se puede manifestar como tenosinovitis o sinovitis adyacente, debido a que la sinovial es rica en células inmunitarias y a su capacidad para experimentar hiperplasia y crecimiento intravascular.
Debido a esto la entesis es un lugar preferencial donde las moléculas de las bacterias se pueden depositar. El microdaño y la deposición bacteriana en el contexto de HLA-B27 podrían llevar a los cambios inflamatorios característicos de la EA. La secuencia de inflamación entésica seguida de formación de nuevo hueso no está demostrada formalmente, aunque estudios de resonancia magnética (RM) sugieren que la formación de nuevo hueso se produce preferencialmente en las lesiones inflamatorias avanzadas de la columna, caracterizadas por procesos reparativos, como la esclerosis ósea.18
Las lesiones agudas se resuelven sin secuelas, pero en las lesiones inflamatorias crónicas, la resolución del proceso produce metaplasia grasa y formación de hueso, por lo tanto el estrés mecánico participa en la progresión de la enfermedad.19
Modelos en animales mostraron la etiología multifactorial de la EspA con modelos de estrés genómico (HLA-B27), microbiano y biomecánico dando forma a los fenotipos de la enfermedad.
≈ CUADRO CLÍNICO
En los pacientes con EspA axial la lumbalgia es característica. Los pacientes con EspA axial o periférica pueden sufrir artritis, entesitis y dactilitis.
► Lumbalgia
La lumbalgia crónica afecta aproximadamente al 20% de la población general, pero una proporción reducida de estos pacientes sufre EspA axial. 21 Por lo tanto, la lumbalgia de la EspA axial se describe como ‘lumbalgia inflamatoria’. Se la halla en el 70–80% de los pacientes con EspA axial y se caracteriza por: edad de inicio <45 años, inicio insidioso, evolución >3 meses, mejora con el movimiento y con los antiinflamatorios no esteroides (AINE), pero no con el reposo22.
Se asocia con rigidez matinal y dolor nocturno. La etapa inicial de la enfermedad es intensa y el dolor se puede irradiar a la columna dorsal o la pelvis. La sacroileitis se puede manifestar como dolor alternante en ambas zonas glúteas y es muy específico para la EspA axial y la EA. También puede estar afectada la columna cervical y, con menor frecuencia la columna torácica, especialmente en la EA, con pérdida de la amplitud de movimientos.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.