Manejo de la Púrpura de Schonlein Henoch

La Púrpura de Schonlein Henoch es la vasculitis más frecuente en niños, con una incidencia de más de 13,5 por 100000 niños en edad escolar. Involucra a los vasos pequeños y se caracteriza por el hallazgo de depósitos de inmunoglobulina A (IgA) en la biopsia tisular. Todavía hay muchas características que se desconocen sobre la PSH, pero se postula que los niños con una susceptibilidad innata para desarrollar PSH al entrar en contacto con un desencadenante externo dispararían el proceso de la enfermedad. La naturaleza exacta del desencadenante es desconocida y fueron implicados muchos agentes infecciosos. Es probable que no haya un mediador específico.
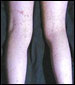
El principal hallazgo clínico es un rash purpúrico que involucra predominantemente los miembros inferiores y las nalgas. Los síntomas abdominales y articulares se ven frecuentemente en la fase aguda de la PSH con evidencia de compromiso renal, que se manifiesta por la presencia de hematuria y/o proteinuria.
Fisiopatología
La investigación de pacientes que desarrollaron PSH reveló un número de anormalidades que jugarían un rol en el proceso de la enfermedad. La naturaleza de las anormalidades que determinan la susceptibilidad para desarrollar PSH son pobremente comprendidas, pero está surgiendo evidencia de una relación con otros trastornos autoinflamatorios asociados con una desregulación en la homeostasis de la interleuquina-1 (IL-1). Los 11 miembros de la familia de genes de la IL-1, incluyen los genes que codifican la interleuquina-1 pro inflamatoria [beta] (IL-1B) y su regulador, el antagonista antiinflamatorio del receptor de IL-1. La IL-1B es una citoquina pro-inflamatoria altamente activa que causa no solo fiebre, anorexia y otros síntomas constitucionales sino también daño tisular y remodelamiento.
Un estudio de Gershoni-Baruch y colaboradores de Israel demostró que el 10% de los pacientes con PSH eran homocigotas para mutaciones del gen MEFV (el gen defectuoso en la fiebre mediterránea familiar), y un 17% adicional tenía defectos heterocigotas. MEFV codifica la proteína que regula la activación de la caspasa-1 y en consecuencia la producción de IL-1B. Se encontró que los niños turcos con fiebre mediterránea familiar (FMF) aumentan 72 veces el riesgo de presentar PSH comparado con los controles. En conjunto, las tasas de PSH en la FMF varían del 2 al 7% y la PSH severa parecería ser más frecuente en la FMF, con reportes de vasculitis cerebral y nefritis grave. La PSH persistente y recurrente en niños con hiperglobulinemia (Ig) D demuestra que otros defectos en el control inflamatorio también podrían modular la PSH.
Los haplotipos de HLA podrían jugar un rol en la susceptibilidad a la PSH. Un estudio de 110 chicos turcos con diagnóstico de PSH muestra un incremento del riesgo de desarrollar PSH en los que presentan HLA A2, A11 y antígenos B35 y una reducción del riesgo en aquellos con HLA A1, B49 y B50.
Un candidato obvio del rol patogénico en la PSH es la IgA, y de las dos subclases, solo la IgA1 está involucrada en la PSH. Se encontró una glicosilación anormal de los glicanos ligados al O en la región bisagra de la molécula en adultos con nefropatía por IgA y en niños con PSH y las concentraciones de IgA1 son dos o tres veces mayores que lo normal. Se sugiere que este cambio hace que los complejos inmunes que contienen este anticuerpo sean resistentes a su eliminación de la sangre, lo que les permite instalarse en los tejidos e iniciar la inflamación.
Diagnóstico
No hay una prueba específica para la PSH y por lo tanto el diagnóstico es clínico. El exantema es la característica diagnóstica principal y los diagnósticos diferenciales más importantes incluyen la sepsis meningocóccica y la trombocitopenia idiopática. En 2005 el Grupo de Vasculitis de la Sociedad Europea de Reumatología Pediátrica (SERP) propuso nuevos criterios de clasificación de la vasculitis pediátrica, reemplazando los criterios de clasificación del Colegio Americano de Reumatología (CAR) de 1990. Sin embargo, estas modificaciones propuestas fueron en su mayoría basadas en la revisión de la literatura y en un proceso consensuado y no fueron formalmente validadas.
Actualmente se realizó un proceso de validación estadística y se definieron criterios modificados para el diagnóstico de PSH. Los valores de sensibilidad y especificidad se obtuvieron al comparar 827 chicos con diagnóstico de PSH por su pediatra tratante o por el panel de consenso con otros 150 pacientes con otras formas de vasculitis infantil (poliarteritis nodosa 150, granulomatosis de Wegener 60, arteritis de Takayasu 87). Esto implica un adelanto significativo de los criterios CAR 1990, que permitía diagnosticar PSH solo en base a una púrpura palpable en menores de 20 años. Sin embargo, Aalberse y colaboradores plantearon la preocupación de continuar sobrediagnosticando PSH, en particular confundiéndose con la vasculitis idiopática cutánea de pequeños vasos (VICPV). Ellos estudiaron los criterios diagnósticos de PSH usados por los pediatras holandeses en 2004, para evaluar su precisión utilizando la presencia de IgA en la piel cuando estaban disponibles las biopsias.
Desafortunadamente, solo se llevaron a cabo 17 biopsias cutáneas en los 232 pacientes reportados con PSH, pero de ellos solo nueve (53%) tenían depósitos de IgA. Ellos creyeron que el diagnóstico clínico de PSH no era siempre confiable y que la exclusión de la PSH permitiría un seguimiento menos activo, basándose en que la VICPV tiene manifestaciones cutáneas muy similares a la PSH y artralgia, dolor abdominal y compromiso renal, pero no se ha reportado que cause problemas renales a largo plazo. Sin embargo, el autor no está seguro de que realizar una biopsia cutánea para excluir PSH cambiaría el patrón de seguimiento de un niño con hematuria y proteinuria persistente, más allá del diagnóstico.
Se llevaron a cabo investigaciones intentando excluir otros diagnósticos y para identificar la presencia de compromiso renal. El recuento sanguíneo completo permite la detección de trombocitopenia. El compromiso renal es común pero generalmente limitado a hematuria y/o proteinuria moderada. La nefritis más grave produce mayores niveles de proteinuria, pero es infrecuente que los niveles séricos de creatinina estén aumentados al inicio.
Manejo agudo
La PSH es una enfermedad multisistémica como se demuestra en los reportes de casos que describieron compromiso de todos los órganos. Sin embargo, la mayoría de los niños con PSH tienen un curso relativamente benigno y no requieren internación. El tratamiento es sintomático, consistiendo en analgesia simple para el dolor articular o abdominal. Se pueden usar antiinflamatorios no esteroides para artralgias más severas. En el pasado se recomendaba reposo en cama, pero no es necesario y los pacientes pueden estar tan activos como quieran.
El dolor abdominal puede ser un problema significativo y la invaginación es parte de los diagnósticos diferenciales. Un curso corto de corticoides (3 días de prednisolona 2mg/kg) puede ayudar, aunque la evidencia es débil para respaldar este tratamiento.
Nefritis de la PSH
Las manifestaciones renales de la PSH son las responsables de la morbilidad a largo plazo. La inflamación de los riñones (nefritis) se evidencia por el hallazgo de hematuria y/o proteinuria. Un pequeño número de pacientes desarrollan una nefritis severa al momento de la presentación de la enfermedad, pero esto no es frecuente y la progresión generalmente es más insidiosa. Aproximadamente el 2% de los pacientes desarrollan problemas renales a largo plazo y por esta razón, los pacientes con hematuria o proteinuria deben permanecer controlados en el tiempo.
Comprensiblemente se enfocó en estrategias para reducir la incidencia de compromiso renal y en primer lugar se realizó mediante la administración de corticoides. Los resultados de tres estudios aleatorizados controlados con placebo del uso de prednisolona al comienzo de la PSH, examinando la incidencia de problemas renales a los 6 meses o al año fueron revisados por el grupo Renal de Cochrane y la conclusión fue que los 3 estudios juntos no demostraron un beneficio significativo del tratamiento a corto plazo con prednisona en la prevención de la enfermedad renal.
La historia no es más clara en cuanto al tratamiento de los pacientes que desarrollan un compromiso renal más severo. Hay datos limitados que guían el tratamiento de la nefritis activa por PSH y la decisión de empezar un tratamiento potencialmente tóxico es complicada por el hecho de que algunos pacientes con nefritis significativa mejorarán espontáneamente. Si se considera el tratamiento hay un rango de opciones que se reportaron como exitosas en series no controladas incluyendo esteroides, ciclofosfamida, plasmaféresis, ciclosporina, azatioprina e inmunoglobulina pero solo hay información limitada de estudios que incluyan grupos control.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.