Aneurismas de la arteria esplénica
Introducción
Los aneurismas de la arteria esplénica representan una condición infrecuente pero potencialmente letal. La prevalencia ha sido reportada tan elevada como de un 10% en algunos estudios basados en autopsias [1]. Los aneurismas de la arteria esplénica son responsables por hasta el 60% de todos los aneurismas de arterias esplácnicas y es el tercer aneurisma abdominal más común, después de los de la aorta y de las arterias ilíacas [2]. Se lo define como una dilatación anormal de la arteria esplénica de más de 1 cm de diámetro. El aneurisma de la arteria esplénica (AAE) fue descrito por primera vez en cadáveres en 1770 por Beaussier [3]. El primer diagnóstico preoperatorio fue hecho cerca de 150 años después por Hoegler en 1920 [4]. La incidencia del AAE varía desde el 0,1 al 10,4% en la población general [1,5,6]. Es cuatro veces más común en mujeres que en hombres [7-9]. Aunque la patogenia no está completamente entendida, los factores de riesgo incluyen: trauma, eventos hormonales y hemodinámicos locales en el embarazo, hipertensión portal (incluyendo síndrome de Caroli), degeneración arterial (fibrodisplasia medial) y aterosclerosis [10,11]. Los pacientes que presentan hipertensión portal están particularmente en riesgo, con una incidencia del 7,1-13,0% [12,13]. El desarrollo de un nuevo AAE después del transplante de hígado es un evento raro. No obstante, se ha reportado que ocurre tan tardíamente como 16 años después del transplante [14,14].
Los aneurismas falsos o pseudoaneurismas de la arteria esplénica son menos prevalentes que los verdaderos. Difieren de los AAE verdaderos en que la dilatación ocurre siguiendo a la disrupción de una o más capas de la pared del vaso. La arteria esplénica es responsable por la mayoría de los pseudoaneurismas esplácnicos. A diferencia del AAE verdadero, estos tienen una leve predominancia en los hombres. Las causas subyacentes, en la mayoría de los casos, son: trauma, infección o debilidad de la pared de la arteria esplénica por exposición a enzimas pancreáticas, Esto último se asocia usualmente con filtraciones de anastomosis pancreáticas, pancreatitis grave y pseudoquistes pancreáticos [16]. La importancia del diagnóstico y tratamiento de AAE radica en su riesgo de rotura, que aumenta significativamente más allá de un diámetro de 2 cm. La mortalidad después de la rotura varía desde el 25% al 70%, dependiendo de la patología subyacente.
Aunque la intervención quirúrgica ha sido desde hace mucho el pilar de la terapia, los avances recientes en técnicas de imágenes y procedimientos mínimamente invasivos, ha revolucionado el diagnóstico y el manejo del AAE. En este trabajo los autores revisan los avances recientes y los conceptos actuales en el manejo del AAE.
Anatomía y patología
La circulación esplácnica incluye las arterias celíacas, mesentérica superior e inferior, que se originan de la aorta abdominal. La más proximal es la arteria o tronco celíaco, que tiene tres ramas, las arterias gástrica izquierda, esplénica y hepática común. La arteria esplénica se origina en el tronco celíaco, distal al origen de la arteria gástrica izquierda y sufre una bifurcación primaria en el hilio del bazo. Transcurre estrechamente aplicada al borde superior del páncreas. Es el flujo de entrada vascular primario del bazo y del páncreas. Además, irriga la curvatura mayor del estómago a través de los vasos cortos gástricos y la arteria gastroepiploica izquierda [17]. La mayoría de los aneurismas se desarrollan en el tronco principal de la arteria esplénica. Los aneurismas distales a la bifurcación primaria son infrecuentes y ocasionalmente involucran ramas pequeñas en el hilio. Los AAE verdaderos ocurren mayormente en el tercio distal de la arteria (75%), seguido por el tercio medio (20%). Generalmente son solitarios y de naturaleza sacular [10,18]. El tamaño promedio del AAE en el momento de la detección es de aproximadamente 2,1 cm y raramente excede los 3 cm [19]. Los aneurismas micóticos se ubican más comúnmente en la bifurcación de la arteria [20]. Los aneurismas esplácnicos concomitantes son hallados en el 3% de los pacientes y los aneurismas no esplácnicos han sido documentados en hasta el 14% de los casos, la mayoría de ellos ocurren en la arteria renal [21].
Los aneurismas verdaderos están contenidos por las tres capas de la pared arterial. La degeneración arterial en la forma de fibrodisplasia de la media es vista comúnmente junto con grados variables de inflamación local, aterosclerosis [10,22], degeneración quística de la media y degeneración mixoide [10,23,24]. Los elementos infecciosos con micro abscesos pueden verse en los aneurismas micóticos [25]. Por otro lado, el AAE falso carece de una o más de las capas de la pared del vaso (íntima, media y adventicia), haciéndolo más débil y más susceptible a la rotura.
Historia natural y síntomas clínicos
La historia natural de los aneurismas de la arteria esplénica es similar a la de otros aneurismas intraabdominales [26] con un aumento progresivo del tamaño llevando finalmente a la rotura. Sin embargo, la mayoría (80%) son asintomáticos y descubiertos incidentalmente [27]. Los AAE sintomáticos (20%) pueden presentarse con dolor abdominal en el epigastrio o en el hipocondrio izquierdo. Otros síntomas generales pueden incluir anorexia, náusea o vómitos que son atribuidos frecuentemente a una hernia hiatal coexistente o a otras patologías, como litiasis vesicular y enfermedad ulcerosa péptica. Aún entre aquellos que se presentan con esos síntomas inespecíficos, el diagnóstico final es casi siempre un descubrimiento fortuito en un estudio por imágenes abdominal [23,28]. Raramente se detecta una masa pulsátil o no en el examen clínico.
Un modo de presentación más dramático es la rotura espontánea de aneurisma, que ocurre en el 2-10% de los pacientes como forma inicial de presentación [10]. Aunque históricamente cerca del 10% de los pacientes se presentan con una rotura aguda [19,29], la amplia disponibilidad de sistemas de imágenes modernos, ha reducido esto a aproximadamente el 3%, basado en estudios recientes. Los factores de riesgo para la rotura de los aneurismas incluyen embarazo, desarrollo de síntomas, expansión de los aneurismas, un diámetro mayor de 2 cm, hipertensión portal, derivación portocava y transplante hepático [10,30,31]. Los aneurismas falsos tienen un riesgo significativamente más alto de rotura que los verdaderos. Una rotura se presenta con un dolor abdominal agudo de comienzo abrupto en el epigastrio o más frecuentemente en el hipocondrio izquierdo, dolor en la punta del hombro izquierdo (signo de Kehr) e inestabilidad hemodinámica [32-35]. Ocasionalmente pueden presentarse con el fenómeno de la doble rotura dentro de las 48 horas. En ese escenario, la primera hemorragia ocurre en la retrocavidad, con un taponaje transitorio. Esto es seguido por un desborde a través del foramen de Winslow en la cavidad peritoneal, resultando en un shock severo. El fenómeno de la doble rotura fue descrito por primera vez por Bockerman en 1930 [5,6,10,23,30,36,37]. Además del sangrado intraperitoneal, la erosión secundaria del aneurisma en una víscera adyacente, puede llevar a la hemorragia gastrointestinal. Esto ha sido descrito en hasta el 13% de los pacientes con rotura del aneurisma en el estómago, colon o conducto de Wirsung en el páncreas. La erosión en la vena esplénica puede resultar en una fístula arteriovenosa e hipertensión portal [4-6,37,38].
Raramente, el alto flujo a través de la fístula arteriovenosa esplénica conduce a un síndrome de robo de la mesentérica e isquemia del intestino delgado [39]. El pseudoaneurisma puede también romperse dentro del duodeno o del conducto pancreático, resultando en anemia, melena o hematemesis. Los pseudoaneurismas que se desarrollan ante la presencia de una fístula pancreática originada por una pancreatitis grave o una cirugía, se presentan frecuentemente con un pequeño sangrado centinela que precede a la hemorragia mayor. En las situaciones postoperatorias, un tercio de esos pacientes podrían sufrir una hemorragia intraluminal, mientras que la mayoría sangrará intraabdominalmente, lo que puede ser detectado si hay drenajes colocados.
La rotura espontánea es la complicación más grave del AAE, con una tasa global de mortalidad del 25%. Es particularmente elevada cuando ocurre en el embarazo, en donde se ha hallado tasas tan altas como del 75% [40]. La mayoría de las roturas de los AAE (95%) ocurre en el embarazo [27]. La tasa de mortalidad en caso de rotura espontánea de pseudoaneurismas es cercana al 100% [41]. El tratamiento debería iniciarse tan pronto como sea posible, independientemente de su tamaño y aún en ausencia de sangrado [42-44].
Investigaciones
El diagnóstico incidental cada vez mayor de AAE está relacionado primariamente con el envejecimiento de la población y el uso liberal de la ecografía y de las imágenes de corte transversal [6,10,29,45]. Ocasionalmente, un AAE calcificado puede ser observado en una radiografía directa de abdomen. No obstante, la ecografía, tomografía computada (TC), resonancia magnética nuclear (RMN), angiografía por resonancia magnética (ARM) y ecografía endoscópica, son todas modalidades que harán más probablemente el diagnóstico inicial de un aneurisma asintomático [32,46]. La ecografía tiene la ventaja de no ser invasiva, ser costo efectiva y libre de radiaciones, con particular aplicación en el embarazo. Sin embargo, es operador dependiente y su sensibilidad es significativamente degradada por la presencia de obesidad, distensión gaseosa y aneurismas pequeños [47,48]. La TC, RMN y ARM tienen la ventaja de brindar imágenes transversales tridimensionales. Cada una de ellas tiene su propio conjunto de desventajas. La exposición a radiación limita el uso de la TC en el embarazo y el impacto de los campos magnéticos en los pacientes con marcapasos cardíacos y otras inserciones metálicas impide el uso de la RMN. Ambas están limitadas en presencia de embarazo [46,48]. Una vez que se ha establecido la sospecha inicial o se ha realizado el diagnóstico, la angiografía por sustracción digital (ASD) con su alta resolución espacial sigue siendo el pilar para definir la ubicación precisa del aneurisma, investigar las ramas colaterales, localizar el origen del sangrado y documentar o excluir otros aneurismas viscerales [2,9,10,29,30,37,49]. La ASD tiene la desventaja de ser invasiva debido a la punción arterial y se ha asociado con complicaciones. Por el otro lado, la TC con multidetección (TCMD) no requiere una punción arterial. Además, la prestación tridimensional podría mejorar la evaluación del AAE [15,49,50].
Los AAE que son considerados como adecuados para el manejo conservador requieren estudios por imágenes regulares para investigar la progresión. El modo de evaluación podría depender de la visibilidad y accesibilidad del aneurisma a las diferentes técnicas por imágenes disponibles. El paciente que no cae en los criterios arriba mencionados, debería ser seguido con TC o ecografía cada 6-12 meses. La ecografía es una buena modalidad para el seguimiento, pero la TC es generalmente preferida, debido a los datos detallados de sección transversal que brinda. En la actualidad no existe un consenso sobre la duración del período de seguimiento en esos pacientes [51]. Se debería prestar especial atención en el seguimiento de los pacientes con transplante ortotópico de hígado (TOH), porque se ha reportado el desarrollo de AAE hasta 16 años después de ser transplantados. Esos pacientes deberían ser seguidos durante toda la vida [15].
Manejo
Las indicaciones para la intervención están relacionadas con la historia natural de la enfermedad, con énfasis sobre los factores que aumentan el riesgo de rotura espontánea. La calcificación, edad avanzada y normotensión no impiden la rotura del aneurisma [52]. Todos los AAE sintomáticos deberían ser tratados como una cuestión de urgencia. Trastek y col., sugieren que todos los aneurismas asintomáticos detectados incidentalmente durante o antes de una gestación planeada, deberían ser tratados antes de llegar a término. Además, todos los aneurismas asintomáticos con un diámetro mayor a 2 cm y aquellos que aumentan su tamaño durante la vigilancia sin tomar en cuenta el diámetro, deberían ser también tratados. Se acepta generalmente que cualquier AAE detectado en pacientes sometidos a transplante hepático también deberían tratarse [23].
Hay disponible un rango de opciones terapéuticas para el tratamiento de los AAE. El tratamiento depende usualmente del modo de presentación, localización y tamaño del aneurisma. La cirugía convencional fue el pilar de la terapia hasta la última década. Recientemente, han evolucionado otras técnicas menos invasivas. Éstas incluyen la cirugía laparoscópica, embolización endovascular y exclusión con stent del aneurisma. Se evita la esplenectomía concomitante para preservar la función inmunológica, a menos que el aneurisma esté localizado profundamente en el hilio esplénico [52]. No obstante, algunas evidencias sugieren que la ligadura o embolización de la arteria esplénica también altera la función del bazo, a pesar de la preservación del órgano [36]. Los abordajes quirúrgicos abiertos pueden incluir la esplenectomía con remoción del aneurisma, ligadura proximal y distal de la arteria esplénica con o sin resección del aneurisma y ligadura arterial trans-aneurismática [7]. La esplenectomía parcial puede ser realizada en el caso de aneurismas distales, preservando el parénquima esplénico no afectado. La tasa de mortalidad asociada con la cirugía abierta es del 1,3% con una tasa de morbilidad del 9% [16,41]. En presencia de una rotura aguda, la hemorragia puede ser rápidamente controlada mediante división del ligamento gastroepiploico y abordaje de la arteria esplénica a través de la retrocavidad o, si es necesario, clampeando la aorta por encima del tronco celíaco, antes del procedimiento definitivo [30]. Los AAE pueden ser abordados por vía anterior o lateral. El abordaje anterior tiende a alterar los vasos cortos gástricos y gastroepiploicos izquierdos y puede aumentar el riesgo de infarto esplénico. El abordaje retroperitoneal lateral preserva la perfusión colateral del bazo [24].
La resección laparoscópica de un AAE ha sido adoptada por muchos autores como una alternativa menos invasiva a la cirugía abierta, a expensas de un desafío técnico mayor [7,8,53]. Fue descrita por primera vez por Saw y col., en 1993 [54]. Arca y col. [7] y Reardon y col. [55], realizaron series pequeñas de cuatro y seis pacientes, respectivamente. Concluyeron que el abordaje laparoscópico fue seguro y factible, pero que requiere una considerable experiencia y ecografía intraoperatoria. En el grupo de Reardon, un paciente fue convertido a cirugía abierta debido a trauma iatrogénico de la vena esplénica. El abordaje laparoscópico generalmente está contraindicado en pacientes con inestabilidad hemodinámica u otros signos de rotura [7]. Al igual que el abordaje abierto, el laparoscópico puede ser anterior o lateral. Un abordaje lateral puede ser adecuado para los aneurismas centrales y distales [27]. Una vez que el aneurisma es visto, las ramas aferente y eferente son ligadas con una engrampadora Endo-GIA y luego es resecado. Otro método de reparación laparoscópica es la técnica de exclusión en donde se alinea una engrampadora endoscópica en forma paralela al eje mayor de la arteria esplénica. Esta técnica fue descrita por Csepel y col., y Matsumoto y col., realizando ambos el procedimiento en un solo paciente, sin complicaciones [9,17]. Esta técnica permanece controversial porque deja un segmento de arteria enferma in situ, exponiéndolo a la presión arterial pulsátil y a la posibilidad de recurrencia [55].
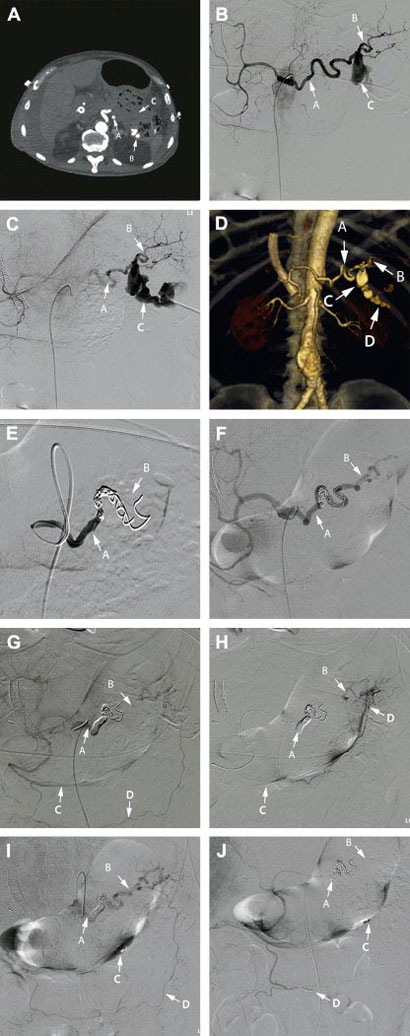
La embolización transcatéter fue descrita por primera vez por Probst y col., en 1978 [56]. Desde entonces, han existido al menos tres grandes series de casos recomendando el abordaje endovascular para el tratamiento del AAE (Guilon y col., tuvieron 12 casos [16], McDermott y col., tuvieron 14 casos [8] y Mandel y col., tuvieron 19 casos [57]). Los avances en la ASD y el desarrollo de una amplia variedad de catéteres arteriales y equipamiento asociado, han aumentado su aplicación exitosa a cerca del 85-100% de los casos. Es considerada por muchos en la actualidad como la primera línea de tratamiento en la mayoría de los pacientes con AAE, particularmente en los aneurismas asintomáticos incidentales [8,58]. La técnica de embolización es muy importante, dado que la arteria esplénica debe ser ocluida en el punto de origen del aneurisma [59]. El resultado depende de la evolución cuidadosa de la lesión, la arteria esplénica y el desagüe esplénico. Una TC previa al procedimiento es esencial para su planificación [16]. Los agentes usados para la embolización incluyen gelatina (Gelfoam), coils de acero, balones desmontables y trombina [55,60,61]. El N-butil cianoacrilato o histoacril ha sido también usado para lograr la embolización. Tiene la ventaja de penetrar y ocluir los nidos de la malformación arteriovenosa, si está presente [62-64]. La embolización puede ser efectuada para todos los AAE, excepto aquellos localizados en el hilio del bazo [59]. Esta técnica es preferida a la cirugía, especialmente cuando el aneurisma es difícil de manejar quirúrgicamente y en pacientes con alto riesgo. Las complicaciones de esta técnica incluyen migración del coil e infarto distal, formación de absceso y raramente rotura del aneurisma [59]. La recanalización puede ocurrir en hasta el 12,5% de los pacientes después de una embolización exitosa [45]. Esto puede tratarse, ya sea repitiendo la embolización o con cirugía [65]. La embolización también puede fracasar debido a razones técnicas si la arteria esplénica era particularmente tortuosa, lo que refuerza la necesidad de una planificación adecuada preoperatoria [66]. Algunos autores han reportado un conglomerado de síntomas en pacientes sometidos a embolización, lo que ha sido denominado como síndrome post-embolización [16]. Esto incluye fiebre, dolor abdominal, íleo y en ocasiones pancreatitis, y afecta hasta el 39% de los pacientes tratados mediante embolización. Ver las Figs. 1 y 2 para una mejor comprensión del proceso de embolización del AAE.
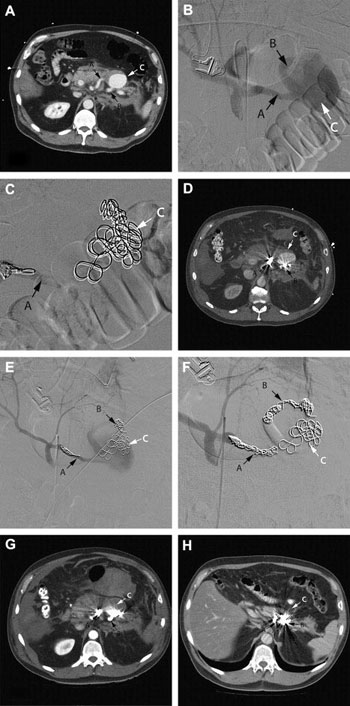
· FIGURA 1: Secuencia de imágenes de un hombre de 70 años que se presentó con dolor en el cuadrante superior izquierdo. (A) TC de abdomen mostrando la presencia de un aneurisma de la arteria esplénica de 4 cm (C) en comunicación directa con la arteria esplénica proximal (A) y distal (B). Se le realizó un angiograma del eje celíaco (B) y se ocluyó el aneurisma y el flujo de entrada con coils (C). Una nueva TC demostró la oclusión incompleta del aneurisma (D) a pesar de observarse los coils en las partes proximal (A) y distal (B) de la arteria esplénica. Un nuevo angiograma confirmó la permeabilidad del flujo de entrada (E), que fue nuevamente embolizado usando coils, hasta lograr una oclusión completa (F). Una TC realizada al día siguiente mostró la ausencia de llenado del saco aneurismático con el material de contraste (G) y tres meses después el aneurisma era invisible (H).
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.