Manejo del Síndrome Antifosfolipídico

Generalidades
Los anticuerpos antifosfolipídicos (AAF) son un grupo heterogéneo de autoanticuerpos que se unen a fosfolípidos (p.ej. cardiolipina) o a proteínas plasmáticas que tienen afinidad por superficies fosfolipídicas (p.ej. beta-2-glucoproteína I, protrombina, anexina). Los fosfolípidos están involucrados en la cascada de la coagulación sanguínea. La aparición de manifestaciones clínicas, fundamentalmente trombosis vasculares y abortos recurrentes, relacionadas directamente con la presencia de AAF define el síndrome antifosfolipídico (SAF) o síndrome de Hughes (en honor al reumatólogo inglés que lo describió en 1983).
En la mitad de los casos, el paciente con SAF no tiene evidencia de ninguna otra enfermedad autoinmune (SAF primario –SAFP-), mientras que en la otra mitad el SAF ocurre en asociación con otros trastornos autoinmunes, principalmente lupus eritematoso sistémico (LES) –el 30-50% de sujetos con LES tienen AAF- pero también artritis reumatoide, esclerodermia o enfermedad de Behçet (SAF secundario). Tanto en un caso como en otro, el autoantígeno contra el que van dirigidos los AAF suele ser la beta-2-glucoproteína I y no los fosfolípidos per se (AAF cofactor-dependientes). No obstante, los AAF pueden acompañar a multitud de otros procesos, como infecciones (virus de la inmunodeficiencia humana, hepatitis C, citomegalovirus), trastornos linfoproliferativos, uso de fármacos (clorpromazina, fenitoína, hidralacina, procainamida, tiazidas, anti-TNFα) o hemodiálisis, circunstancias en las que suele tratarse de anticuerpos IgM presentes en bajas concentraciones, dirigidos contra verdaderas estructuras fosfolipídicas (AAF cofactor-independientes) y que no se asocian con eventos trombóticos. También se han descrito AAF en el 5-10% de los donantes de sangre, aunque este porcentaje se reduce a menos del 2% si consideramos sólo a los sujetos con títulos persistentemente positivos.
En un estudio retrospectivo reciente de 128 pacientes con SAFP se observó que sólo el 14% desarrollaron un LES o una enfermedad similar al lupus después de un periodo de seguimiento medio de 8 años.
Detección de anticuerpos antifosfolípido en el laboratorio
En la práctica clínica los AAF que se detectan en todos los laboratorios son los anticuerpos anticardiolipina (ACL) y el anticoagulante lúpico (AL). Probablemente en el futuro inmediato se deba incluir la medición de los anticuerpos anti-beta-2-glucoproteína I.
Los ACL, bien sean del isotipo IgM o IgG, se detectan mediante una técnica de ELISA. Los resultados se expresan en unidades MPL y GPL, respectivamente, de una forma semicuantitativa como negativos (<10 GPL o MPL), positivos débiles (10-40 GPL o MPL), positivos medios (40-80 GPL o MPL) o positivos altos (>80 GPL o MPL). Sólo los valores a partir de positivo medio (>40 GPL o MPL) se incluyen actualmente en los criterios diagnósticos de SAF. Hay que señalar que todavía existe controversia y falta de consenso sobre qué valores de ACL se deben considerar como positivos a efectos diagnósticos. Cifras que oscilan entre 20 y 40 GPL o MPL obligan a descartar otras causas de trombofilia, antes de aceptarse como diagnósticas.
La detección de AL se efectúa mediante técnicas coagulométricas funcionales que ponen de manifiesto la presencia de anticuerpos dirigidos contra la fracción fosfolipídica del complejo activador de la protrombina. Para asegurar la presencia de AL se deben cumplir las siguientes 4 condiciones (Fig. 1):
Fig. 1: Detección del anticoagulante lúpico en el laboratorio
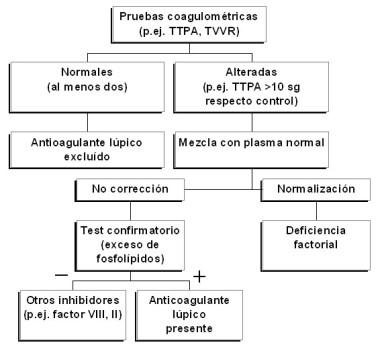
1) Prolongación de al menos un tiempo de coagulación dependiente de fosfolípidos en el plasma del paciente objeto de diagnóstico. Para demostrar este extremo se pueden utilizar diversas pruebas, capaces de evaluar la vía intrínseca de la coagulación (tiempo de tromboplastina parcial activada -TTPA-, tiempo de tromboplastina parcial activada diluida, tiempo de coagulación con caolín), la vía extrínseca (tiempo de protrombina diluido), o la vía final común (tiempo del veneno de víbora de Russell diluido –TVVR-, tiempo de textarina y ecarina, tiempo de veneno de Taipan). La ausencia de una prolongación del TTPA (>10 sg respecto al control), el test más empleado, no excluye la existencia de un AL si se utiliza un reactivo poco sensible a los AAF. En tales circunstancias recurriremos a otra prueba de coagulación que evalúe una porción distinta de la cascada enzimática (p.ej. TVVR).
2) Fallo para corregir el tiempo de coagulación prolongado, después de mezclar el plasma del paciente con plasma normal (relación 1:1). Con ello se excluyen deficiencias de factores de la coagulación, contenidos en el plasma normal.
3) Acortamiento o corrección del tiempo de coagulación prolongado tras la adición de un exceso de fosfolípidos sintéticos o procedentes de un lisado plaquetario (prueba confirmatoria).
4) Exclusión de otras coagulopatías si el test confirmatorio es negativo (p.ej. inhibidores del factor VIII o del factor II). Paradójicamente, el AL prolonga los tiempos de coagulación in vitro, pero promueve la formación de coágulos in vivo.
Dado que en un 35% de los pacientes no coexisten los ACL y el AL (es decir, tienen un subtipo de anticuerpo u otro), es necesaria la realización de ambas pruebas para descartar fehacientemente la existencia de AAF. A diferencia de los ACL, la prueba de AL no es valorable en pacientes que estén sometidos a tratamiento anticoagulante; deberán haber transcurrido al menos 2 semanas desde la finalización de este último. Por otro lado, en algunos sujetos el AL también puede alterar ligeramente el tiempo de protrombina, lo cual repercutiría sobre el valor del INR (parámetro que se evalúa durante el tratamiento con dicumarínicos). También es posible que la existencia de anticuerpos anti-protrombina provoque un déficit funcional de esta proteína, circunstancia que generalmente se observa en asociación con AL. Cuando ello deriva en un sangrado significativo, a esta rara entidad la denominamos síndrome de AL-hipoprotrombinemia.
Con menor frecuencia, en los pacientes con AAF se puede constatar la existencia de una serología luética falsamente positiva. Esto significa que la prueba reagínica es positiva, debido a que VDRL o RPR utilizan una mezcla de fosfolípidos como substrato, pero la prueba treponémica específica es negativa.
Manifestaciones clínicas
Los AAF, bien por su interacción con el endotelio vascular, con las plaquetas o por interferir con los complejos de proteínas y fosfolípidos que regulan la coagulación, promueven el desarrollo de trombosis. Este riesgo parece mayor en los sujetos que exhiben AL que en aquellos que sólo poseen ACL, especialmente si los títulos no son muy altos. Se ha estimado que el 50% de pacientes con LES y AAF desarrollan un SAF después de un periodo de observación de 20 años.
Trombosis vasculares
El SAF constituye uno de los estados de hipercoagulabilidad en los que puede producirse tanto trombosis venosas como arteriales. Los estudios poblaciones muestran que el SAF y la resistencia a la proteína C activada (factor V de Leiden) son las causas más comunes de trombofilia, representando cada una el 20% de los casos de trombosis recurrente en gente joven. El SAF y las trombofilias genéticas son proporcionalmente menos frecuentes en personas de más de 65 años, donde la edad, la arteriosclerosis y el cáncer son causas más habituales de trombosis.
Las trombosis venosas profundas, especialmente de las extremidades inferiores, son la manifestación más común del SAF y, en la mitad de los casos, se acompañan de embolismos pulmonares. Las trombosis arteriales son menos frecuentes que las venosas; en cerca del 50% de casos afectan a la circulación cerebral (accidente isquémico transitorio o ictus), en el 25% a la coronaria (angina, infarto de miocardio) y en otro 25% a otros territorios como el cutáneo (úlceras, gangrena digital), retiniano o renal. Los episodios trombóticos relacionados con el SAF pueden tener lugar en lechos vasculares que se afectan infrecuentemente en otros estados protrombóticos y tienen tendencia a recurrir en el mismo sistema vascular (arterial o venoso) que el evento original.
Se debe tener en cuenta que no todos los episodios de isquemia arterial o infarto tienen un origen trombótico. Las embolias, procedentes de vegetaciones mitrales o aórticas, también son causa de ictus. De hecho, las anomalías valvulares cardiacas detectadas por ecocardiografía son muy frecuentes en pacientes con SAF (30-70%), aunque la mayoría de ellas tienen escasa trascendencia clínica. Suele tratarse de regurgitaciones que afectan a la válvula mitral o menos frecuentemente, aórtica. Las vegetaciones sobre dichas válvulas sólo se han descrito en el 4% de pacientes con SAF.
Los sujetos con SAF pueden desarrollar trombosis agudas o crónicas en la microcirculación (capilares, arteriolas, vénulas), que ocasionan una pérdida aguda o lentamente progresiva de la función de un órgano (p.ej. riñón). De hecho, en dos terceras partes de los pacientes con SAF asociado a LES se detecta nefropatía microtrombótica, que se manifiesta clínicamente como hipertensión arterial e insuficiencia renal. Una microangiopatía trombótica diseminada es la característica fundamental del llamado SAF “catastrófico”, como se describirá más adelante.
Morbilidad gestacional
Aproximadamente un 15% de las mujeres con abortos durante los períodos preembriónico (< 6 semanas de gestación) y embriónico (6 a 9 semanas de gestación) tienen un SAF. Las pérdidas durante estas fases precoces de la gestación son comunes en la población general. Más características del SAF son las pérdidas fetales (>10 semanas de gestación) y los nacimientos prematuros, que se han relacionado con insuficiencia uteroplacentaria debida a trombosis localizada y quizás a una interferencia de los AAF con la anexina V (proteína anticoagulante placentaria) o con la propia invasión del trofoblasto.
Otras manifestaciones clínicas
Son también manifestaciones prominentes del SAF (~20%) la trombocitopenia, la anemia hemolítica y la livedo reticularis. Se utiliza el término de síndrome de Sneddon para designar la combinación de livedo reticularis e ictus, si bien los pacientes con este síndrome pueden no tener AAF. La presencia de livedo reticularis parece relacionarse también con un mayor riesgo de disfunción cognitiva en sujetos con SAF. La trombocitopenia no protege contra el desarrollo de eventos trombóticos.
Síndrome antifosfolipídico catastrófico
El término SAF “catastrófico” define una forma aguda y devastadora de SAF caracterizada por oclusiones vasculares múltiples y simultáneas que ocasionan un fracaso multiorgánico. Estos pacientes tienen en común: 1) evidencia clínica de afectación de múltiples órganos en un período inferior a una semana, 2) evidencia histopatológica de oclusión de pequeños vasos en al menos un órgano o tejido (una minoría tienen también trombosis de grandes vasos), y 3) confirmación de la presencia de AAF en el laboratorio.
Afortunadamente se trata de una variedad infrecuente de SAF (<1%), con una mortalidad, a pesar del tratamiento, del 50%. En más de la mitad de los casos se identifica un factor precipitante, por lo común una infección y, en menor medida, un procedimiento quirúrgico o el embarazo. La gran mayoría de estos pacientes se encuadran dentro de un SAFP. Los órganos más comúnmente afectados son por orden decreciente: riñón (hipertensión maligna), pulmón (distrés respiratorio, embolias pulmonares), cerebro (encefalopatía, infartos, convulsiones), piel (púrpura, livedo, necrosis cutánea), corazón (infarto, valvulopatía) y glándulas suprarrenales (insuficiencia suprarrenal aguda).
Diagnóstico
Como en otras enfermedades autoinmunes se han postulado una serie de criterios clínicos y de laboratorio que permiten clasificar a los pacientes con SAF. En la práctica se utilizan los reseñados en la Tabla 1. Sólo en aquellos pacientes con ACL IgG o IgM o AL negativos en los que se sospecha fuertemente un SAF se debería determinar la concentración de anticuerpos anti-beta-2-glucoproteína I o los ACL del isotipo IgA. Los AAF se pueden consumir durante un episodio trombótico agudo, por lo que es prudente medirlos 6 semanas después del mismo si resultaron inicialmente negativos. Asimismo, cualquier resultado positivo de AAF exige una confirmación al cabo de 3 meses para descartar que no se trate de un fenómeno transitorio, como el que se observa en asociación con determinadas infecciones virales.
Tabla 1: Criterios de clasificación del síndrome antiifosfolipídico
|
Criterios clínicos |
|
Criterios de laboratorio |
El diagnóstico de SAF exige al menos un criterio clínico y otro de laboratorio. La presencia de AAF se debe verificar en ³2 ocasiones con un intervalo de al menos 12 semanas
Diagnóstico diferencial
Se deben incluir en el diagnóstico diferencial del SAF otras enfermedades sistémicas (neoplasias, síndrome nefrótico, policitemia, trombocitosis), el uso de anticonceptivos orales o estados de trombofilia congénitos que predisponen al desarrollo de eventos trombóticos. El SAF, la homocisteinemia y la mutación 20210 del gen de la protrombina favorecen tanto las trombosis venosas como arteriales, mientras que el factor V de Leiden o las deficiencias de proteína C, proteína S o antitrombina III generalmente se manifiestan con trombosis venosas.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.