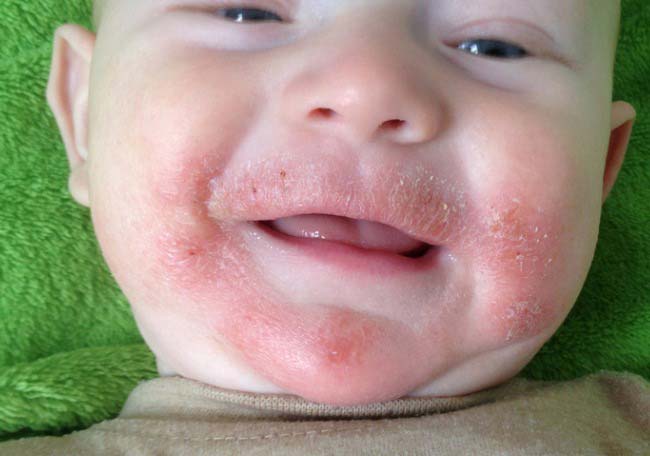
Dupilumab en niños con dermatitis atópica no controlada
|
Aspectos destacados
|
Resumen
Antecedentes
Los tratamientos sistémicos actuales para niños menores de 6 años con dermatitis atópica de moderada a grave que no se controlan con terapias tópicas pueden tener una eficacia y seguridad subóptimas. Dupilumab está aprobado para niños mayores y adultos con dermatitis atópica y para otras afecciones inflamatorias de tipo 2. El objetivo fue evaluar la eficacia y la seguridad de dupilumab con corticosteroides tópicos de baja potencia concomitantes en niños de 6 meses a menores de 6 años con dermatitis atópica de moderada a grave.
Métodos
Este ensayo de fase 3, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, se llevó a cabo en 31 hospitales, clínicas e instituciones académicas de Europa y América del Norte. Los pacientes elegibles tenían entre 6 meses y menos de 6 años de edad, con dermatitis atópica de moderada a grave (puntuación de 3 a 4 en la Evaluación global del investigador [IGA]) diagnosticada de acuerdo con los criterios de consenso de la Academia Estadounidense de Dermatología, y una respuesta inadecuada a los tratamientos tópicos con corticosteroides.
Los pacientes fueron asignados aleatoriamente (1:1) a placebo subcutáneo o dupilumab (peso corporal ≥5 kg a <15 kg: 200 mg; peso corporal ≥15 kg a <30 kg: 300 mg) cada 4 semanas más corticosteroides tópicos de baja potencia (hidrocortisona crema al 1% de acetato) durante 16 semanas. La aleatorización se estratificó por edad, peso corporal inicial y región. La asignación de pacientes se realizó a través de un sistema de respuesta web interactivo central y la asignación de tratamientos se enmascaró.
El criterio principal de valoración en la semana 16 fue la proporción de pacientes con una puntuación IGA de 0 a 1 (piel limpia o casi limpia). El criterio de valoración secundario clave (criterio de valoración coprimario para la UE y el mercado de referencia de la UE) en la semana 16 fue la proporción de pacientes con una mejora de al menos un 75 % desde el inicio en el índice de gravedad y área del eccema (EASI-75).
Los análisis primarios se realizaron en el conjunto de análisis completo (es decir, todos los pacientes asignados aleatoriamente) y los análisis de seguridad se realizaron en todos los pacientes que recibieron cualquier fármaco del estudio. Este estudio se registró en ClinicalTrials.gov, NCT03346434.
Resultados
Entre el 30 de junio de 2020 y el 12 de febrero de 2021, se evaluó la elegibilidad de 197 pacientes, 162 de los cuales fueron asignados al azar para recibir dupilumab (n=83) o placebo (n=79) más corticosteroides tópicos.
En la semana 16, significativamente más pacientes en el grupo de dupilumab que en el grupo de placebo tenían IGA 0–1 (23 [28 %] frente a tres [4 %], diferencia 24 % [IC 95 % 13–34]; p<0· 0001) y EASI-75 (44 [53%] vs ocho [11%], diferencia 42% [IC 95% 29-55]; p<0·0001).
La prevalencia general de eventos adversos fue similar en el grupo de dupilumab (53 [64 %] de 83 pacientes) y en el grupo de placebo (58 [74 %] de 78 pacientes).
La incidencia de conjuntivitis fue mayor en el grupo de dupilumab (cuatro [5 %]) que en el grupo de placebo (ninguno). Ningún evento adverso relacionado con dupilumab fue grave o provocó la interrupción del tratamiento.
Interpretación
Dupilumab mejoró significativamente los signos y síntomas de la dermatitis atópica en comparación con el placebo en niños menores de 6 años. Dupilumab fue bien tolerado y mostró un perfil de seguridad aceptable, similar a los resultados en niños mayores y adultos.
Comentarios
El primer estudio para tratar el eccema de moderado a grave en bebés y niños de 6 meses a 5 años con un fármaco biológico (anticuerpo monoclonal) en lugar de medicamentos inmunosupresores muestra que el fármaco fue muy eficaz para reducir los signos y síntomas de eccema de moderado a grave, informan los investigadores que participan en un nuevo estudio internacional de fase III en varios sitios dirigido por Northwestern Medicine.
Un curso de 16 semanas de dupilumab, un medicamento que se dirige a una vía inmunitaria clave en las alergias, dio como resultado que más de la mitad de los niños tuvieran al menos una reducción del 75 % en los signos de eczema y reducciones muy significativas en la picazón con una mejoría del sueño.
Este es el primer ensayo a gran escala, aleatorizado y controlado con placebo de un anticuerpo monoclonal en cualquier enfermedad de la piel, incluido el eczema, en niños de hasta 6 meses. El estudio, que incluyó 31 sitios en Europa y América del Norte, se publicó en The Lancet.
“Los niños en edad preescolar que se rascan constantemente, se despiertan varias veces por la noche con sus padres, están irritables y tienen una capacidad marcadamente limitada para hacer lo que otros niños de su edad pueden hacer y mejoran en la medida en que duermen toda la noche, cambian de personalidad y tienen un comportamiento normal. vida, como deberían hacerlo los bebés y los niños”, dijo la autora principal del estudio, la Dra. Amy Paller, presidenta de dermatología en la Facultad de Medicina Feinberg de la Universidad Northwestern y médica asistente en el Hospital Pediátrico Ann & Robert H. Lurie de Chicago.
Comentarios
Para ver los comentarios de sus colegas o para expresar su opinión debe ingresar con su cuenta de IntraMed.